Г. В. Плеханова (технический университет) к афедра общей и физической химии общая химия Сборник задач
 Скачать 2.09 Mb. Скачать 2.09 Mb.
|
5.6. Равновесия в насыщенных растворахНасыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора. Рассмотрим равновесие между солью, состоящей из катионов металла Mz+ и анионов кислотного остатка Az, и ее насыщенным раствором. При этом учтем, что все соли - сильные электролиты, полностью диссоциирующие в растворе.
Константу данного равновесия называют произведением растворимости соли и обозначают L. Запишем ее выражение согласно закону действующих масс:
Выражение (97) используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости обычно берут в справочнике. 5.6.1. Растворимость в бинарной системе соль - водаВ этом случае, согласно уравнению (96), Mz+ = +S и Az = S. Подставим эти соотношения в (97). L = (+S)+(S) = (S), где = (++)1/, а = + + Отсюда получаем формулу для расчета растворимости соли в воде:
5.6.2. Растворимость в многокомпонентной системе с одноименными ионамиРассмотрим расчет растворимости соли М+А в системе, содержащей хорошо растворимую соль МА с одноименным анионом. Пример такой системы: BaSO4–Na2SO4–H2O. Катионы Mz+ переходят в раствор только из осадка, поэтому их концентрация определена растворимостью: Mz+ = +S. Концентрация анионов в растворе складывается из двух составляющих: растворимость труднорастворимой соли S, и концентрация соли М, которую обозначим С. После подстановки в формулу (97) получаем:
Растворимость находят путем решения степенного уравнения (99). Если растворимость меньше концентрации соли с одноименным ионом в 100 и более раз, то есть S 0,01C, то пренебрегают в сумме меньшим слагаемым и получают:
Аналогично вычисляют растворимость в присутствии одноименного катиона. Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается. 5.6.3. Условия образования осадковЕсли произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, то есть правая часть в формуле (97) больше левой, то в системе будет происходить образование осадка. При противоположном знаке неравенства осадок будет растворяться. Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют следующие формулы:
Из формулы (102) находят концентрацию ионов гидроксила, а затем рН гидратообразования. |

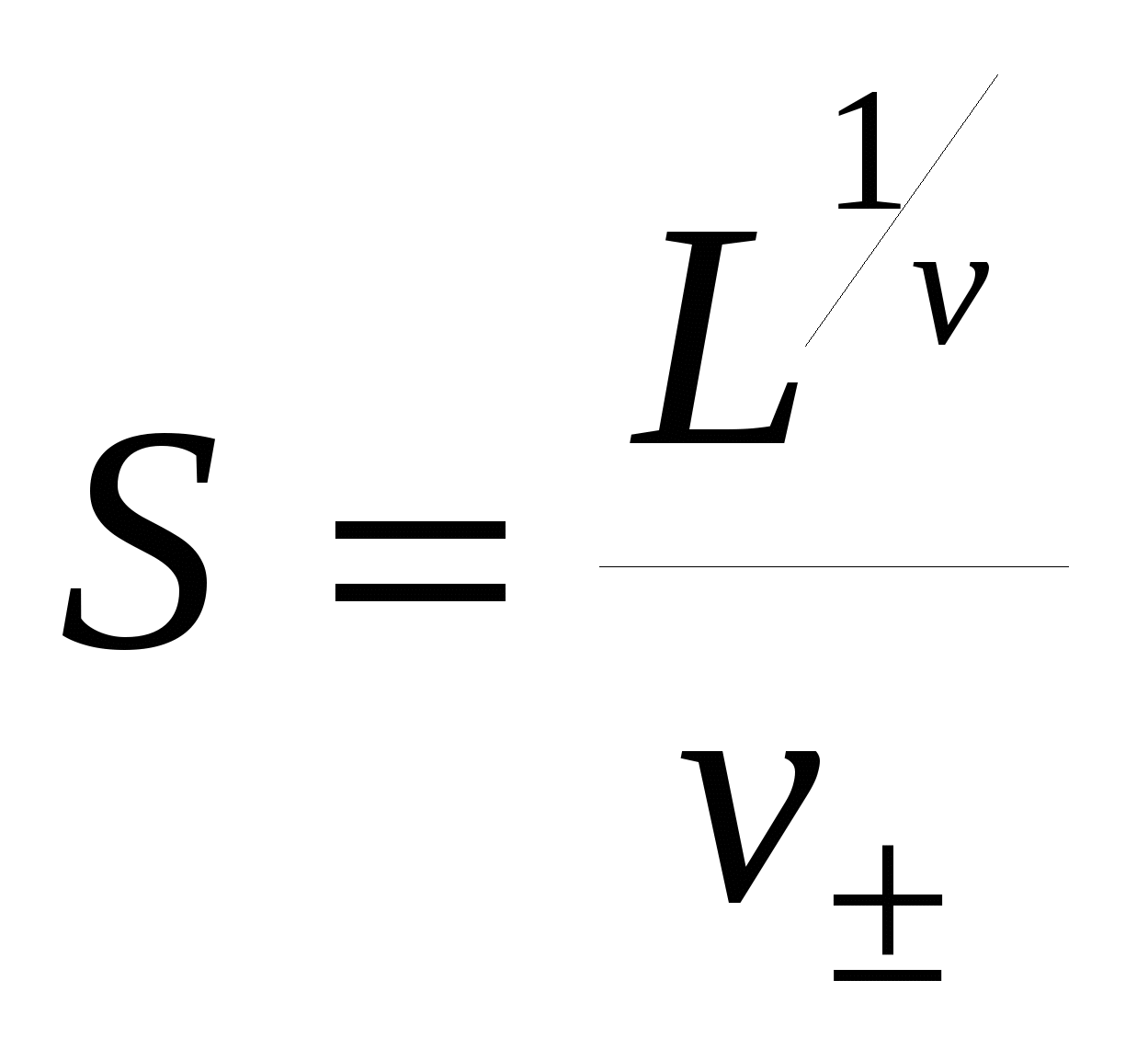 .
.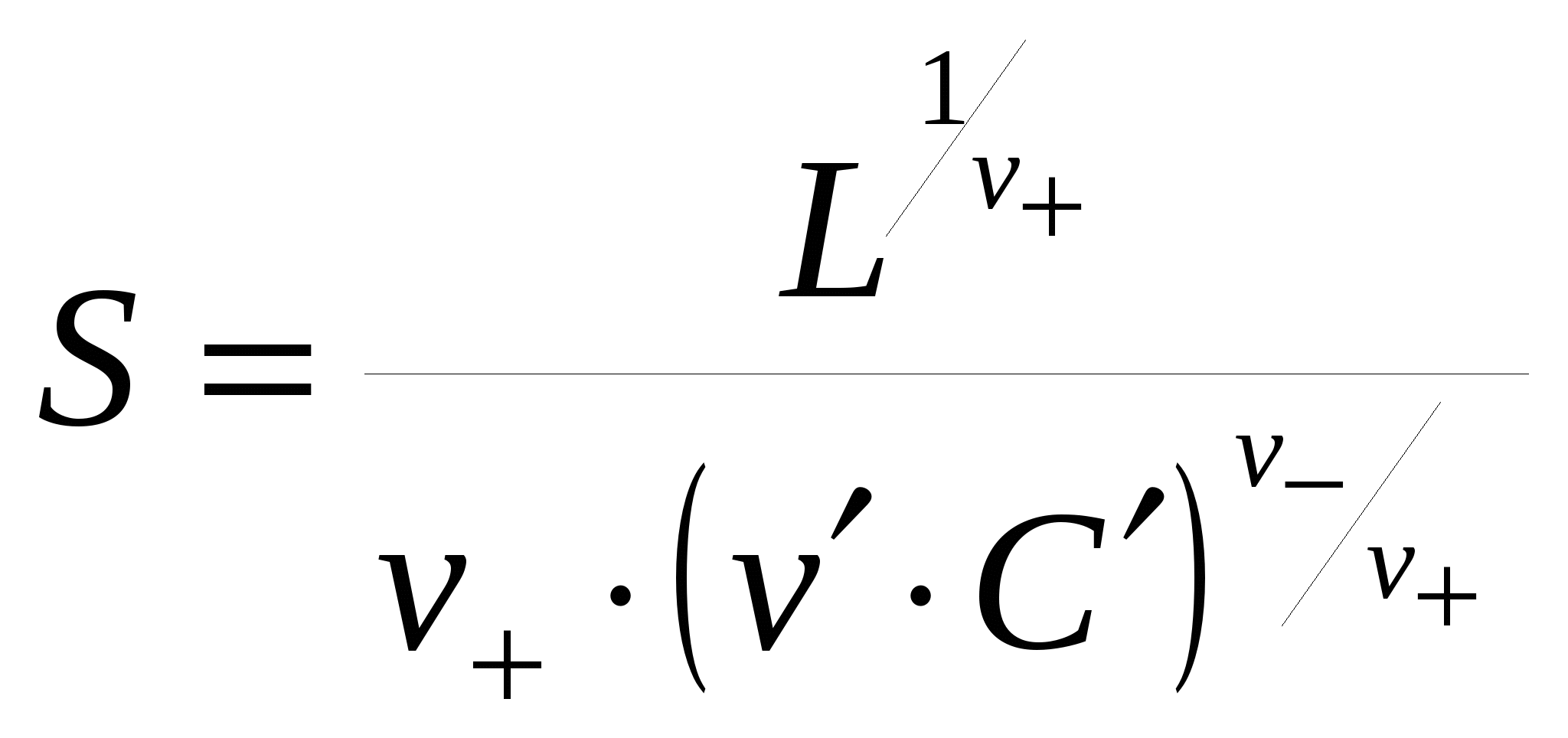 .
.