Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
|
120 ГЛАВА 6
последовательность из шести-восьми нуклеотидов (например, UAAGGAGG), спаривающаяся с комплементарной последовательностью (в данном случае AUUCCUCC) РНК-компонента (рРНК) малой субъединицы рибосомы. Обычно чем прочнее связывание между мРНК и рРНК, тем выше эффективность инициации трансляции. Именно поэтому большинство экспресси-рующих Е. сoli-векторов конструируют таким образом, чтобы мРНК клонированного гена обязательно содержала сильный сайт связывания рибосомы. Это необходимое условие трансляции гетерологичных про- и эукариотических генов в E. coli. Однако должны соблюдаться и некоторые другие условия. Во-первых, нуклеотидная последовательность, связывающаяся с рРНК, должна находиться на определенном расстоянии от старт-кодона клонированного гена (в РНК старт-кодоном является AUG; в ДНК ему соответствует кодон ATG). Во-вторых, участок ДНК, содержащий сайт связывания рибосомы и несколько первых кодонов клонированного гена, не должен иметь такую нуклеотидную последовательность, при которой после транскрипции может произойти вну-трицепочечное спаривание (рис. 6.13), нарушающее связывание мРНК с рибосомой. Именно локальная вторичная структура мРНК, обеспечивающая экранирование или, напротив, экспонирование сайта связывания рибосомы, и определяет прочность связывания мРНК с комплементарной рРНК. Таким образом, при клонировании любого гена важно убедиться в том, что сайт связывания рибосомы расположен на нужном расстоянии от этого гена и что вторичная структура мРНК не помешает его присоединению к рибосоме. Уже создано большое количество векторных систем, которые включают как транскрипционный, так и трансляционный сигналы, обеспечивающие экспрессию клонированных эукариотических генов в E. coli. Одной из таких систем Оптимизация экспрессии генов, клонированных в прокариотических системах 121
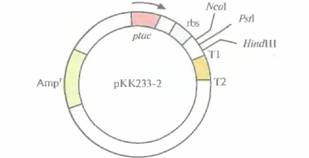
является экспрессирующий вектор рКК233-2, содержащий следующие элементы (рис. 6.14): • селективный маркер устойчивости к ампициллину • tec-промотор • lacZ-участок связывания рибосомы • старт-кодон ATG, расположенный на расстоянии восьми нуклеотидов от сайта связывания рибосомы • сайты терминации транскрипции Т1 и Т2 фага λ. Клонируемый ген встраивают в NcoI-, PstI-или HindIII-сайт, расположенный между сайтом связывания рибосомы и сайтами терминации транскрипции. Если его рамка считывания не попадает «в ногу» с кодоном AUG, то необходимо произвести минимальную коррекцию. В этом случае после индукции и транскрипции происходит достаточно эффективная трансляция клонированного гена. Однако следует иметь в виду, что поскольку нуклеотидная последовательность, кодирующая N-концевой участок белка-мишени, у разных клонированных генов неодинакова, нельзя создать универсальный вектор, исключающий одноцепочечное спаривание мРНК при любых обстоятельствах. Поэтому ни одна из областей инициации трансляции, как бы она ни была оптимизирована, не может га- рантировать эффективность трансляции всех клонированных генов. Таким образом, описанные выше экспрессирующие векторы - это только основа для создания оптимальной системы трансляции. Эффективной трансляции может препятствовать и «несовместимость» клеток, обусловленная тем, что в клонируемом гене имеются кодоны, редко встречающиеся в геноме организма-хозяина. В таких случаях в хозяйской клетке может не доставать транспортных РНК (тРНК), узнающих редко используемые кодоны, что снижает выход продукта клонированного гена. Как решить эту проблему — не совсем понятно. Если продукт клонированного гена очень ценен, можно попытаться химически синтезировать такой вариант клонируемого гена, который состоит из кодонов, обычно используемых хозяйским организмом (оптимизация кодонов). | |||||||||