Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
Химерные белкиОчень часто чужеродные белки, особенно небольшие, обнаруживаются в гетерологичных хозяйских клетках лишь в минимальных количествах. Такой кажущийся низкий уровень экспрессии кодирующих их генов во многих случаях объясняется деградацией чужеродных белков в хозяйских клетках. Один из способов решения этой проблемы состоит в ковалентном присоединении продукта клонированного гена к какому-нибудь стабильному белку клетки-хозяина. В составе подобной конструкции, получившей название «химерный белок», продукт клонированного гена оказывается защищенным от расщепления протеазами хозяйской клетки, что было показано в ходе экспериментов. Слияние белков программируется на уровне ДНК лигированием кодирующих участков соответствующих генов. В самом простом виде векторная система слияния предусматривает включение гена-мишени или его сегмента в кодирующий участок клонированного гена-хозяина. Очень важно, чтобы РНК. транскрибируемая с клонированного гена-мишени, имела правильную нуклеотидную последовательность, обеспечивающую образование продукта клонированного гена. Если при объединении сегментов ДНК происходит изменение рамки считывания, т. е. последовательность колонов детерминирует укороченный или неправильный трансляционный продукт, то не сможет образоваться и функционально активная форма белка. Убедиться в правильности рамки считывания можно разными способами. Как правило, для этого необходимо знать точную нуклеотидную последовательность лигируемых фрагментов ДНК, Расщепление химерных белковВ зависимости от предназначения белкового продукта клонированного гена он может использоваться как таковой или в составе химерного белка, причем последний вариант встречается нечасто. Например, из-за присутствия фрагмента хозяйского белка большинство химерных белков оказываются непригодными для применения в клинике, а сам продукт клонированного гена-мишени может оказаться неактивным. Кроме того, для химерных белков предусмотрена более сложная процедура тестирования, которую они должны пройти, чтобы получить разрешение к применению у соответствующих организаций. Все это заставляет искать способы удаления лишних аминокислотных последовательностей из молекулы получаемого продукта. Один из таких способов основан на присоединении белка, кодируемого геном-мишенью, к белку клетки-хозяина, содержащему короткий пептид, распознаваемый специфической протеазой небактериального происхождения. Такое присоединение тоже программируется на уровне ДНК. Олигонуклеотидные линкеры, несущие сайты для протеаз. можно пришить к клонированному гену до того, как такая конструкция будет введена в экспрессирующую векторную систему слияния. Линкером может служить, например, олигонуклеотид, кодирующий пептид Ile-Glu-Gly-Arg. После синтеза и очистки химерного белка для отделения белкового продукта, кодируемого клонированным геном, можно использовать фактор свертывания крови Ха, который является специфической протеиназой, разрывающей пептидные связи исключительно на С-конце последовательности Ile-Glu-Gly-Arg (рис. 6,6). Более того, поскольку такой пептид Оптимизация экспрессии генов, клонированных в прокариогических системах 113
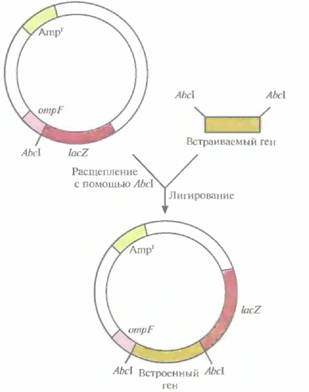
встречается в природных белках довольно редко, этот подход можно использовать для отделения многих других продуктов, кодируемых клонированными генами. Применение химерных белковВ некоторых случаях конечным продуктом, который предполагается использовать, является сам химерный белок. Например, нередко возникает необходимость в получении антител, узнающих конкретный участок белковой молекулы. Чтобы решить эту задачу, можно встроить в подходящий вектор сегмент ДНК, кодирующий белковый домен, к которому будут вырабатываться нужные антитела. Образующийся в результате химерный белок и будет служить антигеном. Антитела к стабилизирующему его белковому компоненту, происходящему от хозяйской клетки, можно удалить абсорбцией их на чистом стабилизирующем белке, и тогда останутся только антитела, связывающиеся с нужной аминокислотной последовательностью. Один из клонирующих векторов системы слияния, сконструированных для получения специфических антител, содержит 5'-концевой сегмент гена ompF E. coli, кодирующего один из наружных мембранных белков, и прилегающую к нему часть гена lacZ (ß-галактозидазы) E. coli (рис. 6.7). Этот сегмент содержит информацию, необходимую для инициации транскрипции и трансляции химерного гена, а также для секреции химерного белка. Несмотря на то что укороченный ген lacZ, лишен кодонов для первых восьми аминокислот, кодируемый им белок сохраняет ферментативную активность. В такой форме ß-галактозидаза способна функционировать независимо от того, какие пептиды присоединены к ее N-концу. Ген lacZ встроен в вектор таким образом, что он попадает «не в ногу» с рамкой считывания лидерной последовательности ompF, поэтому активная ß-галактозидаза не образуется. Однако если рамка считывания какого-либо клонированного фрагмента ДНК согласуется с таковой для генов ompFиLacZ, то образуется трех компонентны и химерный белок, состоящий из OmpF-фрагмента, белка, кодиру-
114 ГЛАВА 6
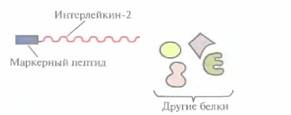
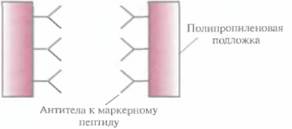
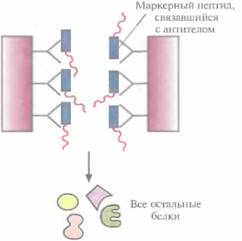
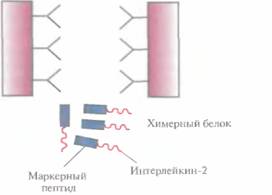
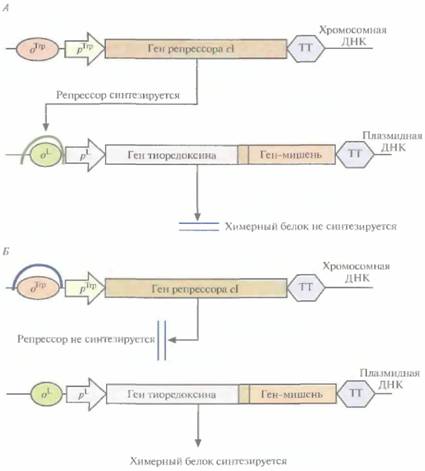
емого клонированным геном, и функционально активной С-концевой части ß-галактозидазы. Он может использоваться как антиген для выработки антител, дающих перекрестную реакцию с белком клонированного гена, или как инструмент для получения небольших фрагментов специфических белков. Химерные белки используются не только для стабилизации полипептидов, но и для упрощения процедуры очистки рекомбинантных белков (табл. 6.3). Так, плазмидная конструкция Saccharomycescerevisiae, содержащая ген человеческого интерлейкина-2 с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид Asp-Туг- Lys-Asp-Asp-Asp-Asp-Lys (он продается под названием Flag), выполняет двоякую функцию: обеспечивает стабилизацию продукта гена интерлейкина-2 и облегчает его очистку. Интерлейкин-2 — это биологический фактор, стимулирующий рост Т-клеток и синтез В-клеточных антител. Химерный белок, образующийся после экспрессии этой генетической конструкции в дрожжевых клетках, может быть очищен за один прием с помощью иммуноаффинной хроматографии. Для этого моноклональные антитела к маркерному пептиду фиксируют на полипропиленовом носителе и пропускают через колонку химерный белок, который связывается с этими антителами (рис. 6.8). Маркерный пептид — небольшая молекула, на его образование расходуется лишь малая часть клеточных ресурсов. Химерный белок обладает такой же биологической активностью, что и нативный интерлейкин-2. Однако если он предназначен для применения в клинике, то маркерный пептид необходимо удалить. Таковы требования государственных служб, контролирующих использование фармацевтических препаратов. Для этого можно использовать бычью энтерокиназу. Многие белки, продуцируемые Е. соli, накапливаются в клетках в форме нерастворимых биологически неактивных телец включения. И хотя из таких структур часто удается получать в небольших количествах биологически активный белок, для этого приходится проводить продолжительную солюбилизацию. Плохая растворимость белков in vivo часто обусловливается их неправильной укладкой, и эту проблему пытались решить различными способами. Так, известно, что химерные белки, одним из компонентов которых является тиоредоксин, белок мол, массой 11,7 кДА, остаются в растворе, даже если на их долю приходится 40% суммарного клеточного белка. Имея это в виду, ген-мишень встроили в полилинкер сразу вслед за геном тиоредоксина, так чтобы оба этих гена попали под контроль pL-npoмотора в плазмидном векторе E. соli (рис. 6.9). В хромосоме хозяйских клеток E. соli, использующихся в этой системе, присутствует генетическая конструкция, детерминирующая образование репрессора cI — копия гена cI, находящаяся под транскрипционным контро- Оптимизация экспрессии генов, клонированных в прокариотических системах 115
лем промотора trp. В отсутствие триптофана (рис. 6.9, А) репрессор образуется в количестве, достаточном для блокирования транскрипции с pL-промотора, и химерный белок не синтезируется. Когда в среду добавляют триптофан (рис. 6.9, Б), trp- промотор выключается и белок-репрессор не синтезируется, а гены химерного белка транскрибируются с плазмидного pL-промотора. Синтезируемый химерный белок, состоящий из тио-редоксина и белка-мишени, концентрируется в основном в особых областях с внутренней стороны плазматической мембраны Е. соli, называемых зонами адгезии, и высвобождается из клеток при осмотическом шоке. Далее белок-мишень можно отщепить от химерного белка с помощью энтерокиназы. Химерный белок, содержащий тиоредоксин, можно очистить еще одним способом. Если белок-мишень остается стабильным лри повышении температуры, то, поскольку тиоредоксин не разрушается при нагревании вплоть до 80 °С, химерный белок можно инкубировать при высоких температурах и освободиться от большинства других клеточных белков, разрушающихся при этих условиях. Включение белков в поверхностные структурыДля скрининга обширных (до 5-1010 клонов) библиотек комплементарных ДНК (кДНК), кодирующих редко встречающиеся белки, были разработаны специальные системы слияния. Обьгчно кДНК встраивают в гены поверхностных белков (белков филаментов или пилей) нитчатых бактериофагов (например, М13) или бактерий и после транскрипции и трансляции получают химерные белки, входящие в состав поверхностных структур этих микроорганизмов. Здесь их идентифицируют иммунологическими методами. Часто для слияния используют ген поверхностного белка pIII фага М13, который связывается с F-пилями Е. coliи инициирует инфекцию. Для клонирования кДНК и других 116 ГЛАВА 6
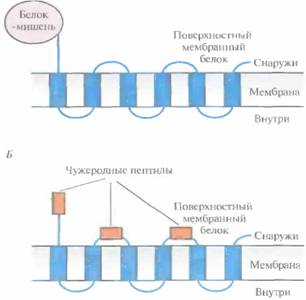
кодирующих последовательностей была сконструирована плазмида (фагмида), содержащая небольшой фрагмент ДНК M13, который обеспечивал ее упаковку in vitro в фаговые частицы. ген белка pIII под контролем какого-нибудь регулируемого бактериального промотора (например, lac-промотора Е. coli) и сайт клонирования вблизи 5'-конца гена рIII. После репликации рекомбинантного фага М13 в E. coli белок-мишень оказывался сшитым с N-концом фагового белка, и содержащие его бляшки можно было идентифицировать иммунологическими методами. Рекомбинантные фагмиды, выделенные из таких бляшек, могут служить источником соответствующей кДНК. Эта весьма эффективная селективная система позволяет обнаруживать кДНК редких, но очень важных белков. Библиотеки, содержащие гены поверхностных бактериальных белков, можно использовать и для идентификации клонов, несущих специфические нуклеотидные последовательности. Чтобы включить искомый белок в поверхностные структуры грамотрицательной бактерии, например E. coli, сшивают его гены и гены белков этой структуры. В качестве бактериальных белков используются белок наружной мембраны А (ОгпрА) и пептидом и кансвязан-ный липопротеин (PAL) E. coli, а также белок F наружной мембраны Pseudomonas aeruginosa (OprF). При этом белок-мишень обычно находится либо на С-, либо на N-конце химерного белка, но иногда короткие полипептиды включаются в середину молекулы бактериального белка (рис. 6.10). Оптимизация экспрессии генов, клонированных в прокариотических системах 117
Системы слияния с локализацией белков-мишеней на поверхности бактериальных клеток можно использовать также для суперпродукции некоторых белков и пептидов. Так, в одной из работ в участок, кодирующий основной белок наружной мембраны Pseudomonasaeruginosa(OprF), был встроен ген антигенного детерминанта возбудителя малярии Plasmodiutnfalciраrит. Бактериальные клетки, синтезирующие соответствующий химерный белок, давали положительную реакцию с моноклональными антителами к P.falciparum. Следовательно, поверхностные химерные белки можно использовать в качестве вакцин (гл. 11). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||