Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
Технология рекомбинантных ДНК 61
При отборе трансформированных клеток руководствуются следующими соображениями. Если клетки, содержащие немодифицированную плазмиду pUC19, выращивать в присутствии изопропил-β-D-тиогалактопиранозида (ИПТГ), который является индуктором lac-оперона, то продукт гена lad не сможет связаться с промоторно-операторной областью гена lacZ', и как следствие будут происходить транскрипция и трансляция плазмидного фрагмента гена lacZ'. Продукт этого фрагмента свяжется с белком, кодируемым хромосомной ДНК, и в результате образуется активная ß-галактозидаза. Последовательность с множеством сайтов рестрикции (полилинкер) встроена в ген lacZ' так, что она не влияет на продукцию функциональной β-галактозидазы, и если в среде присутствует ее субстрат 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (X-Gal), то он будет гидролизоваться под действием этого фермента с образованием продукта синего цвета, окрашивающего колонии клеток, содержащих немодифицированную плазмиду pUC19. Для клонирования в pUC19 донорную ДНК расщепляют одной из рестриктаз, чей сайт находится в полилинкере; плазмидную ДНК гидролизуют такой же рестриктазой, а затем обрабатывают щелочной фосфатазой. Обе ДНК смешивают в присутствии ДНК-лигазы Т4 и используют образовавшийся продукт для трансформации клеток, которые могут синтезировать ту часть ß-галактозидазы (LacZα), которая соединяется с продуктом гена lacZ' с образованием активного фермента. Обработанные клетки высевают на питательную среду с ампициллином, ИПТГ и субстратом для ß-галактозидазы. Нетрансформированные клетки не могут расти в присутствии ампициллина, а клетки, несущие интактную плазмиду, образуют на среде с ампициллином колонии синего цвета. Клетки-хозяева, несущие гибридную плазмиду, образуют на той же самой среде белые колонии, поскольку обычно при встраивании в полилинкер чужеродной ДНК ПРОПУЩЕНА СТР. 62 ПРОПУЩЕНА СТР. 63 64 ГЛАВ А 4 последовательности ДНК. Эту проблему можно решить, используя другую рестриктазу. Следующий после создания библиотеки этап — это поиск клона (клонов), несущего искомую последовательность ДНК. Для этого используют три широко известных метода: гибридизацию с меченым ДНК-зондом с последующим радиоавтографическим анализом, иммунологический скрининг и скрининг по активности белка, кодируемого геном-мишенью. Скрининг с помощью гибридизацииНужную нуклеотидную последовательность в образце ДНК можно обнаружить с помощью ДНК-зонда, спаривающегося только с искомой последовательностью. Для этого ДНК сначала переводят в одноцепочечную форму, подвергнув ее тепловой обработке или воздействию щелочью. В этих условиях водородные связи между основаниями разрываются и цепи расходятся
Технология рекомбинантных ДНК 65
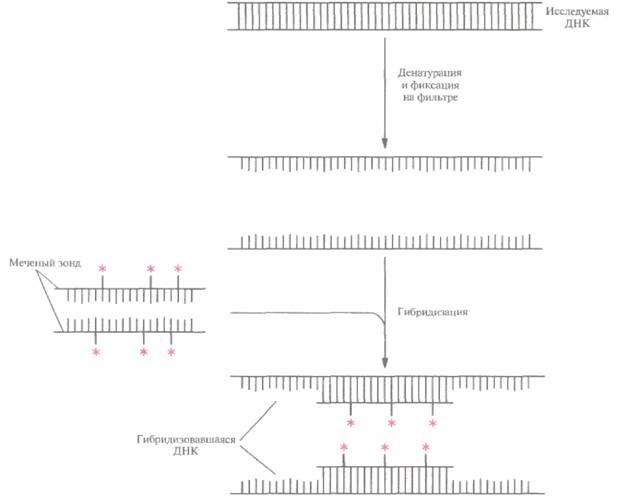
(происходит денатурация). Если теперь медленно снизить температуру, то произойдет их воссоединение (ренатурация). При этом, если в растворе присутствует одноцепочечный ДНК-зонд, он тоже будет ренатурировать с ДНК, специфически спариваясь с комплементарными участками. В результате образуется гибридная ДНК, т. е. двухцепочечная молекула, цепи которой принадлежат двум разным ДНК. Процедура ДНК-гибридизации состоит в следующем. ДНК-мишень подвергают денатурации и одноцепочечные молекулы необратимо «пришивают» к твердой подложке (нитроцеллюлозному или найлоновому фильтру). Эту процедуру обычно проводят при высокой температуре. Затем фильтр инкубируют с одноцепочечным ДНК-зондом, меченным радиоизотопом или другой меткой. Если нуклеотидные последовательности зонда и ДНК-мишени комплементарны, то происходит их спаривание (т. е. гибридизация) (рис. 4.11). Гибридные молекулы можно визуализировать радиоавтографическим (дополнение 4.2) или другим методом, зависящим от природы метки. Если комплементарность между зондом и ДНК-мишенью отсутствует, то гибридизации не происходит, и мы получаем отрицательный результат. Обычно размер зонда варьирует от 100 до 1000 п. н. и более, хотя можно использовать как более крупные зонды, так и зонды меньшего размера. Для гибридизации, т. е. для образования стабильного комплекса, необходимо, чтобы на участке длиной 50 нуклеоти-дов совпадало более 80% из них, но это зависит от условий реакции. Меченые ДНК-зонды можно получить разными способами. Один из них, называемый методом случайных праймеров, основан на применении смеси синтетических олигонуклеотидов (олигомеров), содержащих все возможные комбинации из шести нуклеотидов. Некоторые из этих олигонуклеотидов оказываются комплементарными последовательностям ДНК-мише- 66 ГЛАВА 4
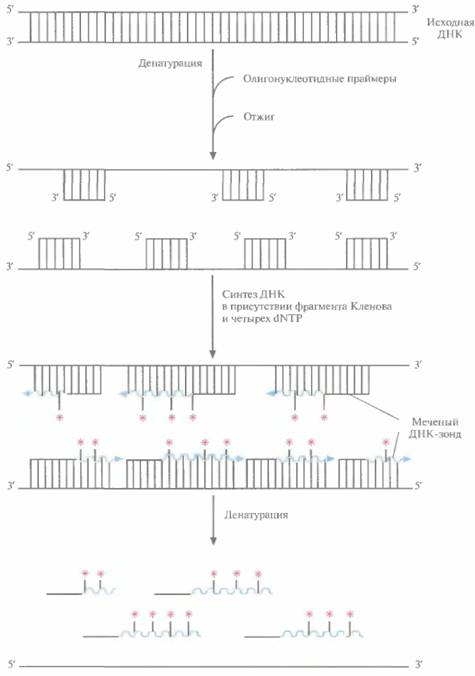
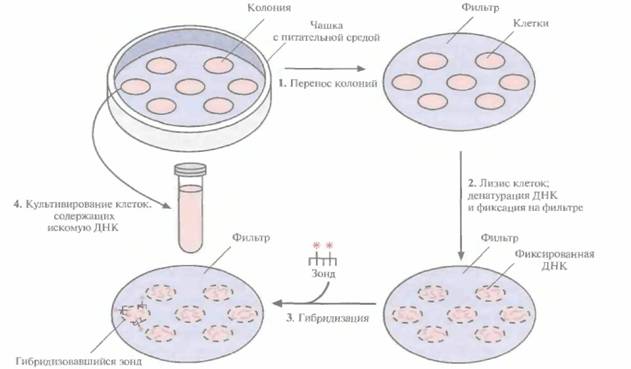
Технология рекомбинантных ДНК 67 ни и гибридизуются с ними, если ДНК предварительно денатурировать (рис. 4.12). После отжига олигонуклеотидов с денатурированной ДНК-матрицей в реакционную смесь добавляют четыре дезоксирибонуклеотида (дезоксирибонуклеозидтрифосфаты; dNTP), один из них — меченый, и фрагмент ДНК-полимеразы 1 Е. соli(фрагмент Кленова). Фрагмент Кленова обладает ДНК-по-лимеразной и 3'-экзонуклеазной активностями, но не 5'-экзонуклеазной активностью, присущей ДНК-полимеразе I E. coli, которая могла бы расщепить новосинтезированные молекулы ДНК, Одиночные цепи ДНК-мишени служат матрицами для синтеза новых молекул ДНК, а связанные с ними случайным образом олигонуклеотиды — затравками (рис, 4,12). При радиоактивном мечении один из dNTP содержит α-32Р, так что 32Р-меченым оказывается и сам зонд. Радиоактивную метку выявляют с помощью радиоавтографии, В качестве нерадиоизотопной метки часто используют биотин, который присоединяют к одному из четырех dNTP. Для выявления гибридизовавшегося биотинилированного зонда на фильтр наносят конъюгат стрептавидина с соответствующим ферментом (например, щелочной фосфатазой). Стрептавидин образует комплекс с биотином, который обнаруживается благодаря тому, что под действием фермента образуется окрашенное или люминесиирующее вещество — продукт превращения нанесенного на фильтр субстрата. Зонды для скрининга геномной библиотеки можно получить по крайней мере двумя способами. Во-первых, можно использовать клонированную ДНК близкородственного организма (гетерологичный зонд). В этом случае условия гибридизации нужно подбирать таким образом, чтобы она могла происходить при существенном расхождении между нуклеотидными последовательностями зонда и искомой ДНК; это позволяет решить проблемы, связанные с заведомым различием между ДНК — источником зонда и исследуемой ДНК, Во-вторых, зонд можно получить методом химического синтеза, основываясь на известной аминокислотной последовательности белкового продукта искомого гена. Скрининг библиотек геномных ДНК обычно проводят по следующей схеме. После трансформации высевают клетки на чашки с питательной средой и переносят выросшие колонии на твердую подложку (например, на нитроцеллюлозный или найлоновый фильтр); проводят лизис клеток, затем депротеинизацию и денатурацию ДНК; фиксируют ДНК на подложке. Наносят на фильтр меченый зонд и проводят отжиг, а затем радиоавтографию. Колонии на исходной чашке, которые содержат гибрилизовавшуюся ДНК, выделяют и культивируют (рис. 4.13), Поскольку большинство библиотек получается в результате частичного гидролиза, положительный гибридизационный сигнал может быть получен для нескольких колоний (клонов). Теперь необходимо определить, какой именно клон (если таковой имеется) содержит искомый ген целиком. С помошью гель-электрофореза и картирования определяют размер каждого фрагмента (вставки) и идентифицируют аналогичные фрагменты или фрагменты с перекрывающимися последовательностями. Можно также провести дополнительное клонирование с тем, чтобы составить полный ген из перекрывающихся фрагментов. Или, если вставка в каком-либо из клонов достаточно велика и вполне может содержать весь ген, провести ее секвенирование и убедиться в наличии старт- и стоп-кодонов и полноразмерной нуклеотидной последовательности, кодирующей искомый белок. К сожалению, никто не может дать гарантии, что в библиотеке представлена вся нуклеотидная последовательность нужного гена. Если поиск полноразмерного гена оказался безрезультатным, можно создать другую библиотеку, используя другую рестриктазу, и провести скрининг с помощью исходного зонда или зондов, созданных на основе предыдущей библиотеки. Чтобы повысить вероятность присутствия в библиотеке полной версии искомого гена, можно также создать библиотеки, содержащие фрагменты ДНК заведомо большего размера, чем средний размер прокариотического гена (этот вариант мы рассмотрим вданной главе позже). Иммунологический скринингВ отсутствие ДНК-зонда для скрининга геномной библиотеки можно использовать другие методы. Например, если клонированный ген экс-прессируется, то его продукт — весь белок или его часть — можно обнаружить иммунологиче- 68 ГЛАВА 4
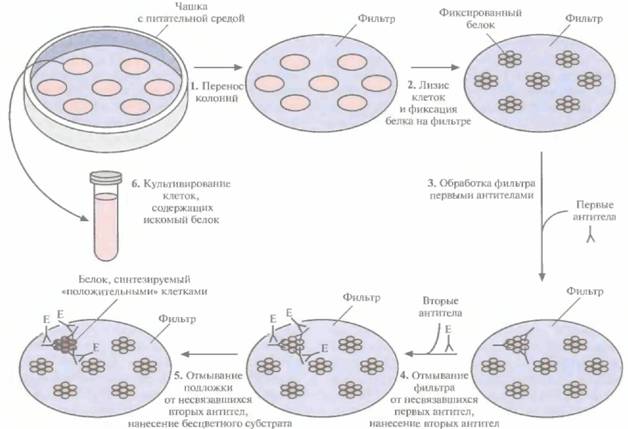
скими методами. Технически эта процедура имеет много общего с гибридизацией. Все клеточные линии (клоны) библиотеки высевают на чашки с питательной средой. Выросшие колонии переносят на фильтр, клетки лизируют, а высвободившиеся белки фиксируют на фильтре. Затем на фильтр наносят первые антитела, которые специфически связываются с данным белком (антигеном), все несвязавшиеся антитела удаляют, а фильтр помещают в раствор вторых антител, специфичных в отношении первых антител. Во многих тест-системах используют конъюгаты вторых антител с ферментом, например с щелочной фосфатазой. После отмывания фильтра добавляют бесцветный субстрат. Если вторые антитела связываются с первыми, то под действием фермента происходит гидролиз субстрата с образованием окрашенного вещества в том месте, где идет реакция (рис. 4.14). Те клетки на чашке, которые соответствуют окрашенным пятнам на фильтре, содержат или полноразмерный ген, или достаточно протяженный его участок, обеспечивающий синтез белкового продукта, узнаваемого первыми антителами. По окончании иммунологического скрининга геномной библиотеки необходимо определить, какой именно из отобранных клонов содержит полноразмерный ген. Технология рекомбинантных ДНК 64
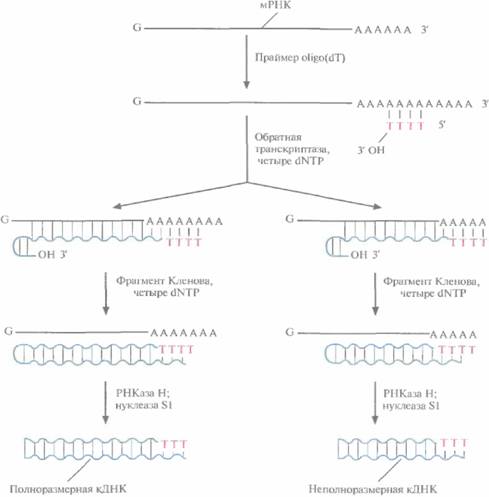
Скрининг по активности белкаМетод гибридизации ДНК и иммунологические методы позволяют идентифицировать многие гены и их продукты. Если при этом искомый ген кодирует фермент, не синтезируемый клеткой-хозяином, то для обнаружения клонов, содержащих данный ген, можно использовать метод идентификации на чашках. Так были идентифицированы гены α-амилазы, эндоглюканазы и ß-галактозидазы различных организмов. Для этого клоны Е. соli, составляющие геномную библиотеку данных организмов, высевали на чашках с питательной средой, содержащей специфический субстрат. После окрашивания селективным красителем клетки, способные утилизировать этот субстрат, приобретали характерную окраску. 70 ГЛАВА 4 Если искомый ген кодирует продукт, без которого мутантная клетка-хозяин не может расти на минимальной среде, то библиотеку можно создать методом трансформации мутантных клеток. Клетки, выросшие в отсутствие необходимого субстрата на минимальной среде, обязательно содержат функциональный искомый ген, попавший в клетку в составе плазмидного вектора. В разных вариантах этот подход использовали для выделения многих важных генов, в частности генов, ответственных за синтез антибиотиков и образование азотфиксирующих клубеньков на корнях некоторых растений, Клонирование структурных генов эукариотДля клонирования эукариотических структурных генов необходимы специальные методики. Прокариоты не способны удалять интроны из первичных РНК-транскриптов, поэтому правильная трансляция эукариотических мРНК в бактериальной клетке невозможна. Более того, экспрессия эукариотической ДНК может осуществляться только при наличии прокариотических сигнальных последовательностей, регулирующих транскрипцию и трансляцию. Концевые участки эукариотических мРНК особым образом модифицированы: их 5'-концы кэпированы (содержат «кэш из остатка G, часто метилированного), а 3'-концы полиаденилированы (содержат poly(A)-«хвост» из примерно 200 остатков аденозина). Наличие роlу(А)-хвоста позволяет отделить мРНК от рибосомной и транспортной РНК. Для этого суммарную эукариотическую РНК пропускают через колонку, заполненную целлюлозой, к которой «пришиты" короткие олигонуклеотидные цепочки из тимидиновых остатков длиной примерно 15 звеньев, oligo(dT). Ро)у(А)-хвосты молекул мРНК спариваются с oligo(dT) и задерживаются в колонке, а молекулы тРНК и рРНК свободно проходят через нее. Затем колонку промывают буфером, в котором происходит разрыв водородных связей между А и Т, и мΡΗΚ высвобождается. Саму мРНК нельзя встроить в ДНК-вектор, сначала на ней необходимо синтезировать двух-цепочечную ДНК, Для этого последовательно используют две разные полимеразы: обратную транскриптазу и фрагмент Кленова ДНК-поли-меразы I (рис. 4.15). Вначале в реакционную смесь с очищенной мРНК добавляют короткие oligo(dT), обратную транскриптазу и четыре dNTP (dATP, dTTP, dGTP, dCTP). Ро1у(А)-хвост мРНК спаривается с oligo(dT), несушим свободную 3'-ОН-группу, которая инициирует синтез комплементарной цепи. Матрицей в этом синтезе служит молекула мРНК, а катализирует его обратная транскриптаза, продуцируемая некоторыми РНК-вирусами. Она последовательно присоединяет к растущей цепи остатки Т, С, G или А, комплементарные A, G, С или U мРНК. In vitro синтез ДНК идет не до конца, при этом обратная транскриптаза перед остановкой обычно «поворачивает вспять» и присоединяет несколько нуклеотидов в обратном направлении (рис. 4.15), так что в результате образуется «шпилька». В реакционную смесь добавляют фрагмент Кленова ДНК-полимеразы I E. coli, который достраивает вторую цепь ДНК, используя первую цепь как матрицу. Он присоединяет дезоксирибонуклеотиды к растущей цепи, начиная с 3'-ОН-конца шпильки. По окончании синтеза препарат обрабатывают ферментом PHКазой Η, которая разрушает молекулы мРНК, и нуклеазой SI, отщепляющей одноцепочечные концы ДНК. Полученный препарат представляет собой смесь частично и полностью двухцепочечных комплементарных ДНК-копий (кДНК) мРНК, преобладающей в исходном образце. Разные кДНК можно встроить в плазмидный вектор и получить кДНК-библиотеку. Для скрининга кДНК-библиотеки с целью идентификации клонов, несущих специфические гибридные плазмиды, можно использовать метод гибридизации или иммунологические методы, В последнем случае кДHК должна быть встроена в сайт, находящийся под контролем бактериального промотора, обеспечивающего транскрипцию. Однако практически ни один вектор не гарантирует, что во встроенной кДНК сохранится правильная рамка считывания и синтезируется правильная полипептидная цепь. Тем не менее все положительные клоны, выявленные тем или иным методом, необходимо подвергнуть дальнейшей проверке и идентифицировать те из них, ко- Технология рекомбинантных ДНК 71
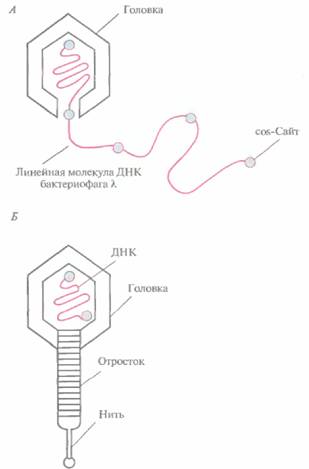
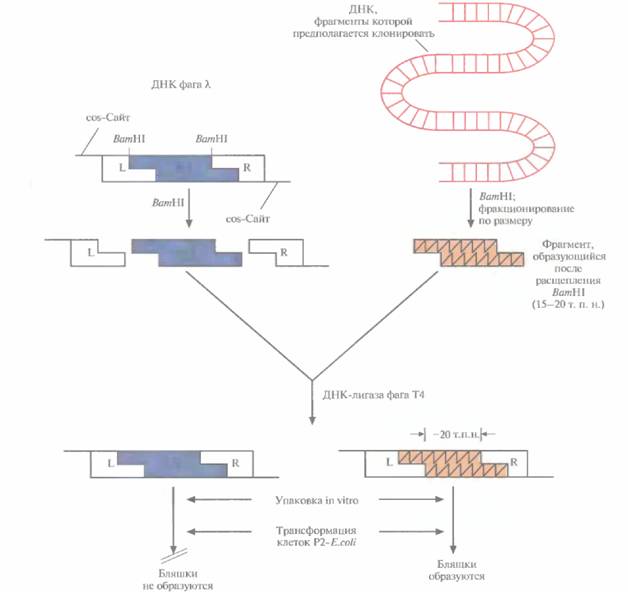
торые несут полноразмерную нуклеотидную последовательность, кодирующую белок-мишень. Векторы для клонирования крупных фрагментов ДНКВекторы на основе бактериофага λС помощью плазмидных векторов можно клонировать фрагменты ДНК длиной до 10 т. п. н. Однако при создании геномных библиотек часто приходится работать с более крупными фрагментами. Для этого были разработаны векторы на основе бактериофага λ Ε. coli. После проникновения фага λ в клетку E. coli события могут развиваться по двум сценариям. Если реализуется литический цикл, то фаг начинает интенсивно размножаться и примерно через 20 мин клетка разрушается (лизирует) с высвобождением до 100 новых фаговых частиц. При альтернативном варианте развития событий фаговая 72 ГЛАВА 4 ДНК включается в хромосому Е. coliкак профаг и реплицируется в клетке вместе с нормальными бактериальными генами (состояние лизогении). Однако при недостатке питательных веществ или иных неблагоприятных обстоятельствах интегрированная фаговая ДНК высвобождается, и запускается литический цикл развитии. Размер ДНК фага λ составляет примерно 50 т. п. н., причем значительная ее часть (около 20 т. п. н.) несущественна для размножения фага и отвечает за его встраивание в хозяйскую ДНК. В связи с этим возникла идея, что ее можно заменить фрагментом другой ДНК эквивалентного размера. Образующаяся ре-комбинантная молекула будет реплицироваться в клетке как ДНК «рекомбинантного" фага λ, «вставшего" на литический путь развития. Чтобы понять, как функционирует векторная система на основе фага λ, необходимо рассмотреть молекулярные аспекты литического цикла развития. Инфекционная фаговая частица имеет головку, в которой заключена плотно упакованная ДНК длиной примерно 50 т. п. н., и отросток с отходящими от него тонкими белковыми нитями (фибриллами). Сборка головки и отростка и упаковка ДНК четко скоординированы. ДНК фага λ — это линейная двухцепочечная молекула длиной 50 т. п. н. с одноцепочечными 5'-«хвостами» из 12 нуклеотидов. Их называют липкими (cos) концами, поскольку они взаимно комплементарны и могут спариваться друг с другом. После того как фаговая ДНК проходит через отросток и попадает в E. coli, cos-концы соединяются с образованием кольцевой молекулы. На раннем этапе литического цикла в результате репликации кольцевой молекулы ДНК образуется линейная молекула, состоящая из нескольких сегментов длиной 50 т. п. н. (рис. 4.16, A). Каждый из таких сегментов упаковывается в белковую головку, к последней присоединяется уже собранный отросток и образуется новая фаговая частица (рис. 4.16,Б). При упаковке молекулы ДНК длиной менее 38 т. п. н. получается неинфекционная фаговая частица, а фрагменты длиной более 52 т, п. н. не умещаются в головку. Сегменты длиной 50 т. п. н. в линейной молекуле ДНК разделены cos-сайтами, и именно по этим сайтам разрезается молекула, когда очередной сегмент заполняет головку. Разрезание осуществляет фермент, находящийся у входа в головку. В результате исследований по изучению сборки фага λ была разработана система упаковки молекул ДНК in vitro с образованием инфекционных фаговых частиц. Смешав в пробирке очищенные пустые головки, фаговую ДНК и собранные отростки, можно получить инфекционные фаговые частицы. Один из множества λ-векторов для клонирования имеет два BamHI-сайта, фланкирующих участок длиной 20 т. п. н. При гидролизе очищенной фаговой ДНК рестриктазой ВатНIобразует-
Технология рекомбинантных ДНК 73
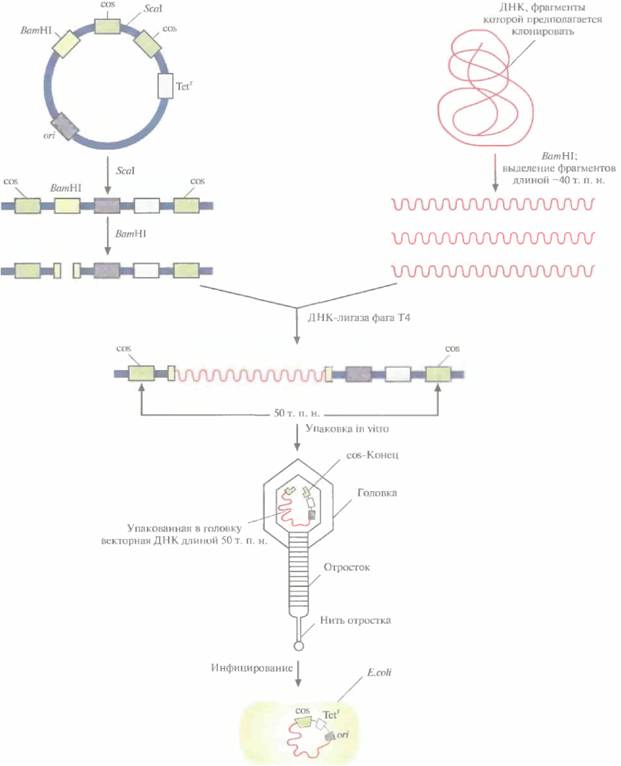
74 ГЛАВА 4 ся три фрагмента. Так называемое левое плечо (область L) содержит генетическую информацию о головке и отростке фага, правое плечо (область R) ведает репликацией ДНК и лизисом, а средний сегмент имеет гены, ответственные за процессы интеграции и исключения (сегмент I/E, от англ. integration/excision). Задача исследователя состоит в том, чтобы заменить этот центральный участок нуклеотидной последовательностью длиной примерно 20 т. п. н. (рис. 4.17) нужной ДНК. ДНК, предназначенную для клонирования, тоже расщепляют с помощью ВатHIи выделяют фрагменты размером от 15 до 20 т. п. н. Оба препарата — фаговую и чужеродную ДНК — объединяют и добавляют ДНК-лигазу фага Т4, а затем — пустые головки и уже собранные отростки. Фрагменты ДНК длиной 50 т. п. н. упаковываются в головки, к ним присоединяются отростки и образуются инфекционные фаговые частицы. Фрагменты большего (>52 т. п. н.) или меньшего (<38 т. п. н.) размера упаковываться не могут. Рекомбинантный фаг λ может размножаться только в тех штаммах E. coli, которые не обеспечивают размножения фага λ с интактной областью I/Е. Для сохранения рекомбинантного фага λ его периодически пересевают на свежую культуру E. coli. Для скрининга библиотек на основе фага λ можно использовать ДНК-зонды или иммунологические методы. Зоны лизиса (бляшки) переносят на фильтр и соответствующим образом тестируют. Если используется ДНК-гибридизация, то вначале удаляют фаговые белки, затем ДНК денатурируют и фиксируют на фильтре. При тестировании иммунологическим методом белки, кодируемые клонированными генами, переносят и фиксируют на фильтре вместе с бляшкой. Сопоставив пятна на фильтре, дающие положительную реакцию, с бляшками на исходной чашке, отбирают позитивные бляшки и проводят субкультивирование. Субкультуры служат источником рекомбинантных бактериофагов, которые можно по отдельности культивировать в E, coli. КосмидыВекторы, называемые космидами, могут включать до 40 т. п. н. чужеродной ДНК и при этом активно амплифицироваться в E. coli как плазмиды. Космиды объединяют в себе свойства плазмидных векторов и векторов на основе фaгa λ. Например, широко применяемая космида pLFR-5 (приблизительно 6 т. п. н.) имеет два cos-сайта фага λ, разделенных сайтом рестрикции для ScaI, полилинкер с шестью уникальными сайтами рестрикции (HindIII, PstI, SalI, BamHI, SmaIи EcoRI), точку начала репликации ДН К (ori) и ген устойчивости к тетрациклину (Tetr). Эта космида может интегрировать чужеродную ДНК длиной до 40 т. п. н. (рис. 4.18). Предназначенные для клонирования фрагменты ДНК длиной около 40 т. п. н. очищают центрифугированием в градиенте плотности сахарозы от продуктов частичного гидролиза донорной ДНК рестриктазой BamHI(рис. 4.18), a pLFR-5 сначала подвергают гидролизу с помощью ScaI, а затем ВатHI. Препараты ДНК смешивают и лигируют. Те продукты лигирования, которые содержат вставку длиной 40 т. п. н., имеют суммарный размер, близкий к 50 т. п. н., и следовательно, могут упаковываться in vitro в головки фага λ. Реассоциировавшие молекулы pLFR-5, Рис. 4.18. Клонирование с помощью космидного вектора. Космида имеет точку начала репликации (ori), обеспечивающую ее существование в Е. coliв виде плазмиды; два интактных cos-конца, разделенных уникальным сайтом для ScaI: BamHI-сайт вблизи одного из cos-сайтов и ген устойчивости к тетрациклину (Tetr). ДНК, которую хотят клонировать, расщепляют рестриктазой ВатHIи фракционируют по размеру, чтобы выделить молекулы длиной примерно 40 т. п. н. Плазммдную ДНК. расщепляют с помощью ScaIи ΒαmIII. Оба препарата ДНК смешивают и обрабатывают ДНК-лигазой фага Т4. Некоторые из гибридных молекул, образовавшихся после лигирования, содержат вставку размером около 40 т. п. н., так что их суммарная длина составляет примерно 50 т. п. н. Эти молекулы упаковываются in vitro в головки бактериофага λ, затем к головкам прикрепляются отростки, и образуются инфекционные частицы. При инфицировании этим «фагом» E. coli в бактериальной клетке оказывается линейная молекула ДНК с cos-концами, которые спариваются друг с другом. ДНК-лигаза клетки-хозяина зашивает одноцепочечные разрывы, и образовавшаяся кольцевая молекула существует в клетке-хозяине как автономно реплицирующаяся единица. Трансформированные клетки можно идентифицировать по признаку устойчивости к тетрациклину. Технология рекомбинантных ДНК 75
76 ГЛАВА 4 не содержащие вставок, упакованы не будут. После сборки фаговых частиц инфицируют ими Е. coli(рис. 4.18). Оказавшись в бактериальной клетке, линейная молекула pLFR-5 со вставкой замыкается в кольцо благодаря спариванию cos-сайтов. В такой стабильной конфигурации она может долгое время существовать в клетке и реплицироваться как гибридная плазмида, поскольку содержит все необходимые для этого элементы. Более того, ген устойчивости к тетрациклину обеспечивает рост колоний, несущих данную космиду, на среде с этим антибиотиком; нетрансформированные клетки при этом погибают. Существуют и другие космидные векторы на основе фага λ. Космиды имеют большое преимущество по сравнению с плазмидами: в них можно встраивать более протяженные фрагменты ДНК, а это означает, что для создания геномной библиотеки нужно меньшее число клонов и потребуется меньше времени на их скрининг. Векторные системы для клонирования очень крупных фрагментов ДНКВекторные системы, способные интегрировать крупные вставки (>100т. п. н.), имеют большую ценность при анализе сложных эукариотических геномов. Без таких векторов не обойтись, например, при картировании генома человека или при идентификации отдельных генов. В отличие от библиотек с небольшими вставками, в геномной библиотеке с крупными вставками скорее всего будет представлен весь генетический материал организма. Кроме того, в этом случае уменьшается число клонов, которые нужно поддерживать, и увеличивается вероятность того, что каждый из генов будет присутствовать в «своем» клоне. Для клонирования фрагментов ДНК размером от 100 до 300 т. п. н. был сконструирован низкокопийный плазмидный вектор на основе бактериофага Р1 — химерная конструкция, называемая искусственной хромосомой на основе фага Р1. Был создан также очень стабильный вектор, способный интегрировать вставки длиной от 150 до 300 т. п. н., на основе F-плазмиды (F-фактора, или фактора фертильности) Е. coli, которая представлена в клетке одной или двумя копиями, с селекционной системой lacZ' векторов pUC. Эта конструкция называется бактериальной искусственной хромосомой (ВАС, от англ, bacterialartificialchromosomes). Генетическая трансформация прокариотПеренос ДНК в E. coliТрансформация — это процесс введения свободной ДНК в бактериальную клетку. E. coli используется в качестве организма-хозяина при работе со многими рекомбинантными ДНК, и чтобы обеспечить проникновение в клетки плазмидной ДНК, их обрабатывают ледяным раствором СаС12, а затем выдерживают при 42 °С в течение 1,5 мин. По-видимому, в результате такой обработки происходит локальное разрушение клеточной стенки. Этот метод дает максимальную частоту трансформации, примерно 10—3, т. е. на каждую 1000 клеток приходится одна трансформированная. Эффективность трансформации, которая определяется как число трансформантов на 1 мкг добавленной ДНК, составляет примерно 107—10К. Частота трансформации никогда не бывает 100-процентной, но этот недостаток компенсируется применением схем отбора, позволяющих быстро идентифицировать трансформированные клетки. Клетки, способные поглощать чужеродную ДНК, называются компетентными. Компетентность E. coli необходимо индуцировать, а некоторые другие бактерии обладают этим свойством изначально. Долю компетентных клеток можно повысить, используя специальную питательную среду или условия культивирования. Для бактерий, устойчивых к химическим индукторам компетентности или не обладающих природной компетентностью, применяются другие системы доставки ДНК. ЭлектропорацияДля увеличения проницаемости клеточных мембран на них воздействуют электрическим током. Эта процедура называется электропорацией. Условия ее проведения различаются для разных видов бактерий. При работе с Е. сой клеточную суспензию (50 мкл) и ДНК помещают в сосуд с погруженными в него электродами и подают единичный импульс тока длительностью 4,5 мс (емкость конденсатора 25 мкФ, Технология рекомбинантных ДНК 77 напряжение 2,5 кВ, сопротивление 200 Ом). После такой обработки эффективность трансформации повышается до 109 для коротких плазмид (примерно 3 т. п. н.) и до 106 для больших (примерно 135 т. п. н.). Аналогичные условия можно использовать для введения в Е. соliвектора ВАС. Таким образом, электропорация является эффективным методом трансформации Е. соliплазмидами, содержащими вставки длиннее 100 т. п. н. Есть основания полагать, что подходящие условия электропорации будут разработаны для всех видов бактерий, так что эта процедура может стать стандартным методом трансформации. О механизме проникновения в клетку ДНК в процессе электропорации известно очень мало. По-видимому, как и при химически индуцированной трансформации, в результате электрошока в клеточной стенке образуются временные поры, через которые ДНК и проходит в клетку. КонъюгацияРекомбинантная ДНК проникает в клетки бактерий, характеризующихся низкой частотой трансформации, таким же образом, как плазмидная ДНК из донорской клетки в реципиентную в естественных условиях. Некоторые плазмиды обладают способностью создавать межклеточные контакты, через которые они и переходят из одной клетки в другую. Образование контактов между донорной и реципиентной клетками обеспечивается конъюгативными свойствами плазмид, а сам перенос ДНК — мобилизационными. Большинство плазммд, которые используются в работах с рекомбинантными ДНК, не обладают конъюгативными функциями и поэтому не могут переходить в ре-ципиентные клетки путем конъюгации. Однако проникновение в клетку некоторых плазмидных векторов все-таки происходит при наличии в этой клетке второй плазмиды, обладающей конъюгативными свойствами. Таким образом, введя в клетку, несущую мобилизуемый плазмидный вектор, плазм иду с конъюгативными функциями, можно трансформировать клетки-реципиенты, с трудом поддающиеся трансформации другими способами. Опишем в общих чертах используемую для этого стандартную экспериментальную процедуру. Смешивают клетки трех разных штаммов. Когда клетки оказываются в непосредственной близости друг от друга, конъюгативная плазми-да, которая в данном случае обладает также мобилизационными свойствами, сама переходит в клетку, содержащую мобилизуемый плазмидный вектор, а затем обеспечивает перенос векторной ДНК в реципиентную клетку. В такой системе реализуются все возможные пути переноса, но подобные штаммы и плазмиды обладают такими генетическими свойствами, чтобы можно было отобрать реципиентную клетку, получившую данный плазмидный вектор. Предположим, что мы имеем три штамма: 1) штамм А, который несет конъюгативную мобилизуемую плазмиду, но не может расти на минимальной питательной среде и чувствителен к антибиотику X; 2) штамм В, который также не может расти на минимальной питательной среде и несет неконъюгативный плазмидный вектор, который имеет ген резистентное™ к антибиотику X; 3) штамм С — рецепиентная клетка-мишень, которая может расти на минимальной среде, не имеет несовместимых плазмид и чувствительна к антибиотику X. После конъюгации клетки непродолжительное время выращивают на полноценной среде без антибиотика X, а затем переносят их на минимальную среду с антибиотиком. В этих условиях могут расти только реципиентные клетки-мишени, которые приобрели плазмидный вектор. Иногда клетка-мишень получает обе плазмиды, однако этот редкий случай можно выявить, если перенести клетки путем перепечатки на минимальную среду и отобрать трансконъюганты, которые способны расти в присутствии антибиотика X, но не могут расти при наличии гена резистентности к другому антибиотику (например, к антибиотику Y), который имеется в конъюгативной плазмиде штамма А. Поскольку для переноса плазмидной ДНК должна произойти конъюгация между тремя бактериальными штаммами, эта процедура получила название тройного скрещивания. 78 ГЛАВА 4 ЗАКЛЮЧЕНИЕТехнология рекомбинантных ДНК включает целый набор экспериментальных процедур, благодаря которым удается выделить (клонировать) фрагменты ДНК, содержащие специфические гены. Успех клонирования зависит от возможности воспроизводимо разрезать молекулу ДНК на фрагменты определенного размера. Для точного расщепления ДНК используют рестрици-рующие эндонуклеазы типа 11. Эти ферменты узнают специфические нуклеотидные последовательности и симметрично разрезают фосфодиэфирные связи в каждой цепи. Типичный эксперимент по клонированию генов включает следующие этапы. 1. Рестриктазное расщепление ДНК, выделенной из организма, который содержит искомый ген. 2. Обработка вектора для клонирования (обычно плазмидного). который может реплицироваться в клетке-хозяине, теми же рестриктазами, которые использовались для расщепления донорной ДНК. 3. Смешивание этих двух образцов ДНК и сшивание фрагментов ДНК-лигазой фага Т4. 4. Трансформация сшитыми молекулами клеток-хозяев. Амплификация рекомбинантной ДНК в трансформированных клетках. Для отбора клеток, содержащих рекомбинантную ДНК, используют специальные приемы. Чтобы уменьшить количество кольцевых плазмидных молекул, образующихся при сшивании фрагментов ДНК-лигазой Т4, рестрици-рованную плазмидную ДНК обрабатывают щелочной фосфатазой, удаляющей 5'-концевые фосфатные группы. Для отбора трансформированных клеток, содержащих гибридные плазмиды, проводят: 1) тестирование на резистент-ность к определенным антибиотикам или колориметрическую реакцию; 2) иммунологические тесты или выявление специфического белка — продукта клонированного гена; 3) гибридизацию с зондом, комплементарным какому-либо участку искомого гена. Чтобы иметь возможность клонировать целый ген, донорную ДНК расщепляют лишь частично. При этом получаются фрагменты разной длины, из которых затем создают геномную библиотеку. Для клонирования крупных фрагментов ДНК были сконструированы векторы на основе бактериофагов λ и Р1, а также плазмиды F. Для получения фрагментов ДНК, кодирующих эукариотические белки, на очищенной мРНК как на матрице синтезируют комплементарную цепь ДНК с помощью обратной транскриптазы; эта цепь в свою очередь используется в качестве матрицы для синтеза второй цепи. После ферментативной обработки эту двухцепочечную комплементарную ДНК встраивают в вектор. Независимо от того. Какая именно стратегия клонирования используется, после идентификации клонированной последовательности необходимо показать, что она представляет собой нативный структурный ген. ЛИТЕРАТУРАBerger S. L, A. R. Kimmel (ed.). 1987. Methods in Enzymotogy, vol. 152. Guide to Molecular Cloning Techniques. Academic Press, London, United Kingdom. Garfin D. E. 1995. Electrophoretic methods, p. 53-109. In ]. A. Glasel and M. P. Deutscher (ed.), Introduction to Biophysical Methods for Protein and Nucleic Acid Research. Academic Press, San Diego, Calif. Grinstead J.t P. M. Bennett (ed.)· 1988. Methods in Microbiology, vol. 21, Plasmid Technology. Academic Press, London, United Kingdom. loannou A. P., C. T. Amemiya, J. Games, P. M. Kroisel, H. Shizuya, C. Chen, M. A. Batzer, P. J. de Jong. 1994. Anew bacteriophage-derived vector for tlie propagation of large human DNA fragments. Nat. Genet. 6: 84-89. Kim U.-J., B. W. Birren, T. Slepak, V. Mancino, C. Boysen, H.-L. Kang, M. I. Simon, H. Shizuya. 1996. Construction and characterization of a human bacterial artificial chromosome library. Genomics34: 213—218. Leonardo E. D., J. M. Sedivy. 1990. A new vector for cloning large eukaryotic DNA segments in Escherichia coli. Bio/Technology 8: 841 —844. Martin C., L. Bresnick, R.-R. Juo, J. C. Voyta, L Bronstein. 1991. Improved chemiluminescent DNA sequencing, BtoTechniques 11: 110-114. Old R. W., S. B. Primrose, 1985. Principles of Gene Manipulation, 3rd ed. Blackwell Scientific Publications, Oxford, United Kingdom. Sambrook JM E. F. Fritsch, T. Maniatis. 1989. Molecular Cloning: a Laboratory Manual, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. Технология рекомбинантных ДНК 79 Slightom J. L., R. F. Drong, P. P. Chee. 1993. Construction of λ clone banks, p. 121—146. In B. R. Click and J. E. Thompson (éd.), Methods in Plant Molecular Biology and Biotechnology. CRC Press, Boca Raton, Fla. Southern E. 1975. Detection of specific sequences among DNA fragments separated by gel elec-trophoresis. J. Mol. Biol. 98: 503-507. Winnacker E.-L. 1987. From Genes to Clones: Introduction to Gene Technology. VCH, New York, N.Y. КОНТРОЛЬНЫЕ ВОПРОСЫ1. Что такое эндонуклеазы рестрикции типа II и почему они так важны для технологии рекомбинантных ДНК? 2. При обработке кольцевой двухцепочечной плазмиды pCELl различными рестриктазами и их комбинациями получаются следующие фрагменты (размеры указаны в парах нуклео-тидов): EcoRI - 6,0; ВатIII - 6,0; HindIII -6,0; НаеII - 3,0; 2,0 и 1,0; EcoRI и НаеII - 2,0 и 1,0; EcoRI и HindIII - 3,5 и 2,5; EcoRI и ВатHI - 4,5 и 1,5; ВатHIи HindIII - 5,0 и 1,0; ВатШ и Haell - 3,0; 1,5 и 0,5; HindIII и НаеII— 3,0; 1,5; 1,0 и 0,5. Используя эти данные, постройте рестрикционную карту pCELl. 3. Опишите применение плазмиды pBR322 в качестве вектора. Какими особенностями она обладает? 4. Опишите основные свойства системы клонирования pUC. 5. Обычно банк клонов создают лигированием плазмидного вектора, подвергнутого исчерпывающему гидролизу с помощью BamHI, с хромосомной ДНК, частично гидролизован-ной рестриктазой Sau3АI. а. Почему в этом эксперименте используется два разных фермента? б. Что такое частичный гидролиз и как его проводят? в. Почему к нему часто прибегают для создания банков клонов? 6. Зачем рестрицированную плазмидную ДНК перед лигированием часто обрабатывают щелочной фосфатазой? 7. Опишите способы введения рекомбинантных плазмид в грамотрицательную бактерию, например в E. coli. | |||||||||||||||||||||||||||