|
Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
Обработка образца ДНК определенной рестриктазой всегда дает один и тот же набор фрагментов — при условии, что расщепление происходит по всем сайтам узнавания. Если использовать несколько ферментов рестрикции и сначала обработать ДНК каждой из рестриктаз в отдельности, а затем их комбинациями, можно построить физическую карту данной ДНК, т. е. установить порядок следования сайтов рестрикции вдоль молекулы. Определив размер полученных фрагментов с помощью гель-электрофореза, можно найти положение рестрикционных сайтов (дополнение 4.1). На рис. 4.4,А указаны размеры фрагментов, полученных в результате расщепления ДНК разными рестриктазами и их смесью. Из этих данных следует, что данный участок ДНК имеет по два сайта для BamHIи EcoRI.
Чтобы построить рестрикционную карту, следует сравнить размеры фрагментов, полученных при раздельной рестрикции и при рестрикции смесью ферментов. Результат такого сравнения представлен на рис. 4.4,Б. Если при гидролизе ДНК каждой из двух рестриктаз (EcoRI и ВатHI) образуются три фрагмента, значит, в исходном фрагменте ДНК было два сайта узнавания для каждой из использованных рестриктаз. Фрагмент размером 300 п. н,, который образуется в результате гидролиза EcoRI, не расщепляется
54 ГЛАВА 4
при гидролизе смесью ЕсоRIи ВатHIв отличие от ЕсоRI-фрагментов размером 850 и 500 п. н. Значит, два EcoRI-сайта находятся на расстоянии 300 п. н. друг от друга и между ними нет ВатHI-сайта, а в ЕсоRI-фрагментах длиной 850 и 500 п.н. есть по одному ВатHI-сайту. Фрагмент размером 950 п. н., который образуется при обработке ДНК рестриктазой ВатHI, при двойном гидролизе расщепляется EcoRI на три фрагмента (250+3004400 - 950 п.н.). Значит, два ВатHI-сайта находятся на расстоянии 250 и 400 п. н. по разные стороны от сайтов для EcoRI. ВатHIрасщепляет EcoRI-фрагмент длиной 850 п. н. на фрагменты длиной 250 и 600 п, н., а один из сайтов для EcoRlнаходится на расстоянии 250 п. н. от сайта для ВатHI, значит, фрагмент 600 п. н.
ДОПОЛНЕНИЕ 4.1 | Гель-электрофорез
Для разделения белков и нуклеиновых кислот широко применяется метод гель-электрофореза. Его принцип заключается в следующем. Исследуемый препарат (раствор белка, ДНК или РНК) вносят в лунку, расположенную у края геля - полужидкой среды с сетчатой пространственной структурой (обычно для электрофореза используют тонкие пластины геля). Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, и когда через гель пропускают электрический ток, они перемещаются в электрическом поле. Молекулы одинакового размера (и одинакового заряда) движутся единым фронтом, образуя в геле дискретные невидимые полосы. Чем меньше размер молекул, тем быстрее они движутся. Постепенно исходный препарат, состоящий из разных макромолекул, разделяется на зоны, распределенные по длине пластинки. За ходом электрофореза следят по перемещению в геле красителя -заряженного низкомолекулярного вещества, которое вносят в каждую лунку перед началом электрофореза. Когда краситель достигает конца пластины, электрофорез останавливают, а гель окрашивают красителем, прочно связывающимся с белками или нуклеиновыми кислотами. Если образец представляет собой дискретный набор макромолекул разного размера, то после электрофореза получается набор четких полос, рас-
|
положенных одна под другой. Если же распределение молекул по размеру более или менее непрерывно, то получается смазанная картина. По интенсивности окраски полос можно судить о концентрации макромолекул в образце. Чтобы определить относительную молекулярную массу разделенных фрагментов, одновременно проводят электрофорез маркерных макромолекул с известными молекулярными массами. Набор маркеров должен охватывать весь диапазон молекулярных масс в данной системе. Образец маркерных молекул вносят в отдельную лунку, расположенную вблизи одного из краев пластинки (или в две лунки у двух разных краев). Логарифм относительной молекулярной массы маркера линейно связан с его электрофоретической подвижностью Rf — величиной, равной отношению расстояний, пройденных маркерной молекулой и красителем (фронтом растворителя). Построив график зависимости логарифма относительных молекулярных масс маркеров от Rf, можно найти относительную молекулярную массу каждого компонента образца. Относительная мол. масса белков измеряется в дальтонах, двухцепочечных нуклеиновых кислот - в числе пар нуклеотидов, одноцепочечных — в числе нуклеотидов. Для разделения белков обычно используют полиакриламидный гель (ПААГ), Он образуется при сополимеризации акрилами-
|
да и бисакриламида, использующегося в качестве сшивки линейных полимеров акриламида. Размер ячеек в полиакриламидной «сетке» зависит от концентрации акриламида и соотношения между количеством акриламида и бисакриламида. Белок перед электрофорезом часто обрабатывают анионным детергентом додецилсульфатом натрия (ДСН), что позволяет проводить фракционирование в зависимости только от одного параметра — молекулярной массы, а зависимость от конформации, плотности упаковки полипептидной цепи и др. исключается. Электрофорез в ПААГ-ДСН позволяет разделять белки с мол. массой от 20 до 200 кДа. Для электрофоретического разделения нуклеиновых кислот среднего размера обычно применяют агарозные гели. Агароза -это особо чистая фракция, получаемая из агара или непосредственно из агарообразующих морских водорослей. В 1,0% агарозном геле можно разделять молекулы ДНК размером от 600 до 20 000 п. н. Для фракционирования более крупных молекул ДНК (миллионы пар оснований), денатурированной ДНК и РНК приходится использовать специальные системы электрофореза. Иногда для решения специальных задач для разделения ДНК применяют поли акриламидные гели. Так, в 20% полиакриламидном геле можно разделить фрагменты ДНК, состоящие всего из шести оснований и различающиеся лишь одним нуклеотидом.
|
Технология рекомбинантных ДНК 55
Рис. 4.4. Картирование сайтов рестрикции. А. Результаты гель-электрофореза фрагментов ДНК, полученных ее расщеплением указанными ферментами. Очищенную ДНК гидролизовали рестриктазами EcoRIи BamHIраздельно, а затем их смесью, проводили гель-электрофорез и визуализировали продукты окрашиванием бромистым этидием. Числа слева от горизонтальных полос -длина фрагментов в парах оснований. Б. Рестрикционная карта, построенная по электрофоретическим данным. Числа — расстояние между сайтами узнавания соответствующих ферментов.
|

|
должен содержать один из концов исходной молекулы ДНК. Далее, мы видим, что ВатHIрасщепляет ЕсоRI-фрагмент длиной 500 п. н. на два фрагмента размером 100 и 400 п. н. и что один из EcoRI-сайтов отделен от BamHI-caйтa 400 п. н.; значит, фрагмент длиной 100 п. н, должен содержать другой конец исходной молекулы. Карта на рис. 4.4,Б иллюстрирует четкое соответствие между положением сайтов рестрикции и размерами фрагментов, получающихся при каждом гидролизе.
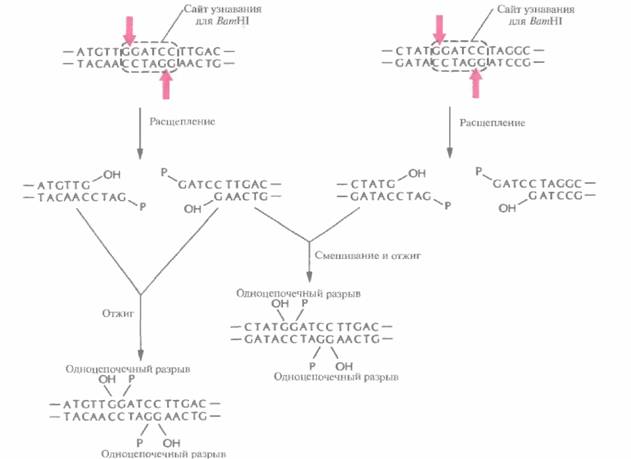
Расщепление рестрицирующими эндонуклеазами имеет еще одно применение. Когда два разных образца ДНК обрабатывают одной и той же рестриктазой с образованием фрагментов с липкими концами, а затем смешивают эти образцы, то благодаря комплементарному спариванию липких концов фрагментов разных образцов могут образовываться новые комбинации генов -рекомбинантные ДНК (рис, 4.5).
Для осуществления молекулярного клонирования недостаточно одних только ферментов рестрикции. Во-первых, водородные связи между теми четырьмя основаниями, которые образуют липкие концы, недостаточно прочны, чтобы удержать два объединившихся фрагмента ДНК, Необходим какой-то инструмент для устранения разрыва в сахарофосфатном остове молекyлы, т. е. для восстановления связи между 3'-гидроксильной концевой группой одной цепи и 5'-фосфатной группой другой. Таким инструментом является ДНК-лигаза бактериофага Т4. Этот фермент катализирует образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые уже удерживаются вместе благодаря спариванию липких концов. Кроме того, ДНК-лигаза Т4 «сшивает» тупые концы, которые сближаются друг с другом после того, как объединяемые фрагменты связываются с ферментом (рис. 4,6). Во-вторых, объеди-
56 ГЛАВА 4
|
Рис. 4.5, Отжиг комплементарных липких концов фрагментов, образующихся при расщеплении двух разных образцов ДНК рестрицирующей эндонуклеазой BатHI. Четыре фрагмента, представленных на рисунке, могут соединиться друг с другом с образованием шести разных молекул ДНК (на рисунке показаны не все возможные комбинации). Фрагменты удерживаются вместе водородными связями, образующимися между четырьмя основаниями липких концов, но эти связи недостаточно прочны, чтобы молекулы в растворе оставались стабильными длительное время.
|
нение разных молекул ДНК само по себе бесполезно, если вновь образованные комбинации (рекомбинантные ДНК) не будут реплицироваться в клетке-хозяине. Таким образом, если одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, то другая должна содержать информацию, необходимую для репликации в клетке рекомбинантной ДНК. Чтобы решить эту проблему, используют клонирующие векторы. В-третьих, при рестрикции ДНК образуется смесь разнообразных фрагментов, и после их лигирования с векторной ДНК образуется множество различных комбинаций. Необходимо уметь распознавать те реципиентные клетки, которые содержат ДНК с нужной нуклеотидной последовательностью. Для этого используют различные системы скрининга.
|
|
|
 Скачать 9.74 Mb.
Скачать 9.74 Mb.

