Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
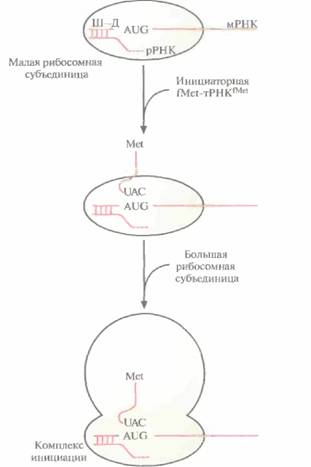
ТрансляцияТрансляция осуществляется при участии мРНК, разных тРНК, «нагруженных» соответствующими аминокислотами, рибосом и множества белковых факторов, обеспечивающих инициацию, элонгацию и терминацию синтеза полипептидной цепи. Трансляция в прокариотических клетках инициируется формилметиониновой тРНК, которая так и называется — инициаторная тРНК. При участии белковых факторов антикодон 3'-UAC-5' инициаторной тΡΗКfMet (fMet - модифицированный метионин, аминогруппа которого формилирована) связывается с кодоном 5'-AUG-3' мРНК, образующей комплекс с малой рибосомной субъединицей. Никакая другая тРНК соединиться с этим комплексом не может. В свою очередь связывание мРНК с малой рибосомной субъединицей осуществляется посредством образования нуклеотидных пар между последовательностью примерно из восьми нуклеотидов (последовательность Шайна—Дальгарно), которая расположена вблизи 5'-конца мРНК, и комплементарной 3'-концевой последовательностью рРНК, связанной с малой рибосомной субъединицей. К комплексу fМеt-тРНКfМеt-мРНК-малая
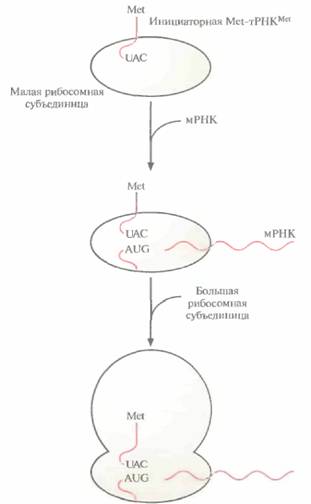
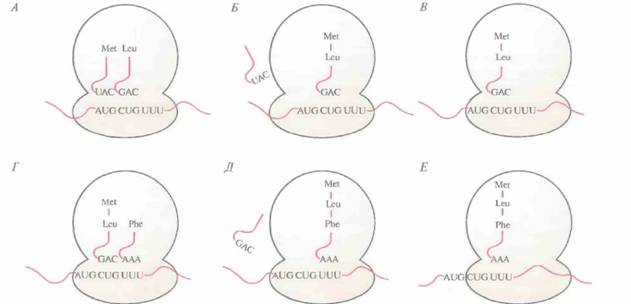
ДНК, РНК и синтез белка 39 субъединица присоединяется большая субъединица, и образуется инициаторный комплекс (комплекс инициации) (рис. 3.15). У эукариот трансляция инициируется связыванием специфической «нагруженной» инициаторной тРНК (Met-TPHKMet) и факторов инициации с малой рибосомной субъединицей. Затем мРНК присоединяется своим 5'-концом к комплексу тРНК—малая рибосомная субъединица, и комплекс продвигается по мРНК до старт-кодона (AUG). Далее антикодон UAC инициаторной Met-TPHKMet спаривается с кодоном AUG мРНК. К комплексу присоединяется большая рибосомная субъединица, и образуется инициаторный комплекс (рис. 3.16.) Этапы элонгации и терминации у про- и эукариот во многом сходны. Процесс элонгации включает образование пептидных связей между соседними аминокислотами, при этом очередность присоединяемых аминокислот определяется очередностью кодонов в мРНК (рис. 3.17). Рассмотрим процесс более подробно. После образования инициаторного комплекса кодон в молекуле мРНК, следующий за кодоном AUG, спаривается с комплементарным ему антикодоном соответствующей тРНК, определяя таким образом, какая из нагруженных тРН К присоединится к рибосоме (ненагруженные тРНК не связываются с рибосомами). Если вторым триплетом в мРНК оказывается CUG, то следующей к рибосомному комплексу присоединяется несущая лейцин тРНК с антикодоном 3'-GAC-5'. Когда эта тРНК оказывается на месте, между карбоксильной группой метионина и аминогруппой лейцина с помощью ферментативной активности, присущей большой субъединице, образуется пептидная связь, при этом лейцин остается связанным со своей тРНК, а метионин отсоединяется от инициаторной тРНК, и последняя отделяется от рибосомы. Комплекс метионин—лейцин— тРНКLeu—мРНК «протягивается» через рибосому (транслокация), так что следующий кодон мРНК может связаться с нагруженной тРНК, несущей соответствующий антикодон. Если третьим кодоном мРНК является UUU, то следующей аминокислотой в растущей полипептидной цепи будет фенилаланин; его доставит к рибосоме тРНК с антикодоном ААА. Когда эта тРНК окажется на месте, между карбоксильной группой лейцина и аминогруппой фенилаланина образуется пептидная связь. тРНКLeu отделится от рибосомы, произойдет транслокация пептидил-тРНКPhe (тРНК с присоединенной к ней растущей полипептидной цепью), и следующий кодон мРНК сможет связаться с антикодоном соответствующей нагруженной тРН К. Эти события — связывание нагруженной тРНК с мРНК благодаря комплементарному спарива-
40 ГЛАВА 3
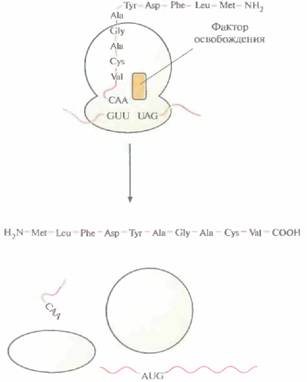
нию кодона с антикодоном, образование пептидной связи, отсоединение «разгруженной» тРНК, транслокация — продолжаются до тех пор, пока не соединятся друг с другом все аминокислоты, закодированные в мРНК. Трансляция происходит в направлении 5'—3' со скоростью примерно 15 аминокислот в секунду. Когда 5'-конец мРНК высвобождается из рибосомного комплекса, он может связаться с другим таким же комплексом, так что одна молекула мРНК может одновременно транслироваться множеством рибосом. Элонгация продолжается до тех пор, пока рибосома не дойдет до кодона UAA, UAG или UGA (стоп-кодон, терминирующий кодон) (рис. 3.18). В норме в клетках отсутствуют тРНК с антикодонами, комплементарными сигналам терминации. Их узнают белковые факторы освобождения (терминации). При связывании фактора освобождения с рибосомой происходит гидролиз связи между последней тРНК и полипептидом, свободная тРНК, полипептидная цепь и мРНК отсоединяются от рибосомы. Рибосома диссоциирует на субъединицы, которые могут вновь участвовать в трансляции. После трансляции многие полипептиды подвергаются различным модификациям. У большинства из них отщепляется N-концевой метионин, так что N-концевым остатком становится вторая аминокислота. У эукариот происходит так называемый процессинг некоторых белков, когда полипептидная цепь расщепляется в определенных сайтах с образованием более коротких белковых молекул со специфическими функциями. В некоторых случаях, особенно в эукариотических клетках, к определенным аминокислотам ферментативным путем присоединяются фосфатные группы, липиды, углеводы или другие низкомолекулярные соединения. В результате этих химических модификаций образуются белки, выполняющие в клетке специфические функции. Генетический словарь состоит из 64 кодонов. Три из них — это стоп-кодоны, а один (AUG) -старт-кодон (табл. 3.2), кодирующий еще и аминокислоту метионин. Когда кодон AUG находится не на 5'-конце молекулы мРНК, а в ее внутренней области, то он распознается другой тРНК (Met-TPHKMet), к которой присоединен немоди- ДНК, РНК и синтез белка 41
фицированный метионин. Аминокислота триптофан кодируется всего одним кодоном (UGG), остальные аминокислоты, из которых состоят белки, — по крайней мере двумя, чаще четырьмя, а иногда и шестью кодонами. Например, для лейцина существует шесть кодонов: (UUA, UUG, CUU, CUC, CUA и CUG. Синонимичные кодоны используются различными организмами с разной частотой. Из четырех кодонов для глицина GGA используется в структурных генах человека в 26% случаев, а в Escherichia coli — в 9%. Такая же ситуация наблюдается и для стоп-кодонов. Так, у человека частота использования кодонов UAA, UAG и UGA составляет 0,22, 0,17 и 0,61 соответственно, а у E. coli — 0,62,0,09 и 0,30. Несмотря на все эти различия, генетический код у всех организмов, за редким исключением, одинаков. Регуляция транскрипции у бактерийВсе процессы, протекающие в бактериальной клетке, — образование аминокислот, нуклеотидов и других важных метаболитов, репликация, транскрипция, трансляция, катаболизм, высвобождение энергии, реакции на внешние воздействия — требуют участия белков. Однако энергетических ресурсов клетки не хватает для одновременного осуществления транскрипции и трансляции (экспрессии) всех структурных генов. Поэтому постоянно экспрессируются толь- 42 ГЛАВА 3
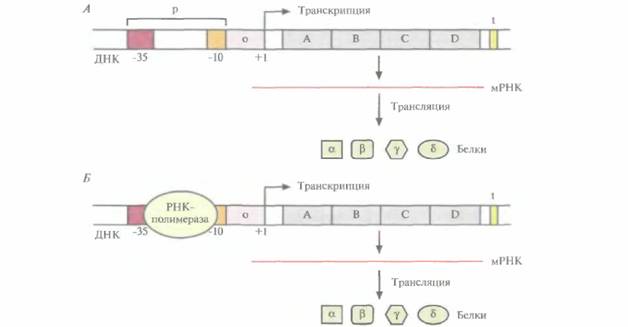
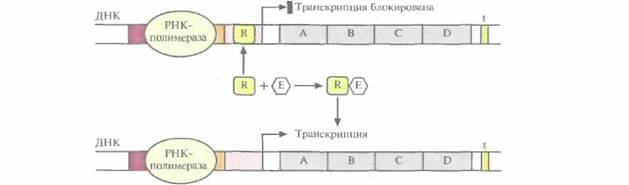
ко те гены, которые кодируют белки, поддерживающие основные клеточные функции, а транскрипция остальных структурных генов регулируется. Когда у клетки возникает потребность в каком-то белке (белках), то инициируется (включается) транскрипция соответствующего структурного гена (генов), а когда такая потребность исчезает, транскрипция выключается. Часто у бактерий белки одного метаболического пути кодируются смежными структурными генами. Нуклеотидная последовательность, в которой закодировано более одного белка, называется опероном. Обычно оперон находится под контролем единственного промотора, и при его транскрипции образуется одна длинная молекула мРНК, кодирующая несколько белков. При трансляции такой мРНК, в которой стоп-кодон последовательности, кодирующей один белок, соседствует со старт-кодоном гена следующего белка, синтезируется набор дискретных белков. В большинстве структурных генов Е. coliимеются два сайта связывания для РНК-полимеразы. Один из них обычно представляет собой нуклеотидную последовательность ТАТААТ АТАТТА (ТАТА-бокс, или бокс Прибнова), а другой - TTGAC AACTG. ТАТА-бокс и последовательность TTGAC расположены за 10 (область —10) и 35 (область —35) нуклеотидов до сайта инициации транскрипции соответственно (нуклеотид +1) (рис. 3.19). Обычно от участка между ТАТА-боксом и нуклеотидом +1 во многом зависит, будет ли происходить транскрипция данного оперона. В зависимости от способа регуляции транскрипции оперона этот участок называется оператором или активатором. Для включения и выключения разных оперонов в ходе эволюции сформировалось множество регуляторных систем. Например, с операторной областью может быть связан регуляторный белок, называемый репрессором; он мешает перемещению РНК-полимеразы вдоль молекулы ДНК, и транскрипция блокируется (рис. 3.20). Однако если с репрессором свяжется некое низкомолекулярное вещество (эффектор), то его конформация изменится таким образом, что его связывание с операторной областью станет невозможным, и транскрипция возобновится. Обычно эффектор разрушается клеточными ферментами. Когда его концентрация снижается, репрессор связывается с операторным участком, и транскрипция вновь прекращается. Операторный участок специфичен для каждого оперона, а эффектор взаимодействует только с определенным репрессором. В качестве иллюстрации рассмотрим такой пример. Предположим, что клетка способна метаболизировать определенный сахар. Тогда синтез ферментов, расщепляющих этот сахар, будет бесполезной тратой клеточных ресурсов, если он отсутствует в среде. С другой стороны, если этот сахар имеется в достаточном количестве и является единственным источником углерода, то ферменты, отвечающие за его утилизацию ДНК, РНК и синтез белка 43
клеткой, становятся совершенно необходимыми. В этом случае сахар действует как эффектор, препятствуя связыванию репрессора с операторным участком и таким образом обеспечивая транскрипцию оперона и синтез ферментов. При истощении запасов сахара в среде репрессор связывается с операторным участком, и транскрипция оперона прекращается. Нормальным состоянием других оперонов может быть состояние, при котором осуществ-
44 ГЛАВА 3
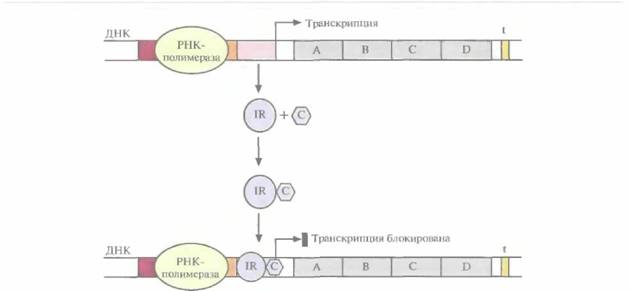
ляется их транскрипция, поскольку репрессорный белок неактивен. В этом случае специфический эффектор (корепрессор), связываясь с неактивным репрессором, вызывает в нем такие конформационные изменения, которые обеспечивают связывание комплекса с операторным участком, и транскрипция оперона выключается (рис. 3.21). Сам по себе репрессор не способен связываться с оператором, поэтому при уменьшении концентрации корепрессора транскрипция возобновляется. Регуляция транскрипции с помощью репрессора называется отрицательной. Если же система регуляции направлена на повышение скорости транскрипции, то она называется положительной Рассмотрим вкратце этот процесс. Белок-активатор связывается с участком между ТАТА-боксом и сайтом инициации транскрипции. При этом он не
ДНК, РНК и синтез белка 45
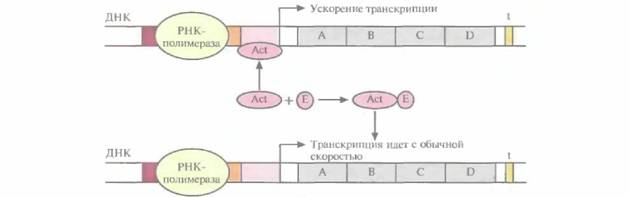
только не блокирует перемещение РНК-полимеразы вдоль молекулы ДНК, а напротив, ускоряет его, действуя как своего рода «смазка». Активаторы специфичны для определенных сайтов активации. Иногда с работающим активатором связывается эффектор, переводящий его в неактивную форму; тогда скорость транскрипции уменьшается (рис. 3.22). В других случаях эффектор, напротив, активирует неработающий активатор. Чтобы понять детали регуляции транскрипции у бактерий, необходимо провести тщательный анализ мутаций, которые влияют на данную регуляторную систему, и исследовать in vitro различные сайты связывания белков и ДНК. Регуляция транскрипции у эукариотНекий набор основных структурных генов, обеспечивающих жизнедеятельность клетки, — генов «домашнего хозяйства» — транскрибируется в большинстве активно функционирующих эукариотических клеток. В отличие от этого специфические гены, которые отвечают за уникальность тех или иных тканей или органов, транскрибируются и транслируются только в определенных клетках. Так, гены, кодирующие - и ß-субъединицы гемоглобина взрослого человека, экспрессируются исключительно в клетках — предшественниках эритроцитов. Число разных мРНК, специфичных для разных клеток, варьирует от единиц до десятков. Способность клеток включать (активировать) или выключать (ингибировать) структурные гены крайне важна для поддержания клеточной специфичности и экономного расходования энергетических ресурсов. Для включения и выключения транскрипции различных эукариотических структурных генов используется множество разнообразных высоко- 46 ГЛАВА 3
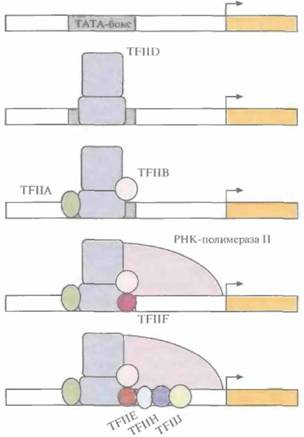
специфичных процессов. Но так или иначе регуляция транскрипции у эукариот осуществляется с помощью специфических белков -- факторов транскрипции. Многие из них связываются непосредственно с нуклеотидной последовательностью длиной менее 10 п.н., называемой по-разному: боксом, модулем, элементом инициации, регуляторным элементом. В отличие от прокариот у эукариот опероны в большинстве своем отсутствуют, т. е. каждый эукариотический структурньй ген имеет свой собственный набор регуляторных элементов. Существенную роль в регуляции транскрипции у эукариот, помимо опосредованной взаимодействием между ДНК и белками, играют также белок-белковые взаимодействия. Несмотря на индивидуальность набора регуляторных элементов у структурных генов эукариот, каждый из них имеет промоторный участок (ТАТА-бокс, или бокс Хогнесса) из восьми нуклеотидов, включающий последовательность ТАТА; последовательность ССААТ (САТ-бокс); участок из повторяющихся динуклеотидов GC (GC-бокс). Эти элементы находятся на расстоянии 25, 75 и 90 п.н. от сайта инициации соответственно (рис. 3.23). Транскрипция структурного гена эукариот начинается со связывания с ТАТА-боксом фактора транскрипции HD (TFIID), который представляет собой комплекс по крайней мере из 14 белков. Затем с TFIID и участками ДНК, примыкающими к ТАТА-бок-су, связываются другие факторы транскрипции, и, наконец, со всем этим транскрипционным комплексом связывается РНК-полимераза II. Затем при участии дополнительных факторов происходит инициация транскрипции в точке + 1 (рис. 3.24). Ясно, что если последовательность ТАТА отсутствует или существенно изменена,
то транскрипция структурного гена становится невозможной. Идентифицированы также факторы транскрипции, специфичные для регуляторных элементов ССААТ и GC, но пока неясно, как ДНК-белковые взаимодействия могут влиять в этом случае на эффективность транскрипции, если элементы расположены на расстоянии более 75 п.н. от сайта инициации. Кроме того, на расстоянии сотен и даже тысяч пар оснований от сайта инициации находится так называемая энхансерная последовательность, которая многократно повышает скорость транскрипции структурных генов. По-видимому, ДНК, РНК и синтез белка 47 сближение удаленных регуляторных элементов и соответствующего структурного гена происходит при укладке хромосомной ДНК. Кроме того, факторы транскрипции, которые связываются с определенными энхансерами и регуляторными элементами, могут образовывать цепочку, соединяющую удаленные друг от друга сайты. Некоторые репрессированные (неэкспрессирующиеся) гены активируются каскадом событий, который запускается каким-либо специфическим внеклеточным сигналом, например повышением температуры или синтезом гормона. Гормон, поступив в кровоток, связывается с рецепторами специфических клеток, облегчающими его проникновение в клетку. Оказавшись в клетке, гормон вступает во взаимодействие с одним из клеточных белков и изменяет его конформацию. В таком измененном состоянии белок проникает в ядро и связывается со специфическим регуляторным элементом, который инициирует транскрипцию соответствующего гена. Существуют также белки, которые, взаимодействуя с регуляторными элементами, блокируют транскрипцию. Например, известен класс генов позвоночных (примерно 18), активно транскрибирующихся только в нервных клетках. Каждый из этих генов имеет регуляторный элемент из 24 п.н., находящийся «левее» (upstream) сайта +1; он обозначается NRSE (от англ, neuron-restrictivesilencerelement). Во всех клетках, кроме нейронов, синтезируется NRSF-фактор (от англ, neuron-restrictivesilencerfactor), который связывается с NRSE и блокирует транскрипцию соответствующих генов. В нейронах NRSF не синтезируется, и упомянутые гены активно транскрибируются. Итак, регуляция транскрипции у эукариот -это очень сложный процесс. Структурный ген может иметь множество регуляторных элементов, которые активируются специфическими сигналами в клетках разного типа в разное время клеточного цикла. Однако некоторые структурные гены находятся под контролем уникального фактора транскрипции. Специфические белки могут взаимодействовать с определенными регуляторными элементами и блокировать транскрипцию или связываться со всем транскрипционным комплексом еще до инициации транскрипции или во время элонгации. ЗАКЛЮЧЕНИЕМолекула ДНК состоит из двух антипараллельных полинуклеотидных цепей, образующих двойную спираль. Их мономерной единицей является нуклеотид, который состоит из азотистого основания, дезоксирибозы и фосфатной группы. Соседние нуклеотиды в цепи связаны фосфодиэфирными связями, а цепи удерживаются вместе с помощью водородных связей, образующихся между комплементарными основаниями. При этом аденин образует водородные связи только с тимином, гуанин — только с цитозином. Процесс удвоения ДНК называется репликацией. В нем участвует множество различных белков, прежде всего ДНК-полимеразы. Каждая из цепей ДНК служит матрицей для синтеза комплементарной цепи. Комплемен-тарность оснований противоположных цепей гарантирует идентичность новосинтезированной и исходной ДНК. Ключевую роль в осуществлении всех биологических функций играют белки. Белковая молекула — это полипептид, состоящий из аминокислот, которые соединены друг с другом пептидными связями. Последовательность аминокислот в белке определяется последовательностью нуклеотидов в ДНК. В синтезе белков участвуют молекулы РНК (мРНК, рРНК и тРНК), различные ферменты и белковые факторы. Все РНК синтезируются на ДНК как на матрице; этот процесс называется транскрипцией. Правильность транскрипции, т. е. ее начало и завершение в нужных сайтах, обеспечивают специфические нуклеотидные последовательности в ДНК и белковые факторы. У эукариот большинство структурных генов состоит из кодирующих (экзоны) и некодирующих (интроны) участков. Первичные транскрипты содержат как те, так и другие. Однако по окончании транскрипции интроны вырезаются, а экзоны сшиваются с образованием функциональной мРНК. В мРНК содержится в закодированном виде информация о последовательности аминокислот в молекуле соответствующего белка. Синтез белка называется трансляцией. Важную роль в нем играют молекулы тРНК и рРНК. В клетке присутствует более 50 разных тРНК. 48 ГЛАВА 3 Каждая из них строго специфически связывается своим 3'-концом с одной из 20 аминокислот. На 5'-конце тРНК находится последовательность из трех нуклеотидов (антикодон), обеспечивающая связывание тРНК с комплементарным участком из трех нуклеотидов в молекуле мРНК, Существуют две основные разновидности рРНК: малая и большая. Они объединяются соответственно с малой и большой субъединицами рибосомы — особой структуры, в которой и протекает синтез белка. У прокариот молекулы рРНК имеют меньший размер, чем у эукариот. У прокариот трансляция начинается со связывания мРНК с малой рибосомной субъединицей. Затем происходит комплементарное спаривание первого кодона мРНК с антикодоном инициаторной тРНК (fMet-тΡΗΚ), к образовавшемуся комплексу присоединяется большая ри-босомная субъединица, и образуется комплекс инициации (иниииаторный комплекс), готовый к синтезу полипептидной цепи. У эукариот трансляция начинается с присоединения инициаторной тРНК, которая несет остаток метионина (Меt-тРНКМеt), к малой рибосомной субъединице; с этой же субъединицей связывается своим 5'-концом мРНК. Малая субъединица перемещается вдоль мРНК до тех пор, пока не дойдет до первого AUG-кодона. Этот кодон образует комплементарную пару с антикодоном UAC инициаторной тРНК. Далее к этому комплексу присоединяется большая субъединица, и образуется рибосома, готовая к синтезу белка. Элонгация и терминация трансляции у про-и эукариот во многом сходны. После образования инициаторного комплекса следующий кодон мРНК спаривается с антикодоном тРНК, несущей соответствующую аминокислоту (обозначим ее АК2). Первая аминокислота в полипептидной цепи, метионин, отщепляется от тРНК и соединяется с АК2 с помощью пептидной связи. Свободная тРНКМеt покидает рибосому. Рибосомный комплекс перемещается вдоль молекулы мРНК, и пептидил-тРНК, т. е. комплекс Ме1-АК2-тРНКАК2, занимает место, освобожденное отделившейся тРНК. Следующий кодон мРНК спаривается с соответствующим антикодоном тРНК, несущим аминокислоту АК3. АК2 отщепляется от своей тРНК и соединяется с АКЗ с помощью пептидной связи, образуя комплекс Меt-АК2-АК3-тРНКАК3. Освободившаяся от аминокислоты тРН К покидает рибосому. Рибосомный комплекс опять перемещается вдоль молекулы мРНК, и Меt-АК2-АК3-тРНКАК3 занимает вакантное место, занимаемое прежде предыдущей пептидил-тРНК. Эти события повторяются до тех пор, пока рибосома не дойдет до стоп-кодона. Антикодона, который был бы комплементарен стоп-кодону, нет ни у одной из тРНК. Однако стоп-кодон распознается неким белковым фактором освобождения; после присоединения этого фактора к рибосоме связь между последней тРНК и синтезированным полипептидом гидролизуется, тРНК, мРНК и полипептид высвобождаются, а рибосома диссоциирует на субъединицы. Синтез мРНК и соответственно синтез белка должны строго регулироваться, поскольку у клетки недостаточно ресурсов для одновременной транскрипции и трансляции всех структурных генов. И про-, и эукариоты постоянно синтезируют только те мРНК, которые необходимы для выполнения основных клеточных функций. Экспрессия остальных структурных генов осуществляется под строгим контролем регуляторных систем, запускающих транскрипцию только в том случае, когда возникает потребность в определенном белке (белках). У прокариот транскрипция инициируется связыванием РНК-полимеразы с последовательностями ТАТА и TTGAC промоторной области структурного гена или оперона. Включение или выключение некоторых оперонов осуществляется при участии эффектора, который изменяет конформацию белка-репрессора и препятствует блокированию транскипции. При уменьшении концентрации эффектора в клетке репрессор связывается с участком ДНК, примыкающим к сайту инициации транскрипции, и препятствует перемещению РНК-полимеразы вдоль молекулы ДНК, блокируя таким образом транскрипцию. В других оперонах с участком ДНК, соседствующим с сайтом инициации траскрипции, связывается белок-активатор, который увеличивает скорость транскрипции. Связывание эффектора с активатором может снижать скорость транскрипции, ДНК-белковые взаимодействия, ответственные за регуляцию транскрипции, ДНК, РНК и синтез белка 49 строго специфичны в отношении определенных структурных генов или оперонов. У эукариот РНК-полимераза II, которая транскрибирует структурные гены, связывается с целым набором белков — факторов транскрипции, которые последовательно присоединяются к ТАТА-последовательности промоторной области. За включение и выключение транскрипции отвечают дополнительные факторы транскрипции, которые связываются с соответствующими участками ДНК. ЛИТЕРАТУРАBuratowski S. 1994. The basics of basal transcription byRNApolymerasell. Cell 77: 1-3. Kozak M. 1991. Structural features in cukaryotic mRNAs that modulate the initiation of translation. /. Biol. Chem. 266:19867-19870. Lodish H., D. Baltimore, A. Berk, S.L. Zipursky, P. Matsudaira, J. Darnell. 1995. Molecular Cell Biology. 3rd ed. Scientific American Books, Inc., New York, N.Y. Nakamura Y., K. Ito, L.A. Isaksson. 1996. Emerging understanding of translation termination. Cell 87: 147-150. Schoenherr C.J., D.J. Anderson. 1995. The neuron-restrictive silencer factor (NRSF): a coordinate represser of multiple neuron-specific genes. Science267i 1360-1363. Tate W.P., C.M. Brown. 1992. Translational termination: "stop" for protein synthesis or "pause" for regulation of gene expression. Biochemistry 31: 2443-2450. Tjian R., T. Maniatis. 1994, Transcriptional activation: a complex puzzle with few easy pieces. Cell77: 5-8. КОНТРОЛЬНЫЕ ВОПРОСЫ1. Опишите в общих чертах процесс репликации ДНК. 2. Чем различаются ДНК и РНК? 3. Опишите сходство и различие структурных генов про- и эукариот. 4. Опишите процесс элонгации полипептидной цепи. 5. Какова наиболее вероятная нуклеотидная последовательность, кодирующая следующую аминокислотную последовательность: MAGGTWYQLFPRKMWNDSTLHPFILPMNVAG. 6. Какой аминокислотной последовательности отвечает следующая нуклеотидная последовательность: GCGAUCGACGAUGUUUCUAAAAGUAU CUCAUCGAAAUG AGGGUUCG UAAUAGCGACCCGGGCGG. 7. Что такое ТАТА-бокс? 8. Что такое оперон? В чем заключается его биологическая роль? 9. Расскажите о трех разных способах регуляции транскрипции у прокариот. 10. Опишите основные элементы ДНК, ответственные за транскрипцию эукариотических структурных генов. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||