Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
|
| |
Секвенирование ДНК с помощью терминирующих дидезоксинуклеотидов |
| F. Sanger, S. Nicklen, A. R. Coulson Proc. Nail. Acad. Set. USA 74: 5463-5467, 1977 |
Специфическая ферментативная амплификация ДНК in vitro: полимеразная цепная реакция |
| К. В. Mullis, F. A. Faloona, S, J. Scharf, R. K. Saiki, G. T. Horn, H. A. Erich Cold Spring Harbor Symp, Quant. Biol. 51: 263-273, 1986 |
| Создание новых методов — это необходимая предпосылка развития любой отрасли науки. Они позволяют получать недоступную прежде информацию, что в свою очередь приводит к более глубокому пониманию сути наблюдаемых явлений и стимулирует дальнейшие исследования, порождающие новые открытия. Что касается молекулярной биотехнологии, то ее основой стали такие мощные методы, как секвенирование ДНК и ПЦР. Определение нуклеотидной последовательности ДНК методом ферментативного копирования с остановкой удлинения цепи, осуществляемого ДНК-полимеразой, — быстрый, относительно простой, недорогой и надежный метод. Помимо того что нуклеотидная последовательность фрагмента ДНК является его исчерпывающей характеристикой на молекулярном уровне, она позволяет также идентифицировать его кодирующую область, подобрать потенциальные праймеры для ПЦР, выявить мутационные изменения в гене. До появления в 1977 г. дидезоксиметода Сангера для секвенирования ДНК использовали метод сайт-специфического химического расщепления цепи (А. М, Maxani, W. Gilbert, Proc. Natl. Acad. Sei. USA 74: 560-564, 1977). А еще | раньше секвенирование нуклеиновых кислот сводилось к определению нуклеотидных последовательностей РНК. Для этого нужный фрагмент ДНК сначала транскрибировали в РНК с помощью РНК-пол имеразы, а затем определяли нуклеотидную последовательность последней. Процедура была весьма сложной и длительной и состояла в следующем: радиоактивно меченную РНК обрабатывали различными рибонуклеазами, затем осуществляли хроматографическое разделение образовавшихся продуктов, повторно обрабатывали их ферментами, проводили щелочной гидролиз продуктов второго расщепления, осуществляли хроматографическое разделение продуктов гидролиза, определяли очередность олигонуклеотидов, основываясь на перекрывании их концевых участков, и воссоздавали исходную молекулу. С появлением дидезокси-метода эта процедура практически перестала использоваться. Теперь секвенируют не саму РНК, а ДНК, синтезированную на РНК как на матрице с помощью обратной транскриптазы, и применяют не метод Максама и Гилберта, а метод Сангера, появившийся после того, как была | создана система клонирования на основе фага M13. Возможность прямого секвенирования ДНК произвела настоящую революцию в исследовании молекулярных основ различных болезней человека и в разработке методов их диагностики и лечения. Огромное влияние на многие области исследований, в том числе и на молекулярную биотехнологию, оказала разработка метода ПЦР (Kary Mullis; U.S. patent 4,683,202), С возможностью получения больших количеств ДНК амплификацией сегментов клонированной или геномной ДНК была решена проблема клонирования ДНК-копий редких молекул мРНК, скрининга геномных библиотек, выявления генных мутаций, физического картирования хромосом и т. д. Первым практическим применением ПЦР было создание тест-системы для диагностики серповидноклеточной анемии (Saîki et al., Science 230: 1350-1354, 1985). ПЦР — это уникальная методика, равных которой нет среди других хорошо известных методов. Начиная с 1986 г. с ее помощью выполнено более 10 000 исследований, и несмотря на их огромное разнообразие, перспективы использования ПЦР представляются еще более впечатляющими. |
настоящее время наиболее широко используется так называемый дидезоксинуклеотидный метод.
Дидезоксинуклеотидный метод секвенирования ДНК
Дидезоксинуклеотид — это полученный искусственным путем нуклеотид, лишенный 2'- и 3'-гидроксильных групп при углеродных атомах сахарного кольца (рис. 5.11, А). У дезоксинуклеотида, входящего в норме в состав ДНК, отсутствует только 2'-гидроксильная группа (рис. 5.11,5). Удлинение цепи во время репликации ДНК происходит в результате присоединения очередного нуклеозидтрифосфата к 3'-гидроксильной груп-
90 ГЛАВА 5
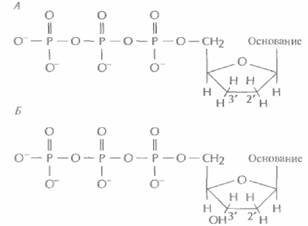 |
| Рис, 5.11. А. Дидезоксинуклеотид (отсутствуют 2'- и 3'-гидроксильные группы в кольце). Б. Дезоксинуклеотид (отсутствует только 2'-гидроксильная группа). |
пе последнего нуклеотида растущей цепи (рис. 5.12). И если таким очередным присоединяемым звеном является Дидезоксинуклеотид, то синтез ДНК останавливается, поскольку следующий нуклеотид не может образовать фосфодиэфирную связь (рис. 5.13). Остановка синтеза ДНК — это ключевой этап дидезоксиметода, но чтобы осуществить секвенирование в полном объеме, необходимо выполнить целый ряд условий.
Первый шаг стандартной процедуры дидезоксисеквенирования состоит в гибридизации синтетического олигонуклеотида длиной 17—20 звеньев со специфическим участком одной из цепей клонирующего вектора, соседствующим со вставкой. Этот олигонуклеотид является праймером, поставляющим 3'-гидроксильную группу для инициации синтеза. Раствор с праймером распределяют по четырем пробиркам, в каждой из которых находятся четыре дезоксинуклеотида, dATP, dCTP, dGTP и dTTP (один из них — изотопно меченный), и один из четырех дидезоксинуклеотидов (ddATP, ddCTP, ddGTP или ddTTP). Концентрацию каждого дидезоксинуклеотида подбирают таким образом, чтобы он оказался включенным по всем позициям в смеси растущих цепей, а не только в первой встретившейся ему позиции. (Напомним, что после присоединения дидезоксинуклеотида рост цепи сразу останавливается,
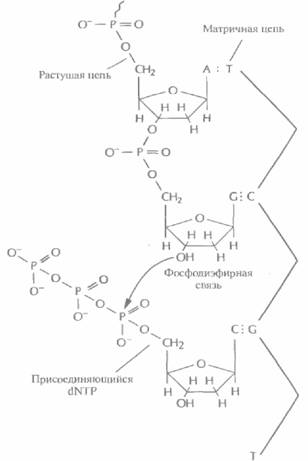 | Рнс. 5,12. Синтез ДНК в обычных условиях. Очередной дезоксирибонуклеотид (дезоксирибонуклеозидтрифосфат; dNTP) спаривается с комплементарным нуклеотидом матричной цепи. Между 3'-гидроксильной группой последнего нуклеотида в растущей цепи и α-фосфатной группой присоединяемого нуклеотида образуется фосфодиэфирная связь. |
поэтому каждая цепь оканчивается 3'-дидезоксинуклеотидом.) По окончании ферментативного синтеза при участии ДНК-полимеразы в каждой пробирке оказывается уникальный набор олигонуклеотидов, каждый из которых содержит праймерную последовательность (рис. 5.14).
Далее в пробирки добавляют формамид, чтобы обеспечить расхождение цепей, и проводят электрофорез в полиакриламидном геле на четырех дорожках (по числу пробирок). Это поз-
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 91
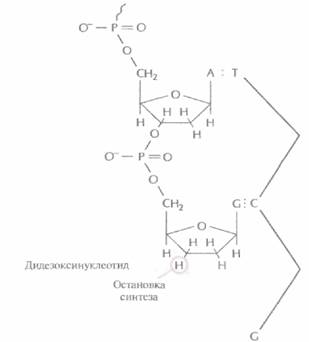 |
| Рис. 5.13. Остановка синтеза ДНК после присоединения дидезоксинуклеотида к концу растущей цепи. Фоофодиэфирная связь между концевым дидезоксинуклеотидом и следующим нуклеотидом не может образоваться из-за отсутствия 3'-гидроксильной группы. |
воляет разделить одноцепочечные фрагменты ДНК, даже если они различаются по длине всего на один нуклеотид. На радиоавтографе обнаруживается набор полос, отвечающих меченым фрагментам ДНК, сопоставление которых позволяет прямо «прочитать» нуклеотидную последовательность секвенируемого сегмента ДНК. В примере, приведенном на рис. 5.15, первые шесть нуклеотидов этого сегмента, начиная с 5'-конца, — это AGCTGC. Самая «быстрая» полоса (радиоактивно меченный фрагмент в самом низу геля) соответствует самому короткому фрагменту и находится в дорожке ddATP; следующие полосы располагаются соответственно в дорожках ddGTP, ddCTP, ddTTP и т. д. На большинстве радиоавтографов четко различаются от 250 до 350 полос. Праймерная последовательность находится на фиксированном расстоянии (10—20 нуклеотидов) оттого сайта, по которому встроена клонированная ДНК, что позволяет легко распознать начало клонированного фрагмента.
Секвенирование ДНК с помощью вектора на основе фага M13
Для определения нуклеотидной последовательности клонированных ДНК используются разные подходы. Один из первых основывался на
 | Рис. 5.14. Удлинение праймера при синтезе цепи в присутствии дидезоксинуклеотидов. В каждой из четырех пробирок образуется уникальный набор олигонуклеотидов разной длины, включающих праймерную последовательность. При этом образуется и какое-то число полноразмерных молекул ДНК. dNTP — дезоксинуклеозидтрифосфат |
92 ГЛАВА 5
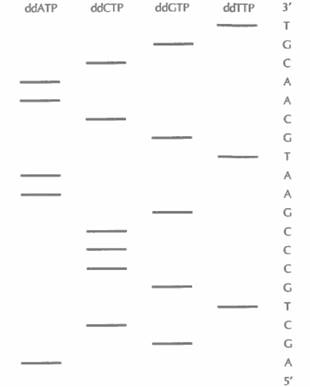 |
| Рис. 5.15. Схематическое изображение радиоавтографа, получающегося при секвенировании ДНК с помощью дидезокси-метода. В каждую из лунок вносили содержимое одной из четырех пробирок, в которых находился один из дидезоксинуклеотидов: ddATP, ddCTP, ddGTP или ddTTP. Нуклеотидная последовательность считывается с радиоавтографа снизу вверх. На рисунке она приведена справа. |
применении фага M13 E. coli в качестве вектора. ДНК этого фага представляет собой одноцепочечную кольцевую молекулу. Когда им инфицируют E. coli, сначала образуется двухцепочечная репликативная форма фаговой ДНК, а одноцепочечные кольцевые молекулы, которые затем упаковываются в вирионы, синтезируются на этой двухцепочечной молекуле как на матрице. Клетки, инфицированные М13, не подвергаются лизису; в них непрерывно образуются новые одноцепочечные молекулы ДНК М13, которые, проходя через клеточную мембрану, одеваются белковой оболочкой и выходят в окружающую среду. ДНК М13 содержит несущественную часть, которую можно заменить нужным фрагментом ДНК; при этом инфекционность рекомбинантных вирусных частиц сохранится. МП-система имеет следующие преимущества: выделенная двухцепочечная репликативная форма может функционировать как плазмида, а одноцепочечная фаговая ДНК — использоваться в качестве матрицы для секвенирования ДНК.
Все это позволяет использовать фаг M13 как комбинированную систему для клонирования и секвенирования ДНК. Обычно нужный фрагмент ДНК длиной примерно 500 п. н. встраивают в полилинкер, который является частью клонированного в РФ-ДНК фага М13 модифицированного гена IacZ', Рекомбинантной вирусной ДНК трансформируют компетентные клетки Е. coli ивысевают их на чашки со средой, содержащей субстрат X-Gal. При его гидролизе ß-галактозидазой образуется продукт, имеющий синюю окраску. На чашках появляются белые (бесцветные) и синие колонии. Первые отвечают клеткам, инфицированным фагом М13 со вставкой, нарушившей рамку считывания гена IacZ', вторые — клеткам, инфицированным фагом М13 с функциональным геном IacZ', не несущим вставки. Из белых колоний выделяют фаговые частицы, а из них — одноцепочечную ДНК со вставкой (рис. 5.16), Для секвенирования последней отжигают выделенную ДНК с праймером, который гибридизуется с последовательностью вблизи вставки, затем проводят дидезокси-секвенирование, электрофорез и радиоавтографию и «прочитывают» нуклеотидную последовательность вставки.
Для секвенирования крупных фрагментов ДНК (примерно 2000 п. н.) используют другие стратегии. Одна из них состоит в следующем. Встраивают этот фрагмент в соответствующий плазмидный вектор и строят его подробную рестрикционную карту. Идентифицируют перекрывающиеся фрагменты вставки длиной от 100 до 500 п. н., субклонируют каждый из них в ДНК М13, секвенируют и воссоздают нуклеотидную последовательность всего исходного фрагмента. Чтобы быть уверенным в правильности полученного результата и идентификации какого-либо нуклеотида, необходимо секвенировать обе цепи по нескольку раз. Секвенирование обеих цепей облегчается тем, что каждый из субклонированных фрагментов исходной ДНК может быть встроен в ДНК М13 в противоположных
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 93
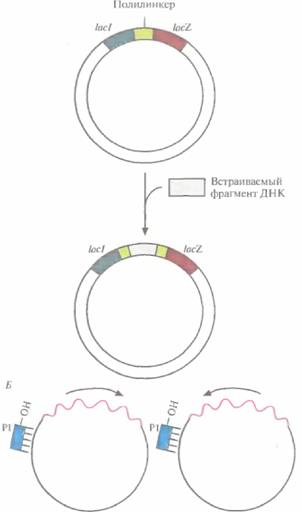 |
| Рис. 5.16. Использование бактериофага М13 для клонирования и секвенирования. А. Встраивание фрагмента ДН К в двухцепочечную репликативную форму ДНК М13. Б. Секвенирование комплементарных цепей клонированного фрагмента ДНК с помошью одного и того же лраймера (Р1). Стрелками показана ориентация вставки в векторе. |
ориентациях. В результате в одном случае праймер будет инициировать синтез первой цепи, а в другом — второй.
Праймер-опосредованная прогулка («Блуждающая затравка»)
Для секвенирования очень длинных фрагментов ДНК (>5000 п. н.) описанный выше подход уже не может быть использован, поскольку число КПЗ-векторов, содержащих перекрывающиеся субклонированные последовательности, значительно увеличивается. Чтобы решить эту задачу, были разработаны методы секвенирования двухце почечных плазмидных ДНК, не требующие субклонирования. Плазмидную ДНК, содержащую нужную вставку, выделяют и отжигают с синтетическим олигонуклеотидным праймером, который гибридизуется с последовательностью в одной из цепей векторной ДНК, находящейся вблизи вставки. Затем осуществляют дидезокси-секвенирование, позволяющее идентифицировать первые 250—350 нуклеотидов вставки. Исходя из этих данных синтезируют второй олигонуклеотидный праймер, комплементарный сегменту вставки, отстоящему примерно на 300 нуклеотидов от места связывания первого праймера, и секвенируют следующие 250—350 нуклеотидов. Аналогичным образом синтезируют третий праймер и определяют нуклеотидную последовательность следующих 250—350 нуклеотидов (рис. 5.17). Эту процедуру, называемую праймер-опосредованной прогулкой, продолжают до тех пор, пока не секвенируют весь фрагмент. Аналогичным образом секвенируют вторую цепь, начиная с праймера, который гибридизуется с этой цепью вблизи вставки.
К сожалению, в результате ошибочного спаривания праймера заданной длины с более чем одним участком внутри вставки могут быть получены неоднозначные результаты. Чтобы избежать этого, используют праймеры длиной не менее 24 нуклеотидов и стараются строго соблюдать условия отжига. Именно таким образом были секвенированы фрагменты ДНК, клонированные в бактериофаге λ (20 т. п. н.) или в космидном векторе (40 т. п. н.).
Некоторые этапы этого процесса недавно были автоматизированы. Это позволило проводить рутинное секвенирование фрагментов длиной несколько десятков тясяч пар нуклеотидов. Во многих случаях праймеры, добавляемые в реакционную смесь в разных пробирках, метят различными флуоресцентными красителями с разной длиной волны флуоресценции. Затем содержимое всех четырех пробирок соединяют и проводят электрофорез на одной дорожке. Дорожку сканируют в луче лазера и регистрируют
94 ГЛАВА 5
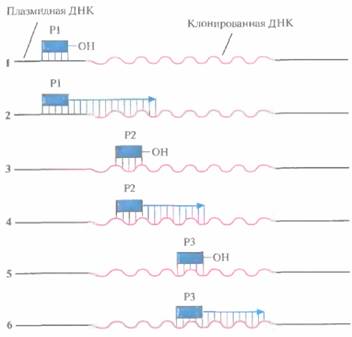 | Рис. 5.17. Секвенирование ДНК методом праймер-опосредованной прогулки. 1. Инициация синтеза цепи ДНК с помощью праймера (Р1), комплементарного участку плазмиды, находящемуся вблизи вставки. 2. Секвенирование фрагмента клонированной ДНК длиной 250-350 нуклеотидов. 3. Подбор второго праймера, комплементарного концевому участку уже секвенированной последовательности длиной примерно 20 нуклеотидов. 4. Секвенирование следующего сегмента клонированной ДНК с помощью второго праймера (Р2). 5. Подбор третьего праймера, комплементарного концевому участку этого сегмента размером 20 нуклеотидов. 6. Третий праймер (РЗ) используется для секвенирования следующего сегмента клонированной ДНК. Эту процедуру продолжают до тех пор, пока не будет секвенирована вся вставка. |
положение каждой флуоресцирующей полосы. Все данные вводят в компьютер, который сопоставляет их и выводит на дисплей нуклеотидную последовательность,
Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР) — это эффективный способ получения in vitro большого числа копий специфических нуклеотидных последовательностей. Их амплификация — иногда в миллионы раз — осуществляется в ходе трехэтапного циклического процесса. Для ПЦР необходимы: I) два синтетических олигонуклеотидных праймера (длиной примерно по 20 нуклеотидов), комплементарные участкам ДНК из противоположных цепей, фланкирующим последовательность-мишень; их 3'-гидроксильные концы после отжига с ДНК. должны быть ориентированы навстречу друг другу; 2) ДНК-мишень длиной от 100 до - 35 000 п. н.; 3) термостабильная ДНК-полимераза, которая не теряет своей активности при температуре 95° и выше; 4) четыре дезоксирибонуклеотида.
Типичная ПЦР-амплификация состоит в многократном повторении следующих трех реакций.
1. Денатурация. Первый этап ПЦР состоит в тепловой денатурации образца ДНК выдерживанием его при температуре 95 °С в течение по крайней мере ) мин. Помимо ДНК, в реакционной смеси содержатся в избытке два праймера, термостабильная ДНК-полимераза Taq, выделенная из бактерий Thermus aquaticus, и четыре дезоксирибонуклеотида.
2. Ренатурация. Температуру смеси медленно понижают до 55 °С, при этом праймеры спариваются с комплементарными последовательностями ДНК.
3. Синтез. Температуру повышают до 75 °С - величины, оптимальной для ДНК-полимеразы Taq. Начинается синтез комплементарной цепи ДНК, инициируемый 3'-гидроксильной группой праймера (рис. 5.18),
Все реакции проводят в пробирках, погруженных в термостат. Смена температурного режима и его поддержание осуществляются автоматически. Каждый цикл обычно длится 3—5 мин.
Чтобы понять, как именно происходит амплификация определенного сегмента ДНК в ходе ПЦР, нужно четко представлять положение всех праймеров и комплементарных им последователь-
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 95
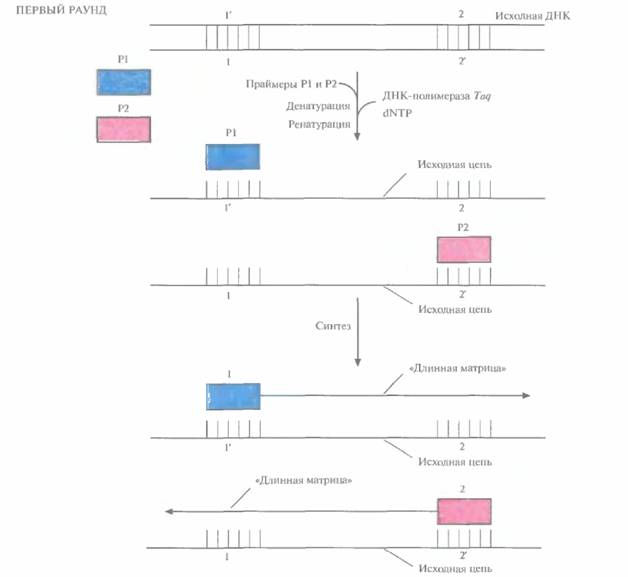 |
| Рис. 5.18. Первый раунд ПЦР. ДНК-мишень фланкирована последовательностями 1'—2 в одной цепи и последовательностями 1—2' — в другой. К образцу ДНК добавляют праймеры (Р1 и Р2), ДНК-полимеразу Tag и четыре дезоксирибонуклеозидтри фосфата (dNTP). Смесь нагревают до 95 °С, инкубируют в течение 1 мин и медленно охлаждают до 55 °С. При этой температуре праймеры, добавленные в избытке, спариваются с разделенными цепями. Повышают температуру до 75 °С. В этих условиях происходит синтез обеих цепей ДНК, начинающийся с 3'-гидроксильных концов праймеров. Каждая из синтезированных цепей имеет гораздо большую длину, чем расстояние от 3'-гидроксильной группы «ее» праймера до концевого нуклеотида последовательности, комплементарной второму праймеру. Эти цепи служат матрицами во втором раунде ПЦР. |
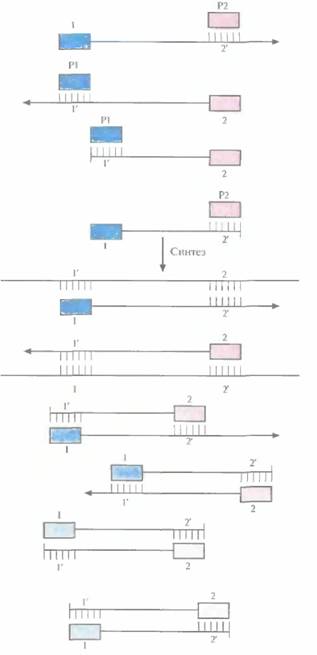
ностей в амплифицируемых цепях в каждом раунде. В первом раунде каждая из новосинтезированных цепей имеет гораздо большую длину, чем расстояние от 3'-гидроксильной группы «ее» праймера до концевого нуклеотида последовательности, комплементарной второму праймеру. Такие цепи называют «длинными матрицами», именно на них будет идти дальнейший синтез (рис. 5.18).
96 ГЛАВА 5
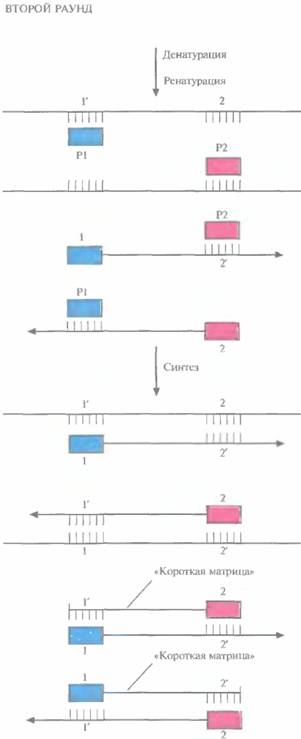 | Рис. 5.19. Второй раунд ПЦР. Исходным материалом в этом случае является смесь молекул ДНК, образовавшихся в первом раунде (рис. 5.18). При отжиге праймеры гибридизуются с комплементарными им участками как исходных цепей, так и «длинных матриц», синтезированных в первом раунде. В результате ферментативного синтеза in vitro на исходных цепях синтезируются «длинные матрицы», а на «длинных матрицах» — «короткие». Последние начинаются с одного праймера, а заканчиваются последовательностью, комплементарной второму праймеру. |
Во втором раунде двухцепочечную ДНК, состоящую из исходной и новосинтезированной («длинная матрица») цепей, опять подвергают денатурации, а затем отжигают с праймерами. Во время синтеза в этом раунде вновь синтезируются «длинные матрицы», а также некоторое количество цепей с праймером на одном конце и с последовательностью, комплементарной второму праймеру, на другом («короткие матрицы») (рис. 5.19). Во время третьего раунда все гетеродуплексы, образовавшиеся ранее, одновременно подвергаются денатурации и отжигу с праймерами, а затем реплицируются (рис. 5.20). В последующих раундах «коротких матриц» становится все больше, и к 30-му раунду их число уже в 106 раз превышает число исходных цепей или«длинных» матриц (рис. 5.21).
Метод ПЦР получил широкое распространение. Разнообразные случаи его применения мы рассмотрим в последующих главах. Здесь упомянем лишь некоторые из них. Один из важнейших - идентификация патогенных микроорганизмов, возбудителей заболеваний человека, животных и растений. С появлением ПЦР отпала необходимость в выделении и очистке ДНК-мишени; для анализа можно использовать очень небольшое количество неочищенного материала. Для синтеза праймеров, специфичных в отношении исключительно ДНК-мишени, нужно знать нуклеотидную последовательность ДНК предполагаемого патогенного микроорганизма. В этом случае в ходе ПЦР будет амплифицироваться только фрагмент ДНК, длина которого равна суммарной длине двух праймеров и фрагмента ДНК между ними.
ПЦР — высокочувствительный метод, поэтому при наличии в исследуемом образце даже ничтожного количества ДНК, случайно попавшей
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 97
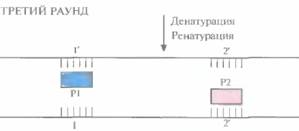 | Рис. 5.20. Третий раунд ПЦР. При отжиге праймеры гибридизуются с комплементарными участками исходных цепей, а также «длинных» и «коротких» матриц. При ферментативном синтезе in vitro на исходных цепях синтезируются «длинные» матрицы», а на «длинных» и «коротких» матрицах — только «короткие матрицы». |
 | 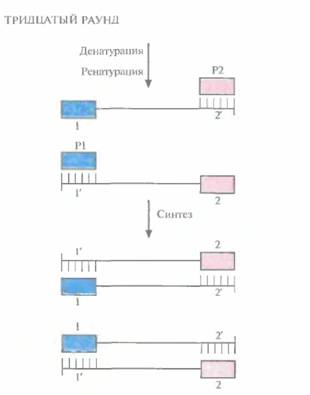 |
| Рис. 5.21. Тридцатый раунд ПЦР. На этом этапе в реакционной смеси содержатся практически одни «короткие матрицы». |
из одной реакционной смеси в другую, могут быть получены ложноположительные результаты. Это заставляет тщательно контролировать все используемые для ПЦР растворы и посуду. Метод ПЦР применяется также для выявления спонтанных мутаций, внесения специфических мутаций in vitro, сборки полноразмерных генов из синтетических олигонуклеотидов, секвенирования ДНК. Во многих случаях возникает необходимость в клонировании ПЦР-продукта. Однако прямое клонирование с помощью лигирования по тупым концам затруднено, по-
98 ГЛАВА 5
скольку полимераза Tagприсоединяет к 3'-концу синтезируемой цепи лишний адениннуклеотид, что снижает эффективность лигирования. Но если вектор для клонирования обработать рестрицирующей нуклеазой с образованием новых тупых концов и затем проинкубировать с полимеразой Taq в присутствии dТТР, то к обоим 3'-концам фрагментов добавится по одному тимидиннуклеотиду. Взаимной комплементарности концевых участков вектора и ПЦР-продукта протяженностью в один-единственный нуклеотид оказывается достаточно для спаривания молекул и их последующего лигирования.
Получение с помощью ПЦР кДНК, отвечающих концам молекул мРНК
С помощью ПЦР можно получать комплементарные ДНК (кДНК), отвечающие 3'- или 5'-концевым участкам специфических информационных РНК (мРНК). Для обозначения этого метода используется сокращение RACE — от англ, rapidamplificationof с DNA ends(быстрая
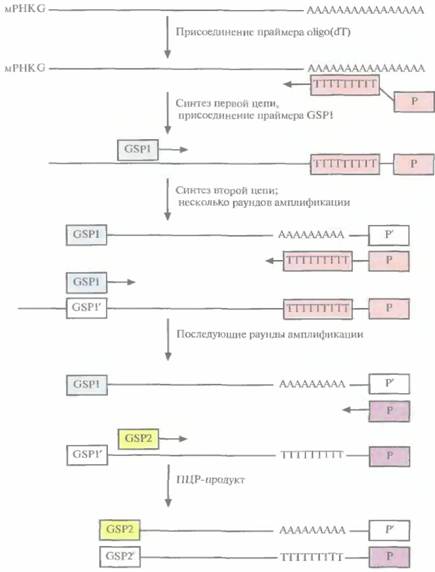 | Рис. 5.22. ПЦР-амплификация кДНК, комплементарной 3 '-концевой части мРНК. Первая цепь кДНК образуется в результате обратной транскрипции мРНК при участии oligo(dT) в качестве праймера Вторая цепь синтезируется на первой цепи как на матрице с помощью полимеразы Tagи ген специфичного праймера (GSP1). В последующих раундах ПЦР используются праймеры GSP2 и P. |
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 99
амплификация концов кДНК). Обозначения 3' RACE и 5' RACE относятся к амплификации кДНК, отвечающих соответствующим концам мРНК. В обоих случаях для проведения ПЦР-амплификации нужно знать нуклеотидную последовательность кодирующей области мРНК-мишени, чтобы синтезировать генспецифичный праймер (GSP). В случае 3' RACE праймером для синтеза первой цепи кДН К служит oligo(dT) с присоединенным к нему вторым праймером (Р) (рис. 5.22). Oligo(dT) спаривается с poly(A)-хвостом мРНК, и обратная транскриптаза синтезирует цепь, комплементарную мРНК. Вторая цепь кДНК синтезируется на первой при участии GSP, комплементарного кодирующей области данной мРНК, с помощью полимеразы
| Рис. 5.23. ПЦР-амплификация кДНК, комплементарной 5'-концевой части мРНК первой цепи, осуществляемая обратной транскриптазой, инициируется праймером GSP. Затем к этой цепи с помощью концевой дезоксинуклеотидилтрансферазы присоединяется ро1у(А)-хвост. Для синтеза второй цепи в качестве праймера используется oligo(dT). Проводят несколько раундов амплификации при участии указанных праймеров, добавляют вторые праймеры (GSP2 и Р) и получают кДНК, отвечающую 5'-концу мРНК. | 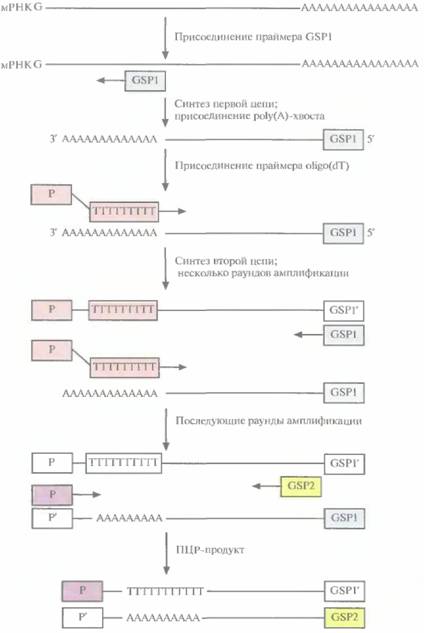 |
100 ГЛАВА 5
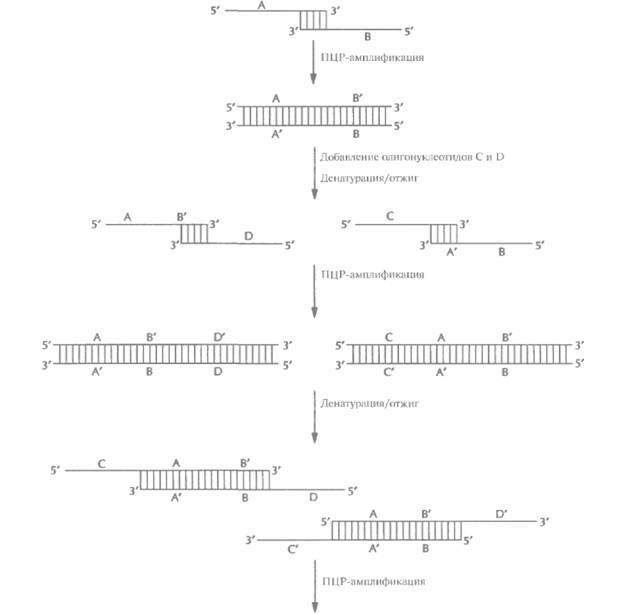 |
| Рис. 5.24. Синтез генов с помощью ПЦР. Перекрывающиеся олигонуклеотиды (А и В) отжигают и достраивают образовавшийся дуплекс с заглубленными 3'-гидроксильными концами. Двухцепочечные молекулы денатурируют, добавляют в реакционную смесь вторую пару олигонуклеотидов (С и D), перекрывающихся с продуктами первого раунда ПЦР, и отжигают. Осуществляют второй раунд ПЦР, добавляют следующую пару олигонуклеотидов (Е и F), осуществляют третий раунд ПЦР и т. д. В результате образуется двухцепочечная ДНК. идентичная искомому гену. Одинаковыми буквами со штрихом или без (А' и А, В и В' и т. д.) обозначены комплементарные участки ДНК. Нуклеотидная последовательность каждого олигонуклеотида соответствует таковой определенных сегментов ДНК. |
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 101
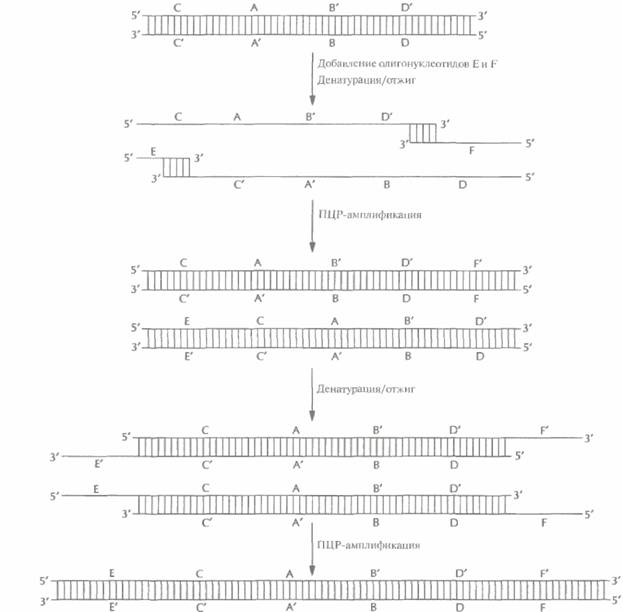 |
| Рис. 5.24. (Продолжение) |
Tag. По завершении нескольких раундов ПЦР, в которых использовались указанные выше праймеры, добавляют вторую пару праймеров, которые связываются по соседству с двумя первыми. Такие тесно расположенные праймеры называются внутренними. Вторая пара праймеров необходима, поскольку без них нельзя амплифицировать полноразмерную молекулу-мишень. Конечным ПЦР-продуктом является кДНК, соответствующая 3'-концу искомой мРНК.
В случае 5'RACE праймером для синтеза первой цепи кДНК служит GSP (рис. 5.23). Новосинтезированную цепь обрабатывают концевой дезоксинуклеотидилтрансферазой в присутст-
102 ГЛАВА 5
вии dATP. Этот фермент случайным образом присоединяет дезосирибонуклеотиды к 3'-концу цепи. Поскольку в данном случае в реакционной смеси присутствует только dATP, на этом конце появляется цепочка адениновых остатков — ро1у(А)-хвост. С ним спаривается праймер P-oligo(dT). инициирующий синтез второй цепи. Проводят ограниченное число раундов ПЦР с указанными праймерами, а затем добавляют вторые праймеры и амплифицируют кДНК, отвечающую 5'-концу мРНК.
RACE-метод широко применяется по ряду причин. Обычно бывает очень трудно обнаружить кДНК, соответствующую мРНК, которая присутствует в данной ткани в маленькой концентрации. С помощью RACE-метода можно быстро получить кДНК, отвечающие концевым участкам этой мРНК, и при необходимости использовать их в качестве зондов для скрининга кДНК- и геномных библиотек. Кроме того, поскольку неполноразмерные 3'-концевые фрагменты кДНК значительно преобладают над полноразмерными, 5'RACE может восполнить недостающие 5'-концевые сегменты.
Синтез генов с помощью ПЦР
Получение генов с помощью ПЦР — гораздо более быстрый и экономичный метод, чем тот, который основан на отжиге олигонуклеотидов с перекрывающимися концами, заполнении брешей с помощью ДНК-полимеразы и сшивании разрывов ДНК-лигазой. В одной из методик конструирование гена начинается с отжига двух перекрывающихся олигонуклеотидов (А и В), отвечающих центральной части гена (рис. 5.24). После отжига образуется дуплекс с заглубленными 3'-гидроксильными группами, служащими точками инициации синтеза комплементарных цепей при ПЦР. Затем в реакционную смесь добавляют еще два олигонуклеотида, С и D. З'-конец олигонуклеотида С идентичен 5'-концу олигонуклеотида А, а сам этот олигонуклеотид отвечает участку конструируемого гена, непосредственно примыкающему к его центральной части слева. Аналогично, 3'-конец олигонуклеотида D идентичен 5'-концу олигонуклеотида В и отвечает участку гена, примыкающему к его центральной части справа. После денатурации смеси и отжига образуются дуплексы с протяженными выступающими одноцепочечными сегментами, достраивающимися с З'-концов. В ходе последующих раундов ПЦР образуется двухцепочечный продукт, состоящий из указанных выше сегментов, расположенных в порядке CABD. Молекула ДНК с заглубленными 5'-концами не достраивается.
На следующем этапе в реакционную смесь добавляют еще два олигонуклеотида, E и F. 3'-конец олигонуклеотида E идентичен 5'-концу олигонуклеотида С, а сам он отвечает участку реконструируемого гена, примыкающему слева к сегменту С. Аналогичными свойствами обладает олигонуклеотид F, если его соотносить с олигонуклеотидом D. После денатурации и ренатурации смеси образовавшиеся дуплексы с выступающими од ноцеп очечным и участками достраиваются с 3'-гидроксильных концов. В ходе последующих раундов ПЦР образуется двухиепочечный продукт ECABDF.
Следующие пары олигонуклеотидов — один «достраивающий» ген слева, другой справа -последовательно добавляют в смесь до тех пор, пока не будет синтезирован весь ген. Длина этих олигонуклеотидов обычно бывает равна 50 звеньям. Каждый «блок» ПЦР состоит из двадцати 4-минутных раундов. Для синтеза гена длиной 1000 п. н. нужно 10 «блоков», так что ген можно получить в течение одного дня. При этом, как и в случае синтеза генов другими методами, последнюю пару нуклеотидов (т. е. 5'- и 3'-концы) можно снабдить дополнительными последовательностями, фланкирующими кодирующий участок и облегчающими последующее встраивание гена в вектор.
ЗАКЛЮЧЕНИЕ
К числу наиболее важных для молекулярной биотехнологии методов, помимо клонирования генов, относятся методы химического синтеза ДНК, секвенирование ДНК и полимеразная цепная реакция (ПЦР).
Целью химического синтеза является получение одноцепочечных молекул ДНК in vitro. Успеха здесь можно достичь только при высокой эффективности образования фосфодиэфирных связей. В противном случае по окончании
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК 103
процесса будет получено очень небольшое число молекул нужного размера. Длина синтезированных in vitro молекул обычно составляет 20-30 нуклеотидов и редко превышает 100 нуклеотидов. Для получения двухцепочечных молекул комплементарные цепи синтезируют по отдельности и затем проводят отжиг. Полученную таким способом ДНК используют в качестве зондов для скрининга геномных библиотек; в качестве линкеров и адаптеров при клонировании генов; для мутагенеза in vitro; для конструирования генов с целью последующего клонирования.
Очень часто для решения биотехнологических и некоторых других задач бывает необходимо знать полную нуклеотидную последовательность клонированного гена. Для секвенирования используют несколько методов; один из них — дидезокси-метод, разработанный Сангером и др. В его основе лежит остановка синтеза цепи после присоединения к ней дидезоксинуклеотида. У такого нуклеотида отсутствует 3'-гидроксильная группа, и дальнейший рост цепи становится невозможным. Для секвенирования в разных пробирках одновременно проводят четыре реакции синтеза ДНК, каждая — в присутствии одного из четырех дидезоксинуклеотидов. Продукты реакций разделяют с помощью гель-электрофореза, проводят радиоавтографию и «считывают» с радиоавтографа нуклеотидную последовательность синтезированного фрагмента ДНК.
Для секвенирования используют также систему на основе фага M13. В ДНК фага встраивают фрагмент ДНК длиной до 500 нуклеотидов, который хотят секвенировать. Эту рекомбинантную ДНК легко получить в одноцепочечной форме и использовать ее в качестве матрицы для секвенирования вставки. Можно использовать также двухцепочечные плазмиды, содержащие клонированную ДНК.
Для определения нуклеотидной последовательности протяженных клонированных сегментов сначала подбирают синтетический олигонуклеотидный праймер, комплементарный участку, соседствующему со вставкой, и с помощью дидезокси-метода секвенируют первые 250—300 нуклеотидов. Затем по результатам секвенирования синтезируют второй праймер и определяют последовательность следующих 250—350 нуклеотидов клонированного участка, и т. д. Этот метод, называемый «праймер-опосредованной прогулкой» (или «блуждающей затравкой»), позволяет секвенировать протяженные фрагменты ДНК без их субклонирования, как в случае системы на основе фага М13.
Метод ПЦР произвел настоящую революцию в биотехнологии. Он позволяет в миллионы раз амплифицировать in vitro нужные сегменты ДНК. Процедура состоит в следующем. Подбирают два праймера, гибридизующиеся с участками ДНК, которые фланкируют искомую последовательность. Денатурируют ДНК, отжигают одноцепочечные молекулы с праймерами, добавленными в избытке, и осуществляют синтез ДНК in vitro. Для облегчения синтеза используют термостабильную ДНК-полимеразу, которая не разрушается при температуре денатурации (95 °С). Затем опять проводят денатурацию, отжиг с праймерами и синтез, и т. д. до примерно 30-го раунда. К этому времени в реакционной смеси преобладают фрагменты, на одном конце которых находится одна праймерная последовательность, а на другом — последовательность, комплементарная второму праймеру. ПЦР можно использовать для выявления патогенных микроорганизмов в том или ином биологическом материале; получения больших количеств специфических фрагментов ДНК с целью клонирования; амплификации 5'- и 3’-концов специфических мРНК; синтеза генов; выявления делеций или вставок в генах, ответственных за то или иное наследственное заболевание.
ЛИТЕРАТУРА
Chen E. Y., P. H. Seeburg. 1985. Supercoil sequencing: a fast and simple method for sequencing plasmid DNA. DNA4: 165-170.
Climie S., D. V. Santi. 1990. Chemical synthesis of the thymidylate synthase gene. Proc. Natl. Acad, Set. USA 87: 633-637.
Di Donato A., M. de Nigris, N. Riisso, S. Di Biase, G. DAlessio. 1993. A method for synthesizing genes and cDNAs by the polymerase chain reaction. Anal. Biochem. 212: 291-293.
Erlich H. A., D. Gelfand, J. J. Sninsky. 1991. Recent advances in the polymerase chain reaction. Science 151: 1643-165].
104 ГЛАВА 5
Fox D. K., B. Westfall, M. Nathan, A. J. Hughes, Jr., A. Rashtchian, D. M. Schuster. 1996. Striding new distances with 5'RACE: long 5'RACE of human APC and TSC-2 cDNA. Focus 18: 33-37.
Itakura K., J. J. Rossi, R. B. Wallace. 1984. Synthesis and use of synthetic oligonycleotides. Annu. Rev. Biochem. 53: 323-356.
Mullis К. В., F. Ferré, R. A. Gibbs (ed.). 1994. The Polymerase Chain Reaction. Birkhäuser, Boston, Mass.
Saiki R. KM D. H. Gelfand, S. Stoffel, S. Scharf, R. Higuchi, G. T. Hörn, K. B. Mullis, H. A. Erlich. 1988. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science 239:487-491.
Sanger F., S. Nicklen, A. R. Coulson. 1977. DNA sequencing with chain-terminating inhibitors. Proc. Natl. Acad. Sei. USA 74: 5463-5467.
Schuster D. M., G. W, Buchman, A. Rashtchian. 1992. A simple and efficient method for amplification of cDNA ends using 5'RACE. Focus14: 46-52.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Предположим, что ваш новый ДНК-синтезатор имеет среднюю эффективность присоединения нуклеотидов 98,5%. Каким будет выход продукта, если вы синтезируете гибридизационный зонд длиной 50 нуклеотидов?
2. Какие две стратегии химического синтеза гена длиной 0,5т. п. н. вы можете предложить? Какую из них вы предпочтете?
3. Что такое линкер? Где его используют?
4. Что такое дидезоксинуклеотиды? Как с их помощью определяют нуклеотидную последовательность ДНК?
5. Почему можно определить нуклеотидную последовательность только одноцепочемной ДНК?
6. Как определяют нуклеотидную последовательность клонированной ДНК с помощью векторной системы на основе фага М13?
7. На месте преступления обнаружен один-единственный волос предполагаемого преступника. В нем содержится [0—20 пикограмм (10–12 г) ДНК. Чтобы охарактеризовать столь малое количество ДНК и определить, идентична ли ее нуклеотидная последовательность таковой у ДНК подозреваемого, нужно 10—100 нанограмм (109 г) ДНК. Как получить ее? Какую информацию вам нужно собрать, прежде чем предпринимать какие-то действия?
8. Что такое «длинная матрица», «короткая матрица», как меняется соотношение между ними с увеличением числа ПЦР-раундов?
9. Как синтезируют гены с помощью ПЦР?
10. Как «превратить» концы молекулы мРНК в кДНК?
