Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
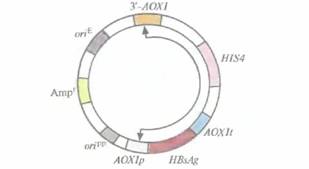
Другие дрожжевые системы экспрессииС помощью систем экспрессии S. cerevisiae удалось получить много разных рекомбинантных белков, К сожалению, в большинстве случаев уровень их экспрессии был довольно низким, Кроме того, обнаружились и другие проблемы. • При увеличении масштабов системы часто происходит потеря плазмид, даже если используются индуцируемые промоторы. • Гетерологичный белок зачастую оказывается гипергликозилированным и содержит более 100 остатков маннозы в каждой боковой олигосахаридной цепи, в то время как в нативных белках их содержится только от 8 до 13 на цепь. Наличие лишних маннозных остатков может изменять биологическую активность продукта или его иммуногенность. • Во многих экспериментах белки, которые должны были секретироваться, на самом деле концентрировались в периплазматическом пространстве, что еще более осложняло их очистку. Все это заставило ученых исследовать возможность получения гетерологичных белков с помощью других видов дрожжей и с использованием эукариотических систем, В частности, изучались соответствующие векторы — системы экспрессии, содержащие видоспецифичные регуляторные последовательности транскрипции и трансляции, возможность трансформации этих видов и получения высокого выхода белков и возможность крупномасштабного культивирования организма-хозяина, В качестве альтернативы S. cerevisiae можно использовать Kluyveromyceslactis, дрожжи, которые применяют для промышленного производства лактозы Получение рекомбиантных белков с помощью эукариотических систем 141 (ß-галактозидазы); Schizosaccharomycespombe, дрожжи, размножающиеся делением, а не почкованием; Yarrowialipotytica, которые используют алканы в качестве субстрата; Pichia postons и Hansenula polymorphe, которые могут использовать метанол как единственный источник углерода и энергии. Синтез поверхностного антигена вируса гепатита ВМетилотрофные дрожжи P. pastoris можно без труда и больших затрат выращивать в промышленных биореакторах. Их использование в качестве организма-хозяина позволило бы увеличить выход активных продуктов — гетерологичных белков. Такой вывод можно сделать, рассмотрев в качестве примера получение поверхностного антигена вируса гепатита В (HBsAg) с помощью специально разработанной системы с использованием интегрирующего вектора. Сначала ген HBsAgвстроили между промотором гена алкогольоксидазы 1 (АОХ1р) и сигналом терминации-полиаденилирования (AOX1t) того же гена (рис. 7.5). Регуляция активности гена АОХ1 Р. posions осуществляется с помощью метанола. В
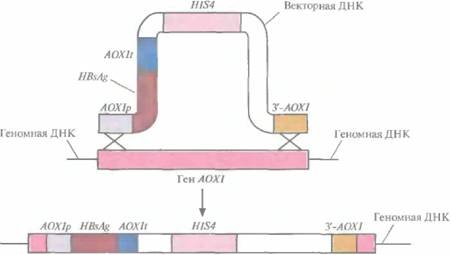
его присутствии на долю алкогольоксидазы может приходиться до 30% всех белков клетки, а в отсутствие метанола алкогольоксидаза не синтезируется вообще. Вектор (рис. 7.5), специально сконструированный для этих исследований, содержал следующие элементы: 1) блок AOX1p-HBsAg-AOX1t; 2) сайт инициации репликации, функционирующий в P. pastoris; 3) фрагмент ДНК, содержащий сайт инициации репликации плазмиды pBR322 и селективный маркер E. coli; 4) фрагмент 3'-АОХ1, способствующий интеграции клонированной ДНК в определенный сайт хромосомы; 5) активный ген гистидинолдегидрогеназы (HIS4), кодирующий фермент, который участвует в синтезе аминокислоты гистидина. Наличие в этой конструкции последовательностей pBR322 позволяет использовать для работы с ней E. coli, что облегчает клонирование и при необходимости позволяет получать большие количества векторной ДНК. Чтобы предотвратить утрату плазмиды. была предусмотрена интеграция участка AOX1p-HBsAg-AOX1tв геном P. pastoris. Для этого штамм P. pastorisHIS4 с дефектным геном гистидинолдегидрогеназы трансформировали фрагментом вектора, содержащим элементы AOX1p-HBsAg-AOX1t, HIS4 и 3'-АОХ1 (рис. 7.5). В результате двойного кроссинговера между AOX1pи 3'-АОХ1 введенной ДНК, с одной стороны, и комплементарными последовательностями хромосомной ДНК, с другой, произошла интеграция последовательностей AOX1p-HBsAg-AOX1tи Н1S4 вгеном, сопровождающаяся утратой хромосомного гена АОХ1 (рис. 7.6). Клетки, в геном которых включился ген HIS4, растут на среде без гистидина; этот признак может использоваться для их отбора. Вторым критерием отбора служит замедление роста клеток в присутствии метанола, поскольку после потери гена АОХ1 после двойного кроссинговера активным остается только один, менее эффективный ген АОХ2. Клон с интегрировавшим фрагментом AOX1p-HBsAg-AOX1tпри росте в присутствии метанола, который активирует АOX1-промотор, синтезировал в больших количествах аутентичный белок HBsAg, накапливающийся в цитоплазме. Белковый продукт образовывал такой 142 ГЛАВА 7
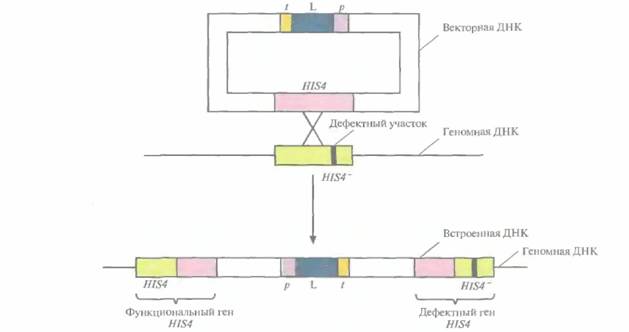
же мультисубъединичный комплекс, как и соответствующий белок в клетках человека, инфицированных вирусом гепатита В, и связывался с антителами к этому вирусу. При выращивании данного клона в 240-литровом ферментере периодического действия количества синтезируемого белка хватило бы примерно на 107 вакцинаций. При этом генетическая конструкция оставалась неизменной в течение 200 часов культивирования в присутствии метанола, Синтез бычьего лизоцима С2Способность P. pastorisсекретировать гетерологичный белок исследовали в системе с использованием кДНК бычьего лизоцима С2, кодирующей полноразмерный белок и его собственный лидерный пептид. Бычий лизоцим — это желудочный фермент, разрушающий клеточные стенки бактерий; он устойчив к протеазам и сохраняет активность в узком диапазоне pH, что позволяет использовать его в качестве добавки к кормам жвачных животных для улучшения пищеварения. Вектор, созданный для этого исследования, был идентичен вектору AOX1p-HBsAg-AOX1t,описанному выше, за исключением того, что вместо кодирующей последовательности HBsAgв него была встроена кДНК лизоцима. Вся плазмида была интегрирована в дефектную копию гена HIS4 в хромосоме P. pastoris. В результате интеграции ген бычьего лизоцима оказывался фланкирован одним активным (HIS4) и одним дефектным (HIS4–) генами гистидинол-дегидрогеназы (рис. 7.7). Предшественник бычьего лизоцима процессировался в P. pastorisи секретировался в среду, при этом удельная активность секретируемого белка была такой же, как у нативного фермента. При ферментации 10 л культуры в течение 200 ч в непрерывном режиме при высокой плотности клеток синтезировалось примерно 20 г лизоцима. Аутентичные гетерологичные белки были получены и с помощью других дрожжевых систем. Например, кДНК α- и ß-цепей гемоглобина А человека были встроены между промотором (МОХр) и сигналом терминации транскрипции (MOXt) гена метанолоксидазы Hansenula polymorpha и помещены друг за другом в экспрессирующий вектор. Через 40 генераций был взят изолят со случайно интегриро- Получение рекомбинантных белков с помощью эукариотических систем 143
вавшим участком исходного вектора и показано, что в нем присутствует функциональный гемоглобин А с правильной тетрамерной структурой: две α - и две ß-цепи (α2β2). Кроме того, с использованием экспрессирующего вектора для S. pombe, несущего селективный маркерный ген и клонированный ген человека, оба под контролем промоторов млекопитающих, были получены большие количества рекомбинантных белков, кодируемых разными генами человека. Дрожжевые системы экспрессии стали играть важную роль в получении гетерологичных белков для научных, промышленных и медицинских целей. Однако, как показали исследования, ни одна из них не может гарантировать получение аутентичного белка любого гена. По этой и ряду других причин были разработаны системы экспрессии генов с использованием клеток насекомых и млекопитающих. |