Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
|
 |
| Рис. 7.2. Рекомбинантные белки, синтезируемые в системах экспрессии S. cerevisiae. HIV-I — вирус иммунодефицита человека 1 типа. |
Векторы для S. cerevisiae
Существует три типа экспрессирующих векторов для S. cerevisiae. 1) эписомные, или плазмидные векторы; 2) интегрирующие векторы; 3) искусственные дрожжевые хромосомы (YAC). Плазмидные векторы уже широко использовались для получения как секретируемых, так и несекретируемых гетерологичных белков. Однако системы экспрессии, основанные на использовании плазмид, зачастую оказываются нестабильными при выращивании клеток в больших объемах (> 10 л). Стратегия с использованием векторов второго типа пока не получила широкого распространения, несмотря на то что в результате интеграции экспрессирующего вектора или транскриптона в хромосомную ДНК получается стабильный рекомбинантный организм. Причиной этого служит то, что число копий клонированного гена ограничивается одной на хромосому, иными словами, конечный выход белка невысок. Можно было бы использовать тандемные последовательности генов, но они часто оказываются нестабильными. Поэтому исследователи остановились на плазмидных векторах с одним клонированным геном, но попытались изменить условия роста, с тем чтобы повысить стабильность плазмид.
Искусственные дрожжевые хромосомы (YAC) предназначены для клонирования больших фрагментов ДНК (100 т. п. н.), которые затем поддерживаются в дрожжевой клетке как отдельные хромосомы. YAC-система чрезвычайно стабильна. С ее помощью проводили физическое картирование геномной ДНК человека и анализ больших транс-криптонов, создавали геномные библиотеки, содержащие ДНК индивидуальных хромосом человека. YАС-вектор напоминает хромосому, поскольку он содержит последовательность, функционирующую как сайт инициации репликации ДНК (автономно реплицирующуюся последовательность), сегмент центромерной области дрожжевой хромосомы и последовательности, образующиеся на обоих концах при линеаризации ДНК и действующие как теломеры, обеспечивающие стабильность хромосомы (рис. 7.3). При встраивании чужеродной ДНК в YAC может происходить нарушение рамки считывания маркерного дрожжевого гена. В результате продукт этого гена не образуется, и при выращивании клеток на специальной среде можно наблюдать цветную реакцию. Кроме того, некоторые YAC-векторы несут селективный маркер, независимый от сайта клонирования. Несмотря на все преимущества, YAC пока не использовались для промышленного синтеза гетерологичных белков.
Прямая экспрессия в S. cerevisiae
Термин «прямая экспрессия» применяется для описания векторных систем, при использовании которых синтезированные белки аккумули-
138 ГЛАВА 7
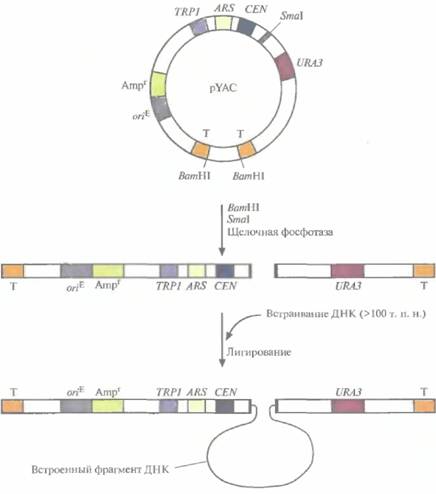 | Рнс. 7.3. YAC-система клонирования. YAC-плазмида (pYAC) содержит селективный маркерный ген E. coli (Ampr), сайт инициации репликации, функционирующий в E. coli (oriE); сегмент дрожжевой ДНК, включающий участки URA3, CEN, TRP1 и ARS (CEN - последовательность, выполняюшая центромерную функцию, ARS дрожжевая автономно реплицирующаяся последовательность, эквивалентная дрожжевому сайту инициации репликации, VRA3 — один из генов биосинтеза урацила, TRP1 - один из генов биосинтеза триптофана). Т — это теломерные области дрожжевой хромосомы, Sinai — сайт, по которому осуществляется клонирование. pYAC сначала обрабатывают SmaI, ВатHIи щелочной фосфатазой, а затем сшивают с фрагментом ДНК длиной 100т. п. н. Конечная генетическая конструкция содержит клонированную ДНК и может стабильно поддерживаться в дрожжевых клетках Ura-Trp- |
руются в цитоплазме хозяйской клетки. Несколькими группами исследователей были разработаны различные экспрессирующие дрожжевые векторы, но все они имеют сходные основные черты. Мы рассмотрим процесс экспрессии чужеродного гена в S. cerevisiae на примере синтеза фермента супероксиддисмутазы человека.
Супероксид-анион — это побочный продукт утилизации кислорода аэробными организмами. У человека он участвует в стимуляции иммунного ответа фагоцитов и направлении лейкоцитов к месту инфекции. Однако избыток данного соединения и его производных может вызывать повреждение клеток. В минимизации потенциального цитотоксического воздействия таких веществ и принимает участие цитоплазматический фермент Cu/Zn-супероксиддисмутаза (Cu/Zn-SOD); он катализирует связывание супероксид-аниона и иона водорода с образованием пероксида водорода, который в свою очередь служит субстратом для каталазы или пероксидазы. Супероксид-анион образуется также при повторной перфузии органа, кровоснабжение которого было прекращено перед хирургическим вмешательством. Чтобы избежать повреждения клеток супероксид-анионом, исследователи предложили перед повторной перфузией вводить в орган Cu/Zn-SOD. Cu/7n-SOD может использоваться также для лечения таких воспалительных заболеваний, как остеоартрит, ревматоидный артрит, склеродермия и болезнь Бехтерева. При этом в
Получение рекомбинантных белков с помощью эукариотических систем 139
обоих случаях лучше использовать белок, аутентичный Cu/Zn-SOD человека, для того чтобы избежать любых нежелательных иммунных реакций, которые могут возникнуть при введении фермента от других видов.
Первоначально кДНК Cu/Zn-SOD человека была клонирована в системе экспрессии Е. coll. Но в этом случае от молекулы Cu/Zn-SOD только отщеплялся инициаторный N-концевой метионин — так, как это происходит со всеми белками, синтезируемыми в Е. coït, a следующая аминокислота (аланин) не ацетилировалась, как в клетках человека. Поэтому для получения аутентичного фермента кДНК Cu/Zn-SOD человека была встроена в дрожжевой эписомный вектор. Дрожжевые клетки не способны эффективно вырезать интроны, поэтому для кодирования специфичных генных продуктов необходимо использовать соответствующие кДНК или химически синтезированные последовательности. Дрожжевой вектор с кДНК Cu/Zn-SOD человека (рис. 7.4) содержал: 1) дрожжевой ген биосинтеза лейцина (LEU2); 2) сегмент 2мкм-плазмиды с сигналом инициации репликации ДНК дрожжей, что обеспечивало репликацию плазмиды в дрожжевых клетках; 3) селективный маркер — Е. соli-ген устойчивости к ампициллину (Ampr) и сайт инициации репликации, активный в Е. œli, что позволяет осуществлять стандартные генноинженерные манипуляции, необходимые для создания плазмиды, в клетках Е. coli; 4) кДНК Cu/Zn-SOD человека, встроенную между промотором дрожжевого гена глицеральдегидфосфатдегидрогеназы (GAPDp) и последовательностью, содержащей сигналы терминации транскрипции и полиаденилирования мРНК того же гена (GAPDt).
Этим вектором трансформировали штамм дрожжей, не способный к синтезу лейцина (LEU2), и высевали их на среду без лейцина. В этих условиях могут расти только клетки с функционирующим LEU2-геном, находящимся в векторе. GAPD-промоторне регулируется, транскрипция с него происходит непрерывно. Поэтому кДНК Cu/Zn-SOD человека транскрибируется в течение всего периода роста (конститутивно). В этом эксперименте в дрожжевых клетках накапливались большие количества Cu/Zn-SOD, в котором, подобно нативному
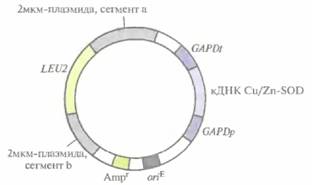 |
| Рис. 7.4. Экспрессирующий вектор S. cerevisiae. Между промотором {GAPDp} и сигналом терминации-полиаденилирования (GAPDt) гена глицеральдегидфосфатдегидрогеназы S. cerevisiaeвстроена кДНК Cu/Zn-SOD человека. Ген LEU2, встроенный в середину дрожжевой 2мкм-плазмиды, кодирует один из ферментов биосинтеза лейцина. Ген устойчивости к ампициллину (Ampr) и сайт инициации репликации Е. coli (oriE) переклонированы из плазмиды pBR322. |
белку из клеток человека, аминогруппа n-концевого остатка аланина была ацетилирована.
Секреция гетерологичных белков, синтезируемых S. cerevisiae
В дрожжевых клетках гликозилируются только секретируемые белки, поэтому для получения рекомбинантных белков, которые для перехода в активную форму должны подвергнуться N-или О-гликозилированию, необходимо использовать системы секреции. Для этого перед кДНК, которая кодирует интересующий исследователи белок, нужно поместить так называемый пре-про-α-фактор - лидерную (сигнальную) последовательность гена а1фактора спаривания дрожжей. Синтезируемый рекомбинантный белок сможет в этом случае эффективно секретироваться дрожжами.
Во время транспорта белка в нем образуются дисульфидные связи, происходят протеолитическое расщепление и другие посттрансляционные модификации, так что в некоторых случаях в среду попадает уже активный белок. Лидерный пептид обеспечивает проникновение белка через цитоплазматическую мембрану и секрецию, при этом сам он отщепляется дрожжевой эндопротеиназой, узнающей дипептид Lys-Arg. Поэ-
140 ГЛАВА 7
тому кодоны Lys и Arg должны располагаться непосредственно перед кДНК, так чтобы после отщепления сигнального пептида синтезированный белок содержал на N-конце нужный аминокислотный остаток.
Используя эписомный экспрессирующии вектор с сигнальной последовательностью α-фактора, удалось получить правильным образом модифицированный, биологически активный белок гирудин: он синтезировался и секретировался штаммом S. cerevisiae. Ген гирудина был выделен из клеток беспозвоночного — пиявки Hirudo medicinalis. Этот белок является мощным антикоагулянтом и не вызывает нежелательных иммунологических реакций у человека. Его можно получать в активной форме в больших количествах, что упростило исследование его способности разрушать сгустки венозной крови и устранять другие проявления тромбоза. К сожалению, клинические исследования 12 142 больных, у 4131 из которых имелись сердечнососудистые заболевания, выявили лишь незначительные преимущества рекомбинантного гирудина перед гепарином. Эти преимущества не могут компенсировать высокую стоимость рекомбинантного гирудина, так что его широкое использование в клинике представляется маловероятным.
Чтобы повысить эффективность секреции рекомбинантных белков штаммами S. cerevisiae, были предприняты дальнейшие исследования, Так, попытались выяснить, способствует ли повышению выхода рекомбинантного белка суперэкспрессия такого природного фермента системы секреции, как дисульфидизомераза, которая обеспечивает правильную укладку белковой молекулы в процессе секреции. Для этого в хромосому 5. cerevisiae встроили ген дрожжевой дисульфидизомеразы, находящийся под контролем конститутивного промотора глицеральдегидфосфатдегидрогеназы и сигнала терминации транскрипции. Уровень синтеза дисульфидизомеразы модифицированным штаммом был в 16 раз выше по сравнению со штаммом дикого типа. Далее в штамм — суперпродуцент дисульфидизомеразы ввели внехромосомный экспрессирующий вектор, несущий ген фактора роста тромбоцитов В человека. Количество секретируемого этим штаммом тромбоцитарного фактора роста В человека превысило в 10 раз количество фактора, секретируемого штаммом с нормальным уровнем синтеза дисульфидизомеразы. Суперпродукция дисульфидизомеразы повышает секрецию белков только с дисульфидными связями. Изменение других белков дрожжевой системы секреции может повысить количество секретируемых рекомбинантных белков с другими требованиями к укладке белковой молекулы.
