Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
|
Направленный мутагенез и генная инженерия белков 165
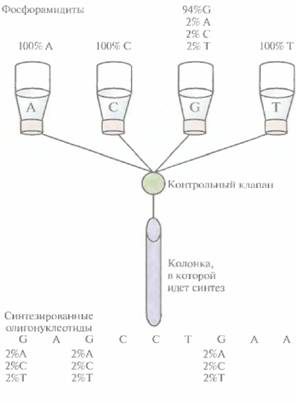
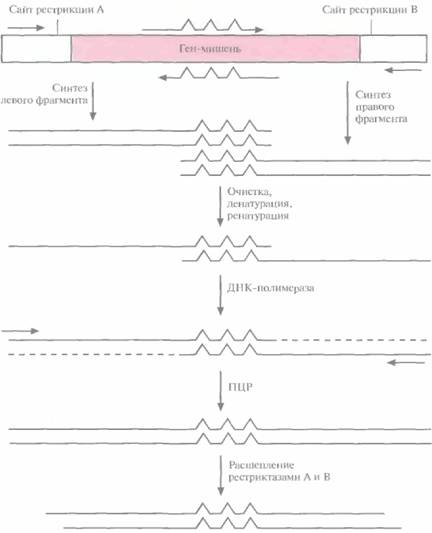
Частично вырожденные олигонуклеотиды могут быть встроены в ген-мишень разными способами. Один из подходов состоит в следующем. Ген встраивают в плазмиду между двумя уникальными сайтами рестрикции и проводят амплификацию его
левого и правого перекрывающихся между собой фрагментов при помощи нескольких ПЦР (рис. 8.6). Пара праймеров, которая используется для амплификации левого фрагмента, включает неполностью комплементарный олигонуклеотид, спаривающийся с тяжелой цепью гена-мишени, и обычный, полностью комплементарный праймер, гибридизующийся с участком легкой цепи, фланкирующим левый уникальный сайт рестрикции. Один из праймеров, использующихся для амплификации правого фрагмента, содержит некомплементарные нуклеотиды и спаривается с тяжелой цепью гена-мишени, а второй праймер полностью комплементарен участку легкой цепи, фланкирующему второй (правый) уникальный сайт рестрикции. Продукты ПЦР-амплификации очищают и объединяют, а затем подвергают денатурации и ренатурации. В результате образуется некоторое количество частично двухцепочечных молекул ДНК, спаренных в области гена-мишени. Их достраивают до полностью двухцепочечных с помощью ДНК-полимеразы, а затем проводят ПЦР-амплификацию с парой праймеров, комплементарных противо- 166 ГЛАВА 8
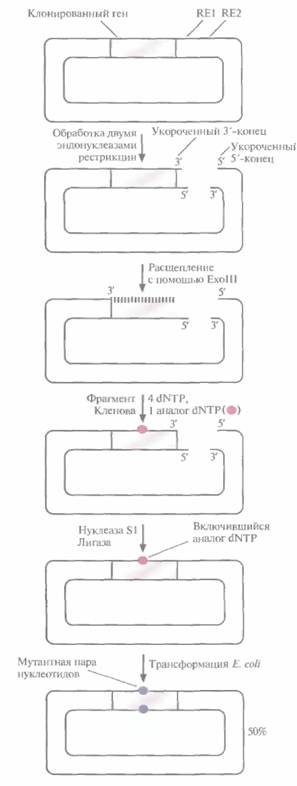
положным концам молекул. Амплифицированные молекулы обрабатывают двумя эндонуклеазами рестрикции, уникальные сайты которых находятся на концах фрагмента, и встраивают в соответствующий плазмидный вектор. Этот подход позволяет получить измененные гены со случайными мутациями. Случайный мутагенез с использованием аналогов нуклеотидовПомимо методов внесения мутаций в клонированный ген, основанных на использовании фага М13, были разработаны другие подходы, в которых использовались плазмидные ДНК, Один из них схематично представлен на рис. 8.7. Ген-мишень встраивают в плазмиду поблизости от двух тесно расположенных сайтов рестрикции. Эти сайты подбирают так, чтобы после расщепления двумя рестриктазами образовывались укороченные 3'- и 5'-концы, а именно, чтобы 3'-конец сайта расщепления, расположенного рядом с клонированным геном, был укорочен, а 3'-конец с другой стороны плазмиды выступал. Экзонуклеаза III (ExoIII) E. coliрасщепляет молекулу ДНК только с укороченных 3'-концов, Направленный мутагенез и генная инженерия белков 167 но не с выступающих 3'- или любых 5'-концов. Ее добавляют в реакционную смесь после инкубированния ДНК с двумя рестриктазами, и она отщепляет от укороченного 3'-конца цепи по одному нуклеотиду. Через определенное время реакцию останавливают и заполняют пробел с помощью фрагмента Кленова ДНК-полимеразы I, используя смесь обычных четырех дезоксирибонуклеотидов с добавлением аналога одного из них. В результате получают плазмиды, содержащие ген-мишень, в одном или нескольких сайтах которого находится аналог соответствующего нуклеотида. Ими трансформируют клетки Е. coli. Плазмиды реплицируются, и в клонированный ген включается нуклеотид, отличный от такового в исходном гене. Помимо описанного выше, для случайного мутагенеза используют и другие методы, например один из вариантов олигонуклеотид-направленного мутагенеза с применением ДНК фага M13. В этом случае затравкой для синтеза ДНК служит смесь олигонуклеотидов, содержащих случайные замены. В результате получают библиотеки клонов, несущих множество мутаций в различных сайтах. Недостаток подходов, при которых в клонированном гене образуется большое число случайных мутаций, состоит в необходимости тестирования каждого клона для идентификации того, который детерминировал бы синтез нужного белка. Это весьма непростая
168 ГЛАВА 8 задача, но зачастую только так можно выявить белки, обладающие новыми свойствами. Как только эта задача решена, определяют нуклеотидную последовательность соответствующего клонированного гена и идентифицируют измененный сайт (сайты). |