Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
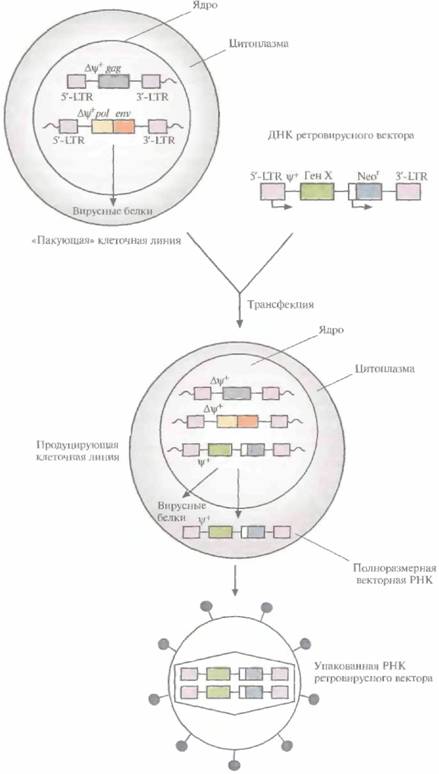
Генная терапия ex vivoГенная терапия ex vivo, как правило, включает следующие этапы (рис. 21.1). 1. Получение клеток от больного. 2. Исправление генетического дефекта с помощью переноса нужного гена в изолированные клетки. 3. Отбор и наращивание генетически «исправленных» клеток. 4. Инфузия или трансплантация этих клеток пациенту. Использование собственных клеток пациента (аутологичных клеток) гарантирует, что после инфузии или трансплантации у него не разовьется иммунный ответ. Необходимо, чтобы процедура переноса генов, используемая для генной терапии ex vivo, 488 ГЛАВА 2] была эффективной, а «терапевтический» ген стабильно поддерживался и непрерывно экспрессировался. Этим условиям отвечают векторы, полученные на основе мышиных ретровирусов. Но ретровирусы имеют существенный недостаток — они могут приводить к злокачественной транформации клеток. Такую вероятность необходимо уменьшить, а лучше полностью исключить. Геном ретровируса дикого типа представлен двумя идентичными одноцепочечными молекулами РНК, каждая из которых состоит из шести участков: длинного концевого повтора (5'-LTR, от англ, longterminalrepeat); некодирующей последовательности пси+ (ψ+), необходимой для упаковки РНК в вирусную частицу; трех генов, кодирующих структурный белок внутреннего капсида (gag), белок, обладающий функциями обратной транскриптазы и интегразы (pol), и белок оболочки (env); 3'-LTR-последовательности (рис. 21.2). Жизненный цикл ретровируса включает следующие стадии. 1. Инфицирование клетки-мишени. 2. Синтез ДНК-копии генома с помощью собственной обратной транскриптазы, 3. Транспорт вирусной ДНК в ядро. 4. Встраивание вирусной ДНК в один из хромосомных сайтов клетки-хозяина. 5. Транскрипцию мРНК с вирусной ДНК под контролем сильного промотора, локализованного в 5'-LTR. 6. Трансляцию белков Gag, Pol и Env в цитоплазме. 7. Образование вирусного капсида и упаковку в него двух РНК-цепей и молекул обратной транскриптазы. 8. Высвобождение вирионов из клетки. Для получения ретровирусного вектора полноразмерную ДНК ретровируса встраивают в плазмиду, с помощью эндонуклеазного расщепления удаляют большую часть гена gagи гены polи env, оставляя 5'-концевой участок гена gagи 5'- и 3’-LTR, а затем рядом с ψ+-областью встраивают «терапевтический» ген, транскрипция которого будет контролироваться 5'-LTR-промо-тором; при необходимости можно встроить и маркерный селективный ген с собственным промотором (рис. 21.3). Такая конструкция позволяет экспрессировать оба клонированных гена. На основе этой схемы созданы различные ретровирусные векторы. Максимальный размер ДНК-вставки, которую может переносить ретровирусный вектор, — примерно 8 т. п. н. ДНК ретровирусного вектора можно использовать для трансформации клеток саму по себе, но эффективность доставки ее в ядро и интеграции в геном клетки-хозяина крайне низка. Поэ-
Генная терапия 489 тому была разработана методика упаковки полноразмерной РНК ретровирусного вектора в интактные вирусные частицы, с высокой частотой проникающие в клетку, что гарантирует встраивание соответствующей ей ДНК в геном клетки -хозяина. Для этого с помощью генной инженерии была создана «пакующая» клеточная линия, в одном из участков генома которой содержится ∆ψ+-сегмент 5'-LTR-gag-3'-LTR (т. е. сегмент, лишенный функциональной ψ+-последовательности), а в другом — ∆ψ+-сегмент 5'-LTR-pol-env-3'-LTR. Оба этих сегмента транскрибируются, но из-за отсутствия ψ+-последовательности и образования вирусных молекул РНК меньшего, чем в норме, размера формируются пустые вирусные частицы. При трансфекиии ДНК ретровирусного вектора в такие клетки она встраивается в хромосомную ДНК и транскрибируется с образованием полноразмерной РНК ретровируса, содержащей ψ+-последовательность. В таких условиях в вирусные капсиды упаковывается только РНК вектора. Образующиеся интактные вирусные частицы можно использовать для высокоэффективной доставки ретровирусного вектора в клетки-мишени (рис. 21.4). В «пакующей» клеточной линии не образуются компетентные по репликации ретровирусы дикого типа, способные встраиваться в гены и приводить к некотролируемой пролиферации некоторых клеток (т. е. к превращению их в раковые клетки). Это весьма существенно, особенно если частицы ретровирусного вектора предполагается использовать для генной терапии соматических клеток человека. В качестве меры предосторожности все же проводят регулярное тестирование готовых ретровирусных векторов, с тем чтобы выявить ретровирусы дикого типа. Кроме того, в «пакующей" клеточной линии нуклеотидные последовательности ретровируса и вектора локализованы в трех разных областях хромосомы, что делает весьма маловероятной возможность последовательных рекомбинационных событий, которые могли бы привести к образованию компетентного по репликации ретровируса. Ретровирусы активно инфицируют реплицирующиеся клетки. Для переноса генов в интенсивно растущие клетки-мишени последние обрабатывают очищенными частицами упакованного ретровирусного вектора либо проводят их совместное культивирование с производящей его клеточной линией, а затем осуществляют дифференциальную селекцию для разделения клеток-мишеней и «пакующих» клеток. Трансдуцированные клетки-мишени (те, в которые при помощи вируса была перенесена невирусная ДНК) тестируют, чтобы удостовериться, что: I ) в них синтезируется продукт терапевтического гена; 2) не образуются компетентные по репликации ретровирусы; 3) ДНК ретровирусного вектора не встроилась в сайт, изменяющий способность клеток к росту либо препятствующий их нормальному функционированию. После тестирования трансдуцированные клетки наращивают в больших количествах и с разными интервалами вводят пациенту. Наиболее вероятными кандидатами для проведения генной терапии ex vivo (рис. 21.5) являются пациенты с наследственными заболеваниями, для лечения которых применяют трансплантацию костного мозга. Терапевтический эффект трансплантации костного мозга в отношении целого ряда болезней связан с наличием в нем тотипотентных эмбриональных стволовых клеток, которые встречаются с частотой 104—105, могут пролиферировать и дифференцироваться в различные типы клеток, такие как В- и Т-лимфоциты (B-клетки и Т-клетки), макрофаги, эритроциты, тромбоциты и остеокласты. Например, в том случае, когда генная мутация нарушает функции макрофагов, трансплантация костного мозга обеспечивает реципиенту постоянный запас компетентных макрофагов, происходящих из популяции тотипотентных стволовых клеток. Генноинженерная модификация тотипотентных стволовых клеток с их последующей инфузией или трансплантацией пациенту для замещения утраченного типа клеток или генного продукта может стать основным способом генной терапии ex vivo. В качестве примера можно рассмотреть дефект АДА, приводящий к повышению в крови уровня аденозина и дезоксиаденозина, токсическое действие которых приводит к гибели В- и Т-лимфоцитов и развитию тяжелого иммунодефицита. Поскольку и В-, и Т-лимфоциты происходят из тотипотентных стволовых клеток, перенос в последние функционального гена АДА с последующим введением 490 ГЛАВА 21
Генная терапия 491
| |||||||||||||||||||||||||||||||||