Глик Молекулярная биотехнология. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. Пер с англ. М. Мир, 2002. 589 с
 Скачать 9.74 Mb. Скачать 9.74 Mb.
|
ГЛАВА 2l. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 21.1. Применяемые в настоящее время методы лечения некоторых моногенных заболеваний человека | ||||
| Генный продукт | Заболевание и его симптомы | Частота встречаемости | Лечение | Прогноз |
| Аденозиндезаминаза | Тяжелый комбинированный иммунодефицит (SCID) Утрата Т- и В-лимфоцитов | 1:1 000000 | Трансплантация костного мозга; введение аденозиндезaминазы | Без лечения: летальный исход к двум годам С лечением: улучшение состояния пациента |
| Рецептор липопротеинов низкой плотности | Семейная гиперхолестеролемия Повышенный уровень холестерола в крови, ишемическая болезнь сердца | 1:500 (гетерозиготы) | Диета, медикаментозное лечение трансплантация печени | Улучшение состояния пациента |
| Глюкоцереброзидаза | Болезнь Гоше Накопление гл юкоиереброзидов в макрофагах, приводящее к поражению печени, селезенки и костей | 1:2 500 (среди евреев); редко у неевреев | Симптоматическое лечение: удаление селезенки, введение антибиотиков, лечение поражений костей, трансплантация костного мозга, введение глюкоцереброзидазы | Улучшение состояния пациента |
| Фактор VIII системы свертывания крови | Гемофилия Λ Изменение фактора VIII, приводившее к нарушению свертываемости крови, хронические кровоизлияния в суставы; обширные кровотечения при травмах | 1:10000 (у мужчин) | Повышение концентрации фактора VIII с помошью переливания плазмы | Увеличение продолжительности жизни при постоянном лечении; при переливании есть риск вирусной инфекции |
| Фенилаланин-гидроксилаза | Фенилкетонурия Избыток фенилаланина в крови новорожденных, умственная отсталость | 1: 10000 | Диета, исключающая фенилаланин | При ранней диагностике и непрерывном лечении — обычно благоприятный |
| α1 - Антитрипсин | Эмфизема Дефицит ингибитора сывороточных протеаз, поражение легких, цирроз печени | 1:3500 | Заместительная терапия; снижение экологических факторов риска | Заболевание прогрессирует медленнее |
ванного иммунодефицита (SCID, от англ, severe combined immunodeficiency) и болезни Гоше. Иногда для компенсации каких-то утраченных функций проводят трансплантацию костного мозга или других органов. К сожалению, нередко интенсивное лечение многих наследственных болезней начинают проводить только тогда, когда пациент находится в критическом состоянии и удается лишь ненамного продлить его жизнь. Поскольку генетические заболевания часто носят системный характер и постепенно приводят к ослаблению организма, разработка эффективных методов лечения представляет собой непростую задачу. Существующая терапия, как правило, малоэффективна, лишь немногие пациенты доживают до старости и могут иметь детей. В большинстве случаев лечение необходимо проводить многократно, оно очень дорогое и длительное. Поэтому разработка новых видов терапии очень актуальна.
После того как были установлены молекулярные основы трансформации бактерий (переноса генов из одного штамма в другой), у ученых появилась надежда, что аналогичный механизм — введение нормальных генов в дефектные соматические клетки — можно будет использовать для лечения наследственных заболеваний человека. Перспективы генной коррекции соматических клеток стали более реальными в 1980-х гг.; к этому времени были
Генная терапия 485
| Таблица 21.1. (Продолжение) | ||||
| Генный продукт | Заболевание и его симптомы | Частота встречаемости | Лечение | Прогноз |
| Трансмембранный белок, нарушения в котором приводят к муковисцидозу | Myковисцидоз Системное поражение органов, в ряде случаев недостаточность поджелудочной железы, закупорка кишечника, закупорка бронхов | 1:2500 (европеоиды) | Введение антибиотиков, физикальная очистка легких, общеукрепляющая диета | Летальный исход в возрасте до 20 лет |
| Орнитин- транскарбамилаза | Гипераммониемия Нарушение цикла мочевины, накопление аммония, дефицит аргинина Ранняя форма, развивающаяся в первые 72 ч после рождения: летаргия, рвота, кома, смерть; в случае выживания — необратимое повреждение мозга Поздняя форма; рвота, летаргия, эпилептические припадки | 1:40 000 | Диета с ограничением белка, диета, обогащенная аргинином, лекарственные Средства, трансплантация печени | Поздняя форма; благоприятный Ранняя (тяжелая) форма: снижение тяжести симптомов |
| Дистрофин | Мышечная дистрофия Дюшенна Πрогрессирующая слабость мышц | 1:7 500 (у мужчин) | Только поддерживающее лечение; полноценное питание, помощь в функционировании дыхательной системы, передвижение в инвалидной коляске | Летальный исход к 20 годам |
| β-Глобин | Серповидноклеточная анемия Хроническая анемия, системное поражение органов, селезенки, сердца, почек, печени, мозга; у гетерозиготных носителей наблюдается мягкая форма болезни | 1:500 (для гетерозигот в популяциях афроамериканцев ; в других популяциях — реже) | Переливание крови, медикаментозная терапия, анальгетики, трансплантация костного мозга | Снижение тяжести симптомов; эффективное лечение отсутствует |
разработаны методы получения изолированных генов, созданы эукариотические экспрессирующие векторы, стали рутинными эксперименты по переносу генов на мышах. В 1990 г. была предпринята первая попытка применения генотерапии для лечения SC1D (табл. 21.1) у двух девочек. Использовался следующий подход. Клонированную кДНК аденозиндезаминазы (АДА) ввели в лимфоциты, полученные от каждой из пациенток. Модифицированные клетки, синтезирующие АДА, культивировали и в течение двух лет с определенной периодичностью вводили девочкам. Через четыре года после начала лечения у обеих пациенток наблюдалась экспрессия гена АДА и отмечалось облегчение симптомов SCID. Однако истинная причина улучшения осталась не совсем ясной: был ли это эффект заместительной терапии (внутривенного введения защищенной формы АДА - полиэтиленгликоль-АДА) или собственно генной терапии. Беспорно одно: этот опыт показал безопасность генной терапии. Сходные результаты были получены и для других пациентов с SCID, одновременно получавших оба вида лечения. Исследования были продолжены на большем числе больных.
В соответствии с законодательством США, прежде чем новый лекарственный препарат будет разрешен к применению, он должен пройти четыре строго оговоренных стадии проверки.
486 ГЛАВА 21
1. Доклинические испытания, которые включают многочисленные эксперименты, проводимые in vitro и на лабораторных животных.
2. I фаза клинических испытаний проводится на небольшом числе (от 6 до 10) пациентов и часто имеет целью проверку безопасности препарата.
3. II фаза клинических испытаний проводится на большем числе пациентов и имеет целью проверку эффективности действия препарата.
4. III фаза клинических испытаний проводится с привлечением большого числа испытуемых и включает исчерпывающий анализ надежности и эффективности препарата, при этом используется информация, полученная на предыдущих этапах.
Прежде чем начать проверку препарата, необходимо, чтобы протокол его испытаний был одобрен и утвержден в соответствующих контролирующих инстанциях. С 1990 по 1992 г. было одобрено более десяти протоколов испытаний по генной терапии, находящихся в I фазе, а к 1997 г. — более 200 протоколов испытаний по генной терапии разных видов злокачественных новообразований, гемофилии, СПИДа, муковисцидоза, гиперхолестеролемии, бокового амиотрофического склероза и др. (табл. 21.2). Прежде чем приступать к I фазе клинических испытаний, необходимо учесть ряд важных моментов: предполагаемое исследование должно быть направлено на разработку методов лечения однозначно диагностируемой болезни, соответствовать существующим правилам проведения медико-биологических экспериментов и осуществляться с минимальным для пациента риском. Поскольку генная терапия представляет собой новое направление, а заболевания, которые предполагают лечить с ее помощью, столь различны, рассматривают множество разных подходов. В настоящее время все исследования по генной терапии направлены на коррекцию генетических дефектов соматических, а не половых (зародышевых) клеток. Это объясняется этическими и чисто техническими причинами, а так-
| Таблица 21.2. Некоторые заболевания, генная терапия которых проходит испытания с 1990 г. | ||
| Заболевание | Генотерапевтический препарат | Клетки-мишени |
| Тяжелый комбинированный иммунодефицит | Аденозиндезаминаза | Лимфоциты, клетки костного мозга |
| Меланома | Фактор некроза опухоли | Инфильтрирующие опухоль лимфоциты, аутологичные клетки опухоли |
| Меланома, глиобластома, рак почки | Интерлейкин-2 | Аутологичные клетки опухоли, клетки опухоли |
| Гемофилия В | Фактор IX | Аутологичные фибробласты кожи |
| Гигтерхолестеролемия | Рецептор липопротеинов низкой плотности | Аутологичные гепатоциты |
| Меланома, рак толстой и прямой кишки, рак почки | Антиген гистосовместимости HLA-B7 u β2- микроглобулин | Клетки опухоли |
| Глиобластома, СПИД, рак яичников | Тимидинкиназа вируса простого герпеса | Клетки опухоли, Т-лимфоциты |
| Муковисцидоз | Трансмембранный белок, нарушения в котором приводят к муковисцидоэу | Эпителий носовой полости и дыхательных путей |
| Рак молочной железы | Фактор типа 1 множественной устойчивости к лекарственным препаратам | CD34+- клетки крови |
| Меланома | Гранулоцитарный колониестимупируюший фактор | Клетки опухоли |
| Артрит | Антагонист рецептора интерлейкина-1 | Аутологичные фибробласты |
| Боковой амиотрофический склероз | Цилиарный нейротрофический фактор (CNTF) человека | Инкапсулированные трансдуцированные экзогенные клетки |
| Плоскоклеточный рак головы и шеи | p53 | Клетки опухоли |
| Анемия Фанкони | Фактор анемии Фанкони группы С | Клетки головного мозга |
Генная терапия 487
же соображениями безопасности: ведь ДНК, введенная в половые клетки человека, передавалась бы последующим поколениям.
В самом общем смысле под генной терапией соматических клеток человека понимают коррекцию специфического наследственного заболевания путем введения в клетку-мишень функционального экспрессирующегося гена. Однако за этим простым определением скрывается целый ряд проблем. Например, как получить доступ к клеткам, предназначенным для коррекции? Как осуществить доставку терапевтического гена? Какая доля клеток-мишеней должна получить такой ген, чтобы болезнь отступила? Необходим ли точный контроль транскрипции введенного гена для обеспечения ее эффективности? Не вызовет ли избыточная экспрессия введенного гена побочных эффектов? Будут ли модифицированные клетки поддерживаться бесконечно или потребуются повторные введения?
Хотя генная терапия соматических клеток делает только свои первые шаги, на ряд вопросов, касающихся некоторых наследственных заболеваний, уже получены ответы. Появляются все новые подходы к генной терапии соматических клеток, которые можно разделить на две большие категории: генная терапия in vivo и ex
| Рис. 21.1. Схематическое представление генной терапии ex vivo. Процедура включает: 1) получение от пациента клеток с генным дефектом; 2) культивирование изолированных клеток; 3) трансфекцию «терапевтической» генной конструкции в изолированные клетки; 4) отбор, выращивание и тестирование трансфицированных клеток; 5) трансплантацию или трансфузию трансфицированных клеток пациенту. | 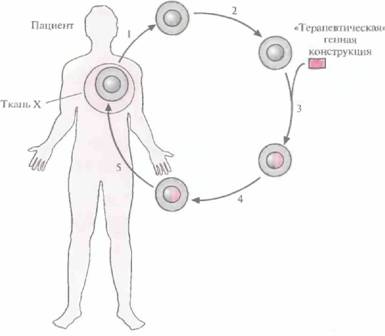 |
vivo. Разрабатывают и специфические лекарственные препараты на основе нуклеиновых кислот: антисмысловые олигонуклеотиды; РНК-ферменты, модифицированные с помощью генной инженерии; олигонуклеотиды, корректирующие генные мутации in vivo.
