тесты фармхимия. ФАРМХИМИЯ_1. Государственная фармакопея рф
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
Препараты простых эфиров1. образование оксониевых солей с концентрированными минеральными кислотами: R-O-R + HCl [R-O+-R]Cl- 2. расщепляются в жестких условиях: R-O-R + HI = R-I + ROH или R-O-R 3. окисляются с образованием перекисных соединений: R-O-R Титрование в неводных средах как метод количественного определения:Достоинства титрования в неводных средах: Можно определять органические и неорганические вещества, смеси различных компонентов, которые при титровании в водной среде не дают четкой КТТ (очень слабые кислоты и основания). Можно титровать соединения, которые нерастворимы в воде, разлагаются водой, образуют эмульсии. Можно использовать для бесцветных растворов. КТТ можно определят индикатором, потенциометрически, кондуктометрически. Можно титровать смеси без разделения. Повышается точность титрования. Меньше поверхностное натяжение, меньше размер капли, меньше погрешность. Недостатки: Необходимо тщательно обезвоживать все растворы, титранты. Титрование органических оснований и их солей в неводных средах: Титрант: HClO4 Растворитель: CH3COOH ледяная. Индикатор: кристаллический фиолетовый. Гексаметилпарарозанилинил хлорид. Три-(п-диметиламинофенил) карбоний хлорид. В щелочной среде фиолетовый, в кислой – желтый. 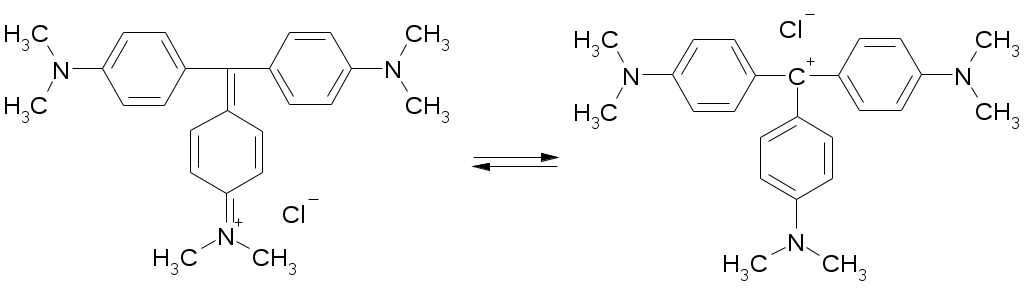 1. Растворение титранта. Образуется положительно заряженный ион "лиония" – ацетоний = ацелоний. HClO4 + CH3COOH ClO4- + CH3COOH2+ 2. Растворение слабого основания в неводном растворителе. Образуется отрицательно заряженный ион "лиат" – ацетат. R3N + CH3COOH R3N+H + CH3COO- 3. Нейтрализация лиония и лиата. Суть процесса, единственная необратимая реакция. CH3COO- + CH3COOH2+ 2CH3COOH 4. ClO4- + R3N+H [R3N+H]ClO4- Часто при титровании в ледяной уксусной кислоте добавляют уксусный ангидрид: 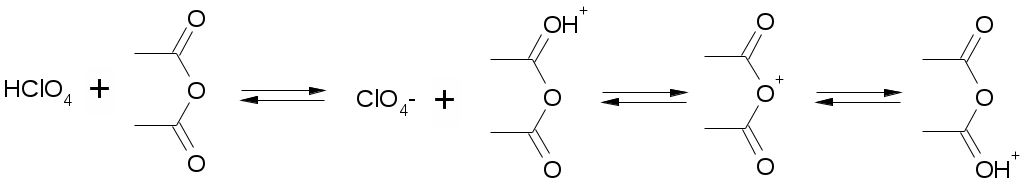 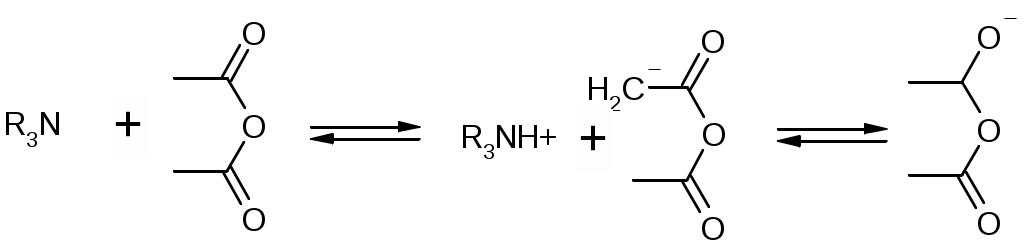 Роль уксусного ангидрида: Связывает воду Усиливает основные свойства слабых оснований (в большей мере, чем уксусная кислота). Смотри кофеин. Ацилирует амино-, гидразино-группы, защищяя их при титровании. Смотри изониазид. Способен связывать галогенид-ионы при титровании солей оснований в неводных средах. Титрование солей: R3N•HA + CH3COOH R3NH+ + CH3COO- + HA (R3N)2H2SO4 + CH3COOH R3NH+ + CH3COO- + (R3NH+)HSO4- Для солей серной, фосфорной, азотной кислот никаких особенностей больше нет. Они титруются по первой ступени, фактор равен единице. А если мы имеем дело с солями галоген-водородных кислот, то возникают сложности. Выделяющаяся кислота может повлиять титрование. HHal H+ + Hal- Cl- + CH3COOH HCl + CH3COO- И получится, что титрование идет не количественно. Поэтому надо связать все анионы галогенидов. Используют уксусный ангидрид: R3N•HHal + (CH3CO)2O R3NH+ + CH3COO- + CH3COCl Препараты:Aether medicinalis. Эфир медицинский. C2H5-O-C2H5Описание: бесцветная прозрачная подвижная летучая легковоспламеняющаяся жидкость со своеобразным запахом. Растворимость: растворим в воде, неограниченно в спирте, бензоле, эф. и ж. маслах Получение: C2H5OH + H2SO4 C2H5OSO3H + H2O C2H5OSO3H + C2H5OH C2H5-O-C2H5 + H2SO4 Подлинность: Ткип и плотность Примеси: Пероксиды C2H5-O-O-C2H5 + 2KI + H2O I2 + C2H5-O-C2H5 + 2KOH Альдегиды (темно-бурый осадок). CH3CHO + 3KOH + K2HgI4 комплекс ртути + CH3COOK + 4KI + 2H2O Применение: растворитель для настоек, экстрактов, в фармацевтическом анализе. Хранение: в хорошо укупоренной таре склянках оранжевого стекла без света вдали от огня. Закупоривают корковыми пробками с пергаментной подкладкой и заливают специальной цинк-желатиновой массой. Aether medicinalis pro narcosiПримеси: Дополнительно проверяется на наличие примеси воды. Реактив пикриновая кислота – окрашивает воду в желтый цвет. Хранение: Список Б. Хранят без доступа воздуха. Сразу после получения и очистки помещают во флаконы оранжевого стекла, закрытые корковой пробкой, под которую подкладывают металлическую фольгу, а поверх заливают специальной мастикой. Контроль каждые 6 месяцев. Цинк в фольге: Zn + C2H5OOC2H5C2H5OC2H5 +ZnO Zn + CH3CHO + H2O C2H5OH + ZnO Применение: Используют ограниченно, заменяя закисью азота, циклопропаном и фторотаном. Dimedrolum. Димедрол. N,N – диметил – 2 – (дифенилметокси)-этиламина гидрохлорид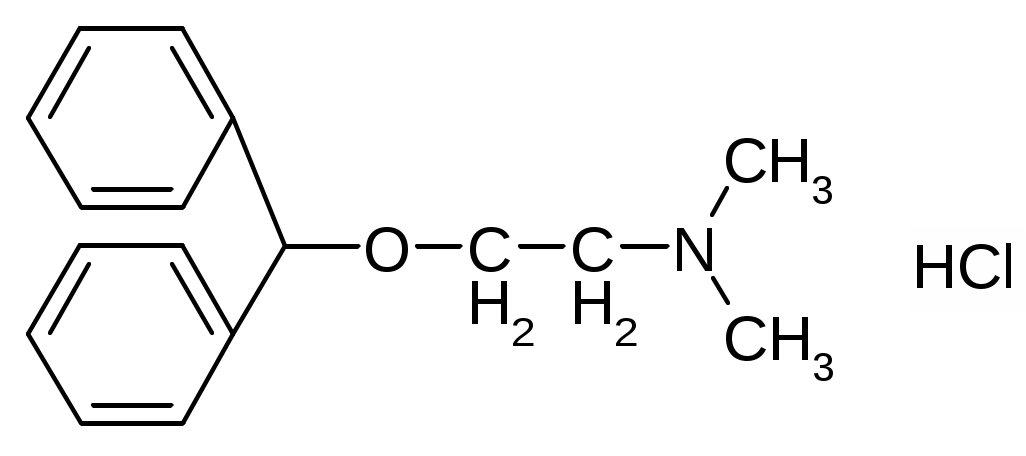 Описание: белый мелкокристаллический порошок горького вкуса вызывает чувство онемения языка, гигроскопичен. Растворимость: очень легко растворим в воде; легко в спирте и хлороформе, очень мало растворим в эфире. Получение: Ph-CO-Ph Подлинность: 1. димедрол 2. ИКС по количеству и интенсивности полос поглощения 3. УФС спиртового раствора при 230-280 нм. Препарат должен иметь 3 максимума и 3 минимума: 2532 нм, 2582 нм, 2642 нм и 2442 нм, 2552 нм, 2632 нм соответственно. 4. реакции на Cl- 5. образование бензгидрола: димедрол Чистота: контролируется прозрачность цветность и рН водного раствора. ТСХ определение амины, бензгидрол. Количественное определение: 1. неводное титрование – ацидиметрия с контрольным опытом. Растворитель – уксусный ангидрид, титрант – 0,1М HClO4 в лед. кислоте, индикатор – кристаллический фиолетовый, титруют до зеленого окрашивания раствора 2димедрол + 2HClO4 + Hg(CH3COO)2 f=1; 2. Прямая алкалиметрия в водной среде с добавлением органического растворителя D + NaOH Индикатор: фенолфталеин. Титрование: до розового окрашивания в водном слое. f=1 3. Меркуриметрия – по НСl 4. Аргентометрия – методом Фаянса с бромфеноловым синим 5. Йодхлорметрия: D +ICl = D•ICl желтый осадок 6. УФ, экстракционная ФК. Хранение: список Б, в хорошо укупоренной таре, защищенном от света и влаге месте. Применение: антигистаминное, слабый снотворный эффект, выпускается в таблетках, инъекционных растворах, микстуры, капсулы. |
