тесты фармхимия. ФАРМХИМИЯ_1. Государственная фармакопея рф
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
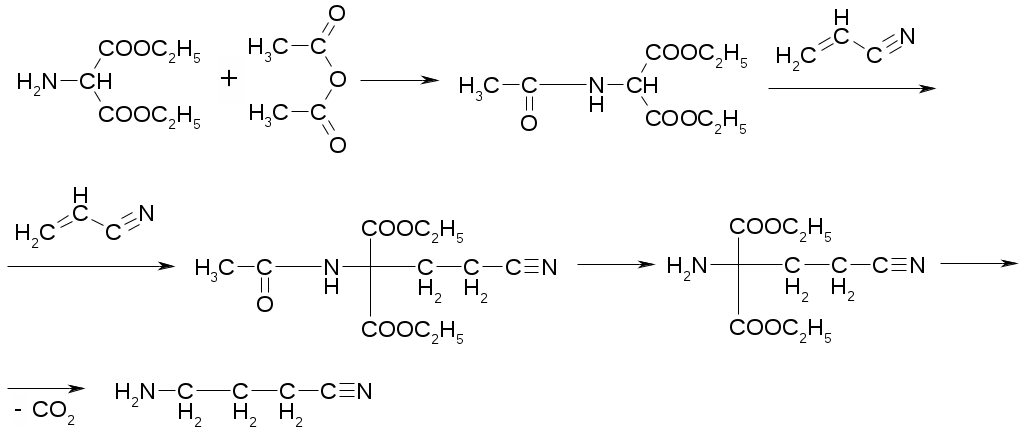
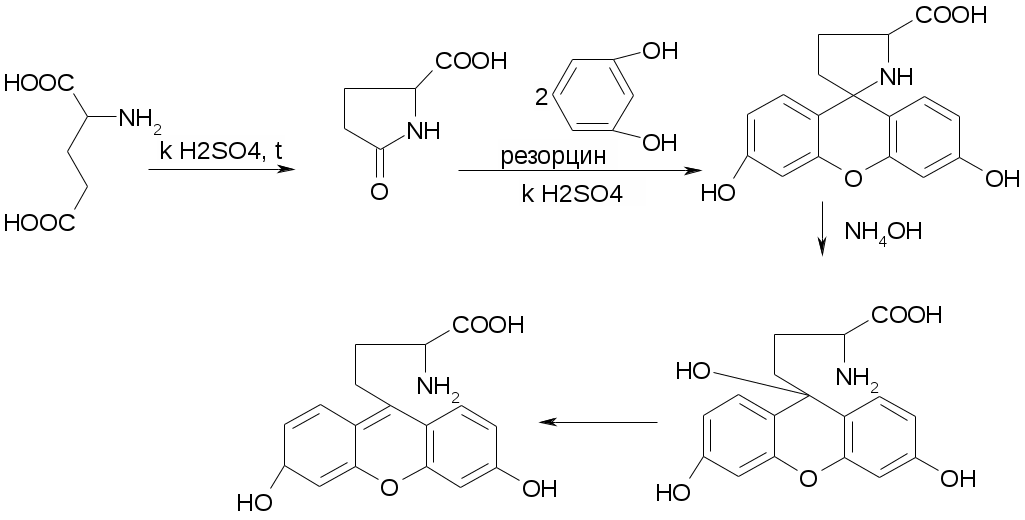
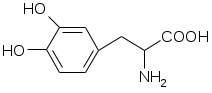
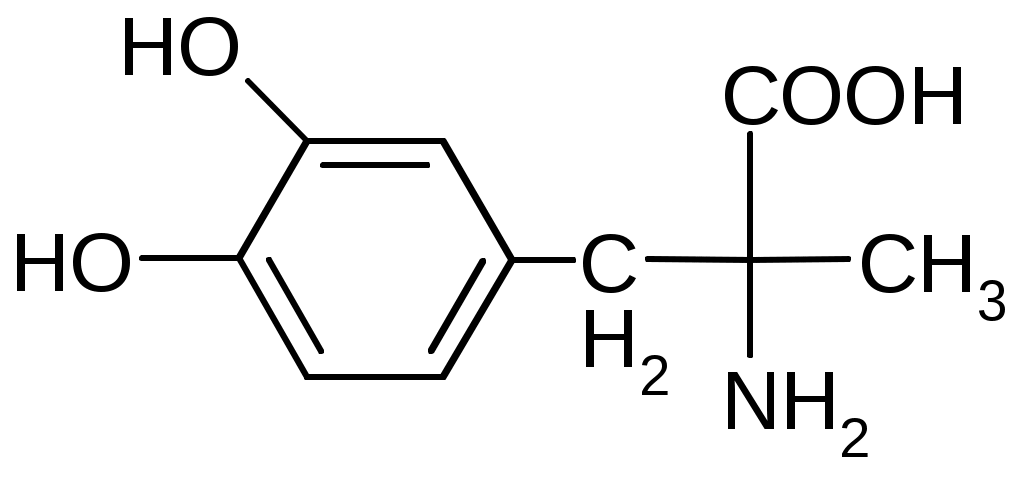
Препараты алифатических аминокислот.Аминокислоты – соединения природного происхождения, являются строительным материалом для конструкции природных белков и пептидов. Характерная особенность – наличие амино- и карбоксилоной групп. Природные аминокислоты – бесцветные, белые и желтоватого оттенка кристаллические субстанции, хорошо растворимые в воде, хуже в органических растворителях. Некоторые имеют запах. Источники: 1. Природные объекты – мясо, молоко, кожа. Получают гидролизом. 2. Синтетические – более 70% всех получаемых аминокислот. Синтезируют на основе галогенкарбоновых кислот или амномалонового эфира. Строение: Тесно связано с физическими свойствами ассиметрического атома углерода (оптическая активность). 1. -COOH, -NH2 придают свойства амфотерности. АК взаимодействуют и с кислотами и со щелочами, способны образовывать комплексы с медью, серой, цинком, свинцом и др. 2. COO-, NH3+ (образование цветтер-иона). 3. Мало и медленно, но растворимы в воде, лучше в горячей, нерастворимы или плохо растворимы в органических растворителях Химические свойства:1. На карбоксильную группу (-COOH) а) СH3-CH2-CH(NH2)-COOH + NaOH CH3CH2CH(NH2)COONa + H2O б) образование сложных эфиров. в) СH3-CH2-CH(NH2)-COOH + CuSO4 + 2NaOH (СH3-CH2-CH(NH2)-COO-)2Cu (водородные связи между медью и атомами азота). 2.На аминогруппу (-NH2) а) СH3-CH2-CH(NH2)-COOH + HX [СH3-CH2-CH(NH3+)-COOH]X- б) Нингидриновая проба: реакцию можно вести в пробирке и на хроматографической бумаге и ТСХ. Окраска переходит от меловой до сине-красной. 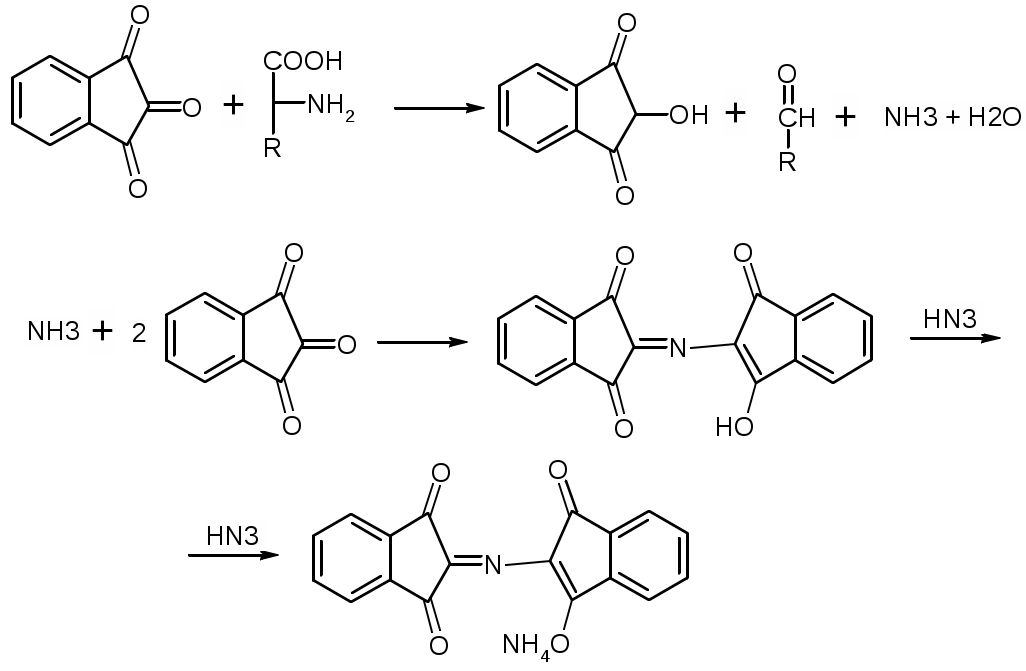 На пластинку наносят раствор анализируемой АК, хроматограмму выдерживают в бутанол, уксусной кислоте, воде. Затем высушивают на воздухе, обрабатывают 1% раствором нингидрина в ацетоне, высушивают в сушильном шкафу при 105 С, затем смотрят в УФ свете. Сине-фиолетовый цвет свидетельствует о присутствии АК. в) Образование лактамов: 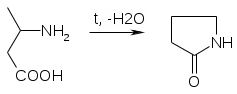 Образуется неустойчивая соль, легко разрушающаяся в щелочной среде. Общие требования к чистоте:1. Испытывается удельное вращение 2. Кислотность. 3. Посторонние АК 4. Общие примеси. Оптическая изомерия:Оптическое вращение – способность вещества вращать плоскость поляризации при прохождении через него поляризованного луча. В зависимости от природы оптически активного вещества, вращение плоскости поляризации может иметь разные направления и величины. Если вращение по часовой стрелке (+), то вещество правовращающее. Угол вращения – величина отклонения плоскости поляризации от начального положения, выражается в угловых градусах и зависит от: 1. Природы оптически активного вещества. 2. Длины пути поляризованного света. 3. Длины волны света. Если это растворы, то величина зависит также от: 1. Природы растворителя. 2. Концентрации вещества. Удельное вращение []D20 – константа, определяемая расчетным путем как угол поворота плоскости поляризации монохромного света на пути длиной 1 дм в среде, содержащей оптически активного вещества 1 г/мл. Если нет специальных указаний, то измеряют при 20 градусах и длине волны, соответствующей слою поглощения Na, т.е. 589,3 нм. Используют для определения подлинности, чистоты, количественного определения. Методы количественного определения АК.1. Метод Кьельдаля. Точную навеску АК, смешивают с порошком K2SO4, CuSO4 (10:1). К полученой смеси прибавляют H2SO4. Проводят реакцию в колбе Кьельдаля, соединенной с холодильником и специальным приемником. При нагреве идет минерализация: CCO2; NNH3(NH4)2SO4 Нагревают до полного просветления раствора, затем колбу охлаждают, прибавляют NaOH. Идет процесс нейтрализации избытка H2SO4, разрушение аммониевой соли. H2SO4 + NaOH Na2SO4 + H2O (NH4)2SO4 + NaOH Na2SO4 + NH3 + H2O Аммиак в специальном приемнике реагирует с борной кислотой: 2NH3 + 4H3BO3 (NH4)2B4O7 + 5H2O Титруют HCl в присутствии м/о + м/с. Разрушается тетраборат с образованием H3BO4 + NH4Cl. 2. Алкалиметрия. RCH2-CH(NH2)-COOH + NaOH Наличие группы -NH2 затрудняет метод, ослабляя кислотные свойства аминокислоты. 3. Формольное титрование по Беренсену. R-CH(NH2)-COOH + HCHO RCH2-CH(N=CH2)-COOH 4. Неводное титрование (по -NH2 группе). Титруют в ледяной уксусной кислоте раствором HClO4 как основание (по аминогруппе). Индикатор – кристаллический фиолетовый (смотри неводное титрование). 5. Газометрический метод Ван-Слейка. При прибавлении к АК фиксированного количества NaNH2 и HCl, происходит выделение N2, который определяют газометрически (ГЖХ). По объему азота рассчитывают содержание АК. Препараты: Acidum glutaminicum - -аминоглутаровая кислота. |