тесты фармхимия. ФАРМХИМИЯ_1. Государственная фармакопея рф
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
Галогены и их соединения с щелочными металламиКачественные реакции на катионы щелочных металловNa+1. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет 2. С цинкуранилацетатом выпадает желтый кристаллический осадок. NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O NaZn[(UO2)3(CH3COO)9]•9H2O + HCl K+1. Окрашивает пламя в фиолетовый цвет. 2. С раствором винной кислоты в присутствии ацетата натрия и спирта. COOH-(CHOH)2-COOH + KBr Ацетат натрия добавляют для связывания минеральных кислот. CH3COONa + H+ Этиловый спирт добавляют для уменьшения растворимость осадка. Но если спирта много, то в осадок выпадает винная кислота. Осадок растворим в минеральных кислотах: COOK-(CHOH)2-COOH + HСl COOH-(CHOH)2-COOH + KCl В щелочах (образуется синьетова соль): COOK-(CHOH)2-COOH + NaOH COONa-(CHOH)2-COOK 3. С раствором кобальтонитрита натрия, он же гексанитрокобальтат натрия выпадет желтый кристаллический осадок. 2KCl + Na3[Co(NO2)6] Качественные реакции на анионы-галогенидыHal- + AgNO3 Все другие соли серебра, кроме галогенидов растворяются в азотной кислоте. AgCl – белый творожистый осадок, легко растворим в растворе аммиака (10%). AgCl + 2NH4OH [Ag(NH3)2]Cl + 2H2O AgBr - светло-желтый, творожистый, трудно растворим в растворе аммиака (10%). AgI - желтый творожистый осадок, нерастворим в растворе аммиака (10%) Br-1. С раствором хлорамина Б. Ph-SO2-NNa-Cl + 2HCl p Ph-SO2NH2 + Cl2 + NaCl Cl2 + 2KBr цвет хлороформного слоя – желто-бурый, желто-оранжевый 2. Реакция с KMnO4 (не фармакопейная). 2KMnO4 + 10KBr + 8H2SO4 хлороформ окрашивается в желто-бурый цвет. I-1. Он более сильный восстановитель, используют слабые окислители. 2KI + 2NaNO2 + 2H2SO4 I2 + 2NO2 + 2Na2SO4 + K2SO4 + 2H2O 2. I- при нагревании с серной кислотой образуется йод, который обнаруживают по образованию фиолетовых паров. 8HI + H2SO4 к H2S + 4I2 + 4H2O Количественное определение галогенидовМетод Мора - NaCl, KCl, NaBr, KBr - ГФ XТочную навеску препарата растворяют в воде и титруют 0,1М AgNO3 с индикатором K2CrO4 при pH=6-8 до оранжево-желтого окрашивания. NaBr + AgNO3 NaNO3 + AgBr КТТ: K2CrO4 + 2AgNO3 KNO3 + Ag2CrO4 кирпично-красный. Ограничения: в кислой среде CrO42- Cr2O72- и обр. осадок Ag2Cr2O7 другого цвета. Метод пригоден только для бесцветных растворов. Метод не используется для I-, т.к. AgI образует коллоидный раствор, затрудняющий осаждение в точке эквивалентноси, мешают SO42-, S2-, PO43-, AsO43-, BO33-, взаимодействующие с Ag+ с образованием осадков. Мешают также Hg2+, Pb2+, Ba2+, из-за образования осадков с индикатором. Среда для титрования нейтральная или слабощелочная, т.к. в сильнощелочной среде выпадает черный осадок: Ag+ + OH- AgOH Ag2O f(NaBr)=1; Метод Фаянса – KI, NaI (ГФ X)Точную навеску препарата предварительно высушивают при 110 С, растворяют в 30 мл воды, прибавляют 1,5 мл. CH3COOH, 5 капель раствора эозината натрия и титруют 0,1M AgNO3 до перехода окраски от желтой до розовой. рН – слабокислая (CH3COOH). Индикатор – адсорбционный (эозинат натрия – рис, [Ind2-](Na+)2 ) 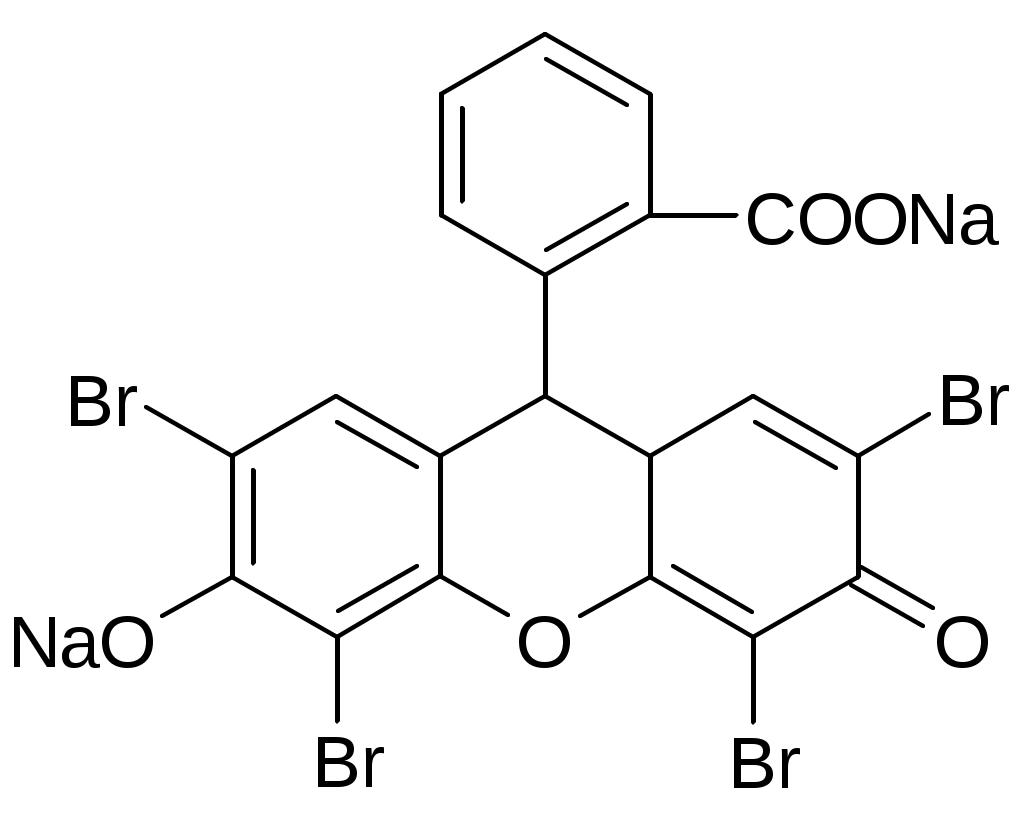 KI + AgNO3 Избыток Ag: AgI Частица индикатора связывает 2 коллоидные частицы [AgI•Ag]+, происходит коагуляция. f(KI)=1; Индикатор – соль органической кислоты, диссоциирует в растворе. В присутствии минеральных кислот диссоциации и окрашивания нет. Можно также определять Cl, Br (НЕ ГФ) Навеску растворяют + бромфеноловый синий + CH3COOH до зеленоватого цвета, титруют до фиолетового окрашивания. 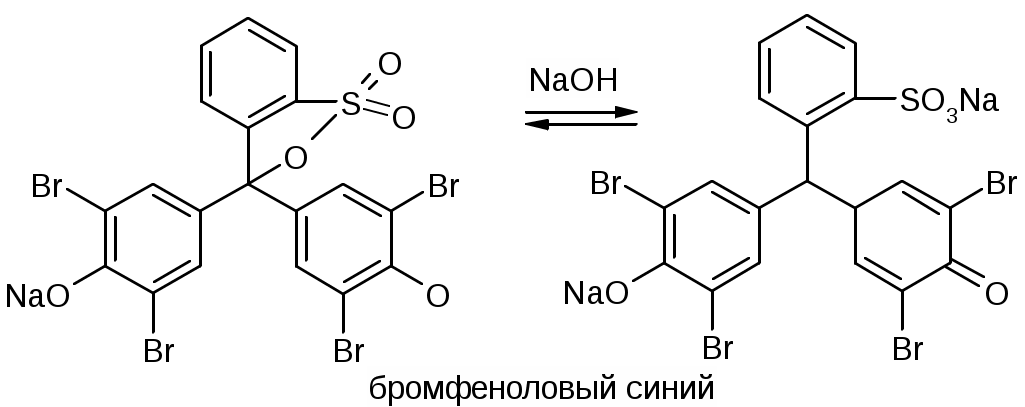 Метод Фольгарда – Br, I, (Сl)Обратное титрование. Титрант – 0,1M AgNO3, Ind – FeNH4(SO4)2 (железоаммонийные квасцы); pH=3 (HNO3). Избыток AgNO3 оттитровывают NH4SCN. KBr + AgNO3 точн. избыток избыток AgNO3 + NH4SCN КТТ: 3NH4SCN + FeNH4(SO4)2 Преимущества: можно титровать в кислой среде, не мешают ионы. Недостатки: меньше точности, для Cl - очень осторожно, т.к. ПР(AgCl) > ПР(AgSCN), AgCl будет растворяться и превращаться в AgSCN. Добавляют органический растворитель, экранирующий AgCl. При определении I-, Fe3+ индикатора – окислитель. I- I2, поэтому индикатор добавляют в последний момент. f(KBr)=1; Метод Кальтгоффа-Стенгера – Br-Титранты – 0,1M AgNO3; 0,1M NH4SCN, обратное титрование. Титруют до розового окрашивания. Отличае от метода Фольгарда в порядке добавления титрантов. Индикатор – железоаммонийные квасцы FeNH4(SO4)2 3NH4SCN точн. избыток + FeNH4(SO4)2 Титруют: KBr + AgNO3 AgNO3 + NH4SCN КТТ: Fe(SCN)3 + 3AgNO3 3AgSCN + Fe(NO3)3 f(KBr)=1; Преимущества: мало расходуется нитрат серебра. Используют для определения бромкамфоры после минерализации. Метод Кальтгоффа – I- в присутствии Cl, Br – йодкрахмальный методРаствор препарата + 1 капля KIO3 + раствор крахмала и H2SO4 разв. до появления синего окрашивания. KIO3 + 5KI + 3H2SO4 Титруют AgNO3 до исчезновения синего окрашивания. KI + AgNO3 AgI + KNO3 f(KI)=1; Окислительное титрованиеПрямые бромато-, йодато-, перманганатометрии. Навеску растворяют в воде, прибавляют KCl разведенный и крахмал. Титруют 0,1M KBrO3 до перехода окраски из бурой через синюю до снова бурой, и, в конечном счете, в лимонно-желтую. 6KI + KBrO3 + 6HCl 3I2 + KBrO3 + 6HCl(р) 6IСl + KBr + 3H2O (лимонно желтые) f(KI)=1/2; Меркуриметрия: - прямое осадительное титрованиеТитрант: 0,1M Hg(NO3)2, реже Hg(ClO4)2; pH=2-3 (HNO3) Индикатор: раствор нитропуссида Na: Na2[Fe(CN)5NO], дифенилкарбазон: Ph-N=N-CO-NH-NH-Ph Навеску растворяют в воде и титруют до образования неисчезающей белой опалесценции (1ый индикатор) или сине-фиолетового окрашивания (2ой индикатор) 1) 2NaCl + Hg(NO3)2 КТТ: Na2[Fe(CN)5NO] + Hg(NO3)2 Hg[Fe(CN)5NO] + 2NO3- (белая опалесценция) 2) 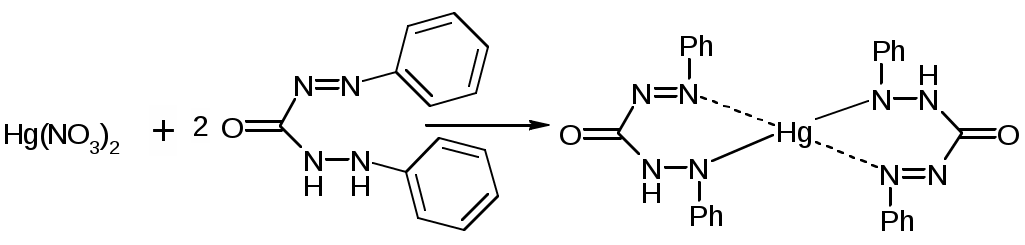 f(NaCl)=1; В случае с I- необходимо добавить спирт по 10 мл на 10 мг йодида. В КТТ спирта должно быть 50-60%. HgI2 может образовывать [HgI4]2- и растворяться. HgI2 со спиртом образуют более прочный комплекс. Безиндикаторная меркуриметрия для I-Титрант: Hg(NO3)2 2KI + Hg(NO3)2 2KI + HgI2 K2[HgI4] Титруют до появления неисчезающего розового осадка. КТТ: K2[HgI4] + Hg(NO3)2 2HgI2 + KNO3 (красный) f(KI) = 2; Преимущества: точность, экономичность, можно титровать при сильнокислом рН. Недостатки: ядовитые соли ртути. Аргентометрия с внешним индикаторомИндикатор – нитрит-крахмальная бумага. Титруют AgNO3 в присутствии H2SO4. Рассчитывают теоретический объем титранта (AgNO3) и около точки эквивалентности каждый раз при добавлении титранта переносят каплю раствора на индикатор. Если нет синего окрашивания – конец титрования. KI + AgNO3 KNO3 + AgI KI + NaNO2 + H2SO4 f=1; Недостатки: потери при выносе капли, приблизительные расчеты объема титранта. Примеси в препаратах галогенидовБарий, кальций и броматы определяют за одно испытание, прибавляя 1 мл H2SO4, раствор должен быть прозрачным и не должен окрашиваться в желтый цвет в течении 5 минут. Ba2+ + H2SO4к BaSO4 Ca2+ + H2SO4к CaSO4 5Br- + BrO3- + 3H2SO4 3Br2 + SO42- + 3H2O Примесь йодатов, тиосульфатов и сульфитов. Приб. несколько капель крахмала и разв. H2SO4. Жидкость не должна приобретать в течение 30 секунд заметного синего окрашивания. 5KI + KIO3 + 3H2SO4 3I2 + K2SO4 + 3H2O Синее окрашивание должно появиться при прибавлении не более одной капли 0,1 М I2. 2Na2S2O3 + I2 2NaI + Na2S4O6 Na2SO3 + I2 + H2O Na2SO4 + 2HI Примесь цианидов определяют, добавляя FeSO4, FeCl3. Подщелачивают, слегка нагревают, после подкисления раствор не должен окрашиваться в синий цвет (берлинская лазурь). 2CN- + FeSO4 Fe(CN)2 + SO42- 4CN- + Fe(CN)2 [Fe(CN)6]4- K4[Fe(CN)6] + FeCl3 KFe[Fe(CN)6]- + 3KCl Примесь йодидов определяют, добавляя 3 капли FeCl3 и несколько капель крахмала. В течение 10 мин. не должно быть синего окрашивания. 2I- + 2FeCl3 Примесь нитратов определяют, добавляя NaOH и цинковые или железные опилки. Нагревают. Влажная красная лакмусовая бумажка в парах жидкости не должна синеть. Zn + NaOH Препараты:Natrii chloridumНатрия хлорид, NaCl, М. в. 58,44 Описание. Белые кубические кристаллы или белый кр. порошок без запаха, соленого вкуса Растворимость. Растворим в 3 ч. воды, мало растворим в спирте. Чистота: Кислотность и щелочность. К 50 мл того же раствора прибавляют 5 капель раствора бромтимолового синего и 0,1 мл 0,02 н. раствора едкого натра; должно появиться голубое окрашивание. К другим 50 мл того же раствора прибавляют 5 капель раствора того же индикатора и 0,1 мл 0,02 н. раствора соляной кислоты; должно появиться желтое окрашивание. Недопустимые примеси: Калий, Кальций, Барий Допустимые примеси: Соли аммония, Магний, Железо, Тяжелые металлы, Сульфаты, Мышьяк. Количественное определение: Неводное титрование1 в среде ледяной уксусной кислоты. Титрант – хлорная кислота HСlO4, индикатор – кристаллический фиолетовый. Вещества в препарате должно быть не менее 99,5%. Хранение. В хорошо укупоренной таре. Применение: физиологический раствор. Natrii bromidumНатрия бромид, NaBr, M. в. 102,90 Описание. Белый кристаллический порошок без запаха, соленого вкуса. Гигроскопичен. Растворимость. Растворим в 1,5 ч. воды и в 10 ч. спирта. Чистота: Щелочность. (см. Натрия хлорид). Недопустимые примеси: барий, кальций, броматы. Допустимые примеси: сульфаты, тяжелые металлы, железо, мышьяк. Количественное определение: Метод Мора. Вещества в препарате должно быть не менее 98,5%, и не более 101,5% Хранение. В хорошо укупоренной таре. Применение: успокаивающее средство. Natrii iodidumНатрия йодид , Nal, M. в. 149,83 Описание. Белый кристаллический порошок, без запаха, соленого вкуса. На воздухе сыреет и разлагается с выделением йода. Растворимость. Растворим в 0,6 ч. воды, в 3 ч. спирта и 2 ч. глицерина. Чистота: Щелочность (см. Натрия хлорид). Недопустимые примеси: цианиды, барий, йодноватая кислота, тиосульфат, сульфит, нитраты. Допустимые примеси: сульфаты, тяжелые металлы, железо, мышьяк. Количественное определение: Метод Фаянса. Вещества должно быть не менее 99,0% Хранение. В хорошо укупоренных банках оранжевого стекла в сухом месте. Применение: при бронхиальной астме, атеросклерозе, пневмонии, сифилисе и др. заболеваниях. Kalii chloridumКалия хлорид, КС1, М. в. 74,56 Описание. Бесцветные кристаллы или белый кристаллический порошок без запаха, соленого вкуса. Растворимость. Растворим в 3 ч. воды, практически нерастворим в 95% спирте. Чистота: Кислотность и щелочность. (см. Натрия хлорид). Недопустимые примеси: Натрий, Кальций, Барий, Соли аммония. Допустимые примеси: Магний, Железо, Тяжелые металлы, Сульфаты, Мышьяк. Количественное определение: Неводное титрование2 в среде ледяной уксусной кислоты. Титрант – хлорная кислота HClO, индикатор – кристаллический фиолетовый. Вещества в препарате должно быть не менее 99,0% Хранение. В хорошо укупоренной таре, предохраняющей от действия влаги. Применение. Источник ионов калия (применяют при гипокалиемии); диуретическое средство. Kalii bromidumКалия бромид, KBr, M. в. 119,01 Описание. Бесцветные или белые блестящие кристаллы или мелкокристаллический порошок без запаха, соленого вкуса. Растворимость. Растворим в 1,7 ч. воды, мало растворим в спирте. Чистота: Щелочность. (см. Натрия хлорид). Недопустимые примеси: барий, кальций, броматы. Допустимые примеси: сульфаты, тяжелые металлы, железо, мышьяк. Количественное определение: Метод Мора. Вещества в препарате должно быть не менее 99,0% и не более 100,6%. Хранение. В хорошо укупоренной таре, предохраняющей от действия света. Применение. Успокаивающее средство. Kalii iodidumКалия йодид, KI, М. в. 166,01 Описание. Бесцветные или белые кубические кристаллы или белый мелкокристаллический порошок без запаха, солено-горького вкуса. Во влажном воздухе сыреет. Растворимость. Растворим в 0,75 ч. воды, в 12 ч. спирта и в 2,5 ч. глицерина. Чистота: Щелочность (см. Натрия хлорид). Недопустимые примеси: цианиды, барий, йодноватая кислота, тиосульфат, сульфит, нитраты. Допустимые примеси: сульфаты, тяжелые металлы, железо, мышьяк. Количественное определение: Метод Фаянса. Вещества в препарате должно быть не менее 99,5%. Хранение. В хорошо укупоренных банках оранжевого стекла. Применение: При бронхиальной астме, атеросклерозе и др. заболеваниях. IodumЙод, А. в. 126,90 Описание. Серовато-черные с металлическим блеском пластинки или сростки кристаллов характерного запаха. Летуч при обыкновенной температуре, при нагревании возгоняется, образуя фиолетовые пары. Растворимость. Очень мало растворим в воде, легко растворим в водном растворе йодидов, растворим в 10 ч. 95% спирта, в эфире и хлороформе. Растворы в хлороформе фиолетового цвета. Подлинность. Раствор препарата в воде от прибавления 1 капли раствора крахмала окрашивается в синий цвет. При кипячении окраска исчезает и появляется вновь при охлаждении. Чистота: прозрачность и цветность раствора. 1 г растертого препарата должен полностью растворяться в 25 мл 10% раствора тиосульфата натрия, образуя прозрачный и бесцветный раствор. 2Na2S2O3 + I2 2NaI + Na2S4O6 Йодистый циан. 0,75 г препарата растирают с 30 мл воды и фильтруют. 10 мл фильтрата обесцвечивают разведенным раствором сернистой кислоты: I2 + H2SO3 Прибавляют 1 каплю раствора сульфата закисного железа, 1 каплю раствора хлорида окисного железа и 0,5 мл раствора едкого натра. Смесь слабо нагревают и подкисляют разведенной соляной кислотой; не должно появляться синее окрашивание. ICN + 2NaOH NaCN + NaIO + H2O 2NaCN + FeSO4 Fe(CN)2 + Na2SO4 Fe(CN)2 + 4NaCN Na4[Fe(CN)6)] Na4[Fe(CN)6] + FeCl3 FeNa[Fe(CN)6] Галогены. Водный раствор йода обесцвечиваем сернистой кислотой. Йодид осаживают нитратом серебра в присутствии NH4OH (AgCl растворяется), фильтруют, в фильтрате определяют хлорид: [Ag(NH3)2]Cl + 2HNO3 AgCl + 2NH4NO3 Количественное определение. Прямое титрование тиосульфатом натрия. 2Na2S2O3 + I2 2NaI + Na2S4O6 f= ½; Вещества в препарате должно быть не менее 99,5%. Хранение. Список Б. В стеклянных банках с притертыми пробками, в прохладном, защищенном от света месте. Применение: антисептик, обработка ран, воспаления кожи. Solutio lodi spirituosa 5%Раствор йода спиртовой 5% Йода 50 г Калия йодида 20 г Воды и спирта 95% поровну до 1 л Описание. Прозрачная жидкость красно-бурого цвета с характерным запахом. Подлинность. 1 каплю препарата разводят 10 мл воды и прибавляют 1 мл раствора крахмала; появляется сине-голубое окрашивание. Спирт не менее 46% Количественное определение. Для I2: 2 мл препарата помещают в коническую колбу емкостью 200 мл с притертой пробкой и титруют 0,1 М раствором тиосульфата натрия до обесцвечивания (без индикатора). 2Na2S2O3 + I2 2NaI + Na2S4O6 f=½; Для KI: к полученному раствору прибавляют 25 мл воды, 2 мл разведенной уксусной кислоты, 5 капель эозината натрия и титруют 0,1 М раствором нитрата серебра до перехода окраски осадка от желтой к розовой (Метод Фаянса). KI + AgNO3 AgI + KNO3 2NaI + 2AgNO3 2AgI + 2NaNO3 Вещества в препарате должно быть 1,9-2,1%. Хранение. Список Б. В склянках оранжевого стекла, в защищенном от света месте. Применение: антисептик, обработка ран, воспаления кожи. |
