Фенолы.
Получение:
1. Из дегтя, каменно-угольной смолы.
2. Из бензолсульфоктислоты.
3. Из солей диазония.
Физические свойства: Кристаллические вещества, без цвета, но могут иметь оттенок (легко окисляются), запах.
Растворимость: в воде хуже, чем в органических растворителях.
Химические свойства:
1) реакции фенольного гидроксила:
а. Образование солей.
б. Образование сложных эфиров.
в. Образование комплексных солей с тяжелыми металлами.
2) Реакции ароматического ядра:
а. Галогенирование.
б. Сульфирование.
в. Нитрование.
г. Азосочетание с солями диазония.
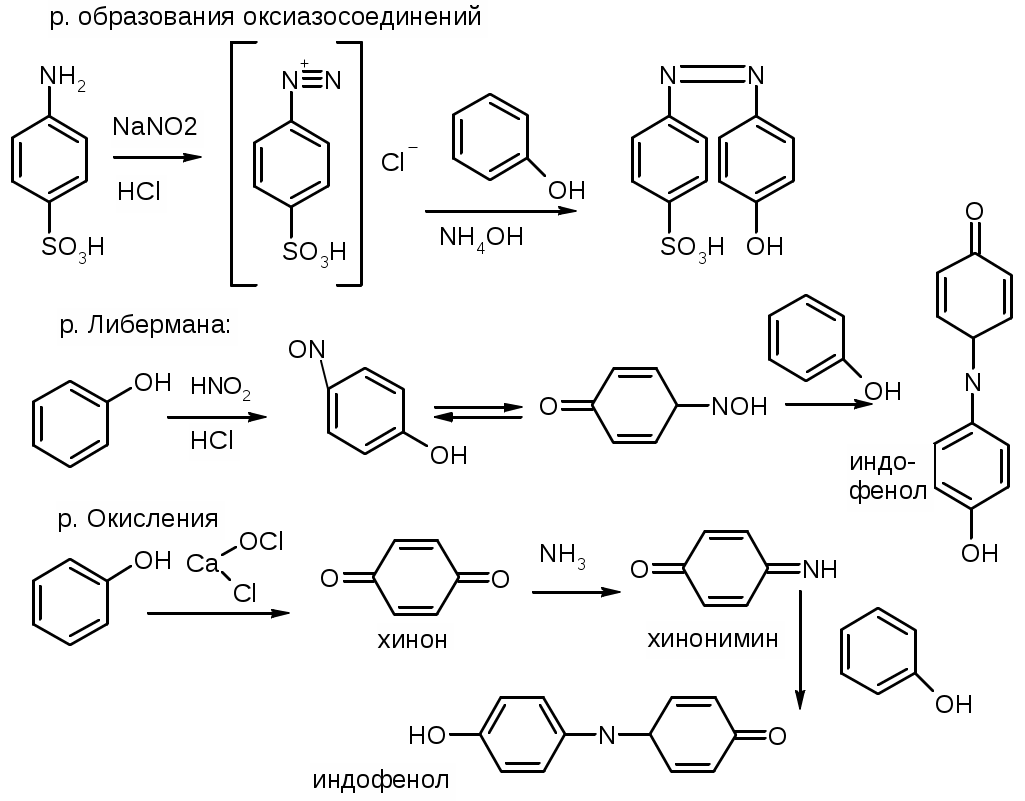
д. р-я Либермана (образование Индофенолов).
е. Нитрозирование.
3) Конденсация:
а. С альдегидами (в прис. H2SO4) ауриновый или трифенил метановый краситель.
б. С CHCl3/OH- при нагревании
в. С фталиевым ангидридом.
Phenolum purum seu Acudum carbolicum crystallisatum. Фенол чистый.
Получение: из каменно-угольной смолы.
Описание: бесцветные тонкие игольчатые кристаллы или мелкокристаллическая масса, на воздухе розовый, имеет запах.
Растворимость: растворим в воде, легко растворимм в спирте, эфире, хлороформе, жирных маслах, глицерине. Растворим в растворах едких щелочей, растворах аммиака.
Phenolum purum liquefactum seu Acidum carbolicum liauefactum
10% раствор воды в феноле. 100 ч расплавленного фенола + 10 ч воды
Описание: бесцветная или розоватая маслянистая жидкость со своеобразным запахом, слабокислая реакция среды.
Ka
1,28•10-10 (слабокислые свойства, но сильнее воды и спиртов).
Не растворяется в растворах карбонатов, гидрокарбонатов ( в отличие от ароматических карбоновых кислот).
Подлинность: ГФ 11
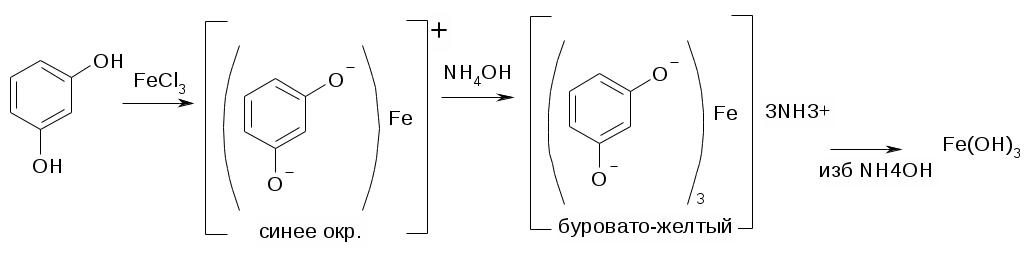
1. Образование фенолятов с FeCl3
Фенол + FeCl3 [(фенолят)Fe]2+ + [(фенолят)2Fe]+ + [(фенолят)3Fe]
Окрашивание исчезает от прибавления H+, или избытка воды или избытка спирта.
2. SE с бромной водой.
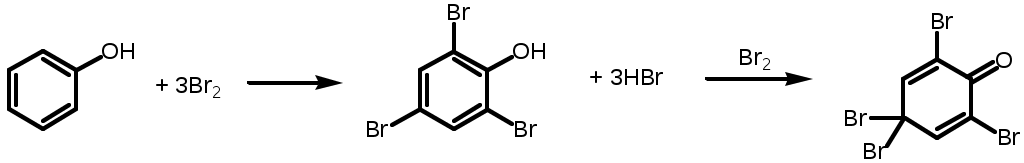
Не ГФ:
1. Конденсация с альдегидами (р-в Альки).
2. Азосочетание с сольями диазония. рН=8-10.
3. Нитрозирование. Индофенольная проба:
Чистота: определенная температура кипения, затвердевания. Специфическая недопустимая примесь – вода (р-р в хлороформе должен быть прозрачным). Кислотность и крезолы (водный раствор должен быть прозрачным, рН=7 или слабокислая. Плотность больше 1.
КО (ГФ): Обратная броматометрия в H2SO4
KBrO3 + 5KBr + H2SO4 3Br2 + 3K2SO4 + 3H2O
Фенол + 3Br2 трибром фенол + 3HBr
f=1/6
Br2 + 2KI I2 + 2KBr
I2 + 2Na2S2O3 2NaI + Na2S4O6
Не ГФ:
1) Йодометрия.
Фенол + 3I2 трийодфенол + 3HI (сильный в-ль)
Недостаток: реакция обратима
HI + NaHCO3 NaI + CO2 + H2O
HI + CH3COONa NaI + CH3COOH
f=1/6, параллельно контрольный опыт.
2) Йодхлорметрия (обратное титрование). Идет реакция йодирования. Плюс: трийдпроизводные образуются необратимо.
f=1/6
3) Цериметрия (обратное титрование)
Фенол + 4Ce(SO4)2 + 2H2O хинон (два кислорода напротив связаны двойными связями, две двойные связи в кольце) + 2Ce2(SO4)3 + 2H2SO4
Ce2(SO4)3 + KI I2
I2 + 2Na2S2O3 2NaI + Na2S4O6
f=1/4, параллельно контрольный опыт.
4) Титрование в неводных средах.
Р-ль: этилендиамин.
f=1
5) ФХМА: спектрофотометрия, фотокалориметрия.
Применение: дезинфицирующее 3%, 5% или мыльнокарболовый раствор.
0,5%, 1% - консервант. Для лечения Кожных заболеваний, заболеваний среднего уха. Легко всасывается через кожу, слизистые – токсичен. Готовые растворы в глицерине 3%, 5%. 2% мазь. «Фукорцин».
Хранение: в хорошо закупоренных банках в защ. от света месте. По списку Б.
Resorcinum seu Resorcinolum. м-дигидрокси бензол
Получение: бензол – сульфирование – спекание с твердым NaOH.
Описание: белый или со слабым желтоватым оттенком кристаллический порошок со слабым запахом, под действием света и воздуха приобретает розовый цвет.
Расторимость: ОЛР в воде, спирте, ЛР в эфире, ОМР в хлороформе, Р в глицерине, жирных маслах.
Подлинность: (ГФ)
1. С р-ром FeCl3
2. Сплавление с избытком фталиевого ангидрида.
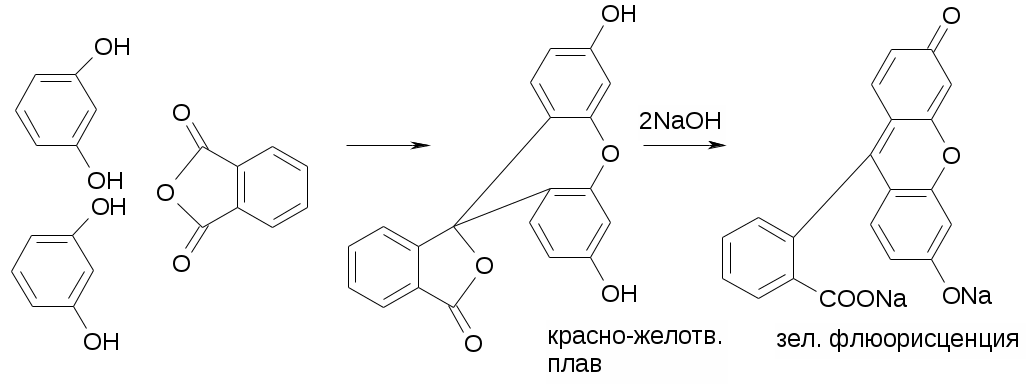
3. УФ спектр. 250-350 нм. Мах – 275.
4. С гидрофталатом калия.
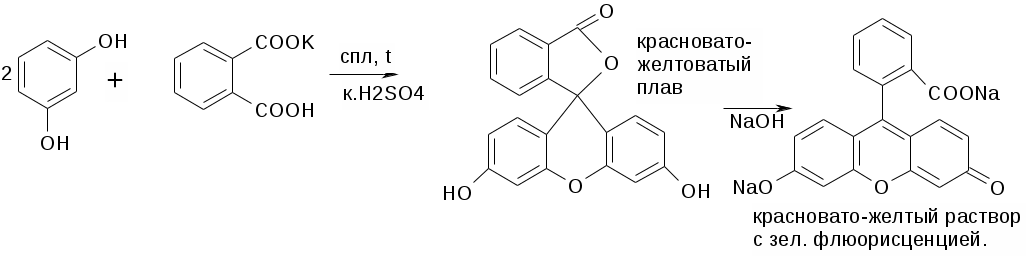
НЕ ГФ:
1. Образование ауринового красителя.
2. С хлороформом или хлоралгидратом в щелочной среде.
3. Конденсация с глюкозой – розовокрасная.
Чистота: температура плавления 109-112°С, прозрачность и цветность (сравнение с эталоном), рН 5% водн. р-ра = 5-6,5
Специфические примеси:
1. Фенол – органолептически (при нагревании с водой не должно быть запаха).
2. Пирокатехин - недопустима. Не должно быть помутнения или осадка:
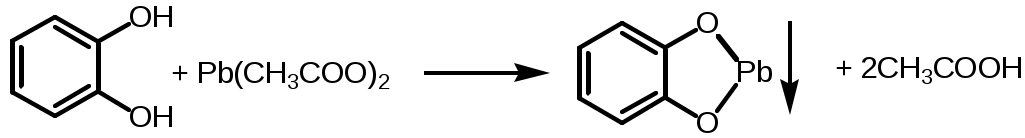
По новой ФС:
Пирокатехин + (NH4)6Mo7O24 Пирокатехин, у которого кислороды связаны с кольцом двойными связями, а в кольце осталось еще две двойные связи. + Mo5O14(синее окрашивание). Сравнивают с раствором стандартного образца пирокатехина, т.к. может быть синее окрашивание.
Посторонние примеси: ТСХ в сравнении со стандартным резорцином. Потеря в весе при высуш.
КО: обратная броматометрия (смотри фенол – то же самое).
НЕ ГФ:
1) Прямая броматометрия (ктт – потенциометрически).
2) Йодометрия (см. Фенол)
3) Йдохлорметрия (см. Фенол)
4) Нитритометрия. Образуется соединение: резорцин, у которого между ОНами группа –N=O, и еще одна такая же рядом с одним из ОНов. f = ½
5) Неводное титрование
6) ФХМА – фотокалориметрия.
Применение: наружный антисептик, водные и спиртовые растворы, мази. Фукорцин.
Хранение: список Б, в хорошо упак. таре оранжевого стекла.
Thymolum 2-изопропил, 5-метил фенол.
Применение: антигельминтное, антисептическое.
Описание: бесцветные кристаллы или кристаллический порошок с характерным запахом.
Растворимость: ОМР в воде, легко в спирте, хлороформе, эфире, жирных маслах, ледяной уксусной кислоте, Р в растворе едкого натра.
Подлинность:
1. В холодной воде погружается вниз, при 45°С поднимается на поверхность.
2. Со смесью кислот:
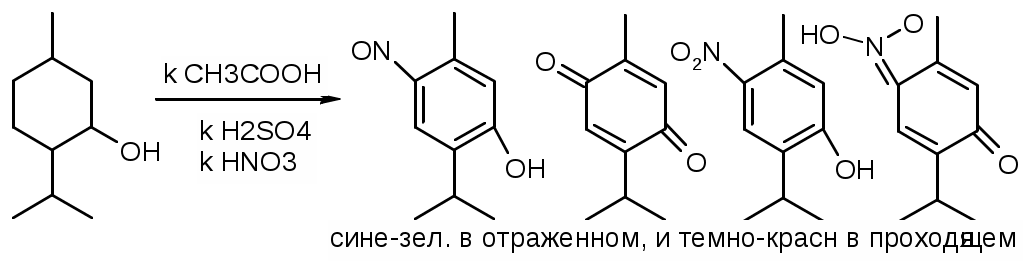
3. С хлороформом в щелочной среде фиолетовое или сиреневое окрашивание.
4. NB! тимол не образует окрашенных комплексов с FeCl3
НЕ ГФ:
1. Реакция с глюкозой в кислой среде – красный.
2. Сплавление с фталиевой кислотой, фталиевым ангидридом тимолфталин – кислотно-основной. Переход окраски от бесцветной к васильковой. рН=9,4-10,6
КО:
Прямая броматометрия (среда HCl). Индикатор – МО
Оглавление.
Общие темы. 1
Государственная фармакопея РФ 1
Структура ФС (ГФ XI) 1
Определение прозрачности и степени мутности 1
Определение окраски жидкостей 1
Растворимость 2
Реакции на общие примеси (с.166, т.1 ГФXI) 2
Галогены и их соединения с щелочными металлами 6
Качественные реакции на катионы щелочных металлов 6
Качественные реакции на анионы-галогениды 7
Количественное определение галогенидов 7
Примеси в препаратах галогенидов 11
Препараты: 12
Соединения кислорода. 15
Препараты: 15
Cоединения бора. 19 Соединения кальция, магния, бария цинка, висмута. 21
Комплексонометрия 21
Индикаторы: 22
Принцип работы индикатора 23
Препараты: 23
Соединения меди, серебра. 29 Органические лекарственные вещества 30 Препараты галогенпроизводных углеводородов 31
Методы минерализации 31
Способы отщепления ковалентно-связанного галогена с целью перевода его в ионное состояние 32
Препараты: 36
Препараты альдегидов и их производных. 40
Химические свойства 40
Методы к.о. 43
Препараты: 43
Препараты алифатических спиртов 49 Препараты простых эфиров 51
Титрование в неводных средах как метод количественного определения: 52
Препараты: 53
Препараты сложных эфиров азотной кислоты 55
Препараты: 55
Препараты карбоновых кислот и их солей 56
Препараты: 57
Препараты алифатических аминокислот. 60
Химические свойства: 61
Общие требования к чистоте: 62
Оптическая изомерия: 62
Методы количественного определения АК. 62
Препараты: 63
Фенолы. 67
Фармацевтическая
химия
Курс лекций
Часть первая
Издание второе, исправленное и дополненное.
- Исправлены ошибки
- Добавлены «Аминокислоты» и «Фенолы»
Created by Aeon
http://spcpa.narod.ru
spcpa@narod.ru
1 Смотри тему "Неводное титрование"
2Смотри тему "Неводное титрование"
|
 Скачать 1.43 Mb.
Скачать 1.43 Mb.