тесты фармхимия. ФАРМХИМИЯ_1. Государственная фармакопея рф
 Скачать 1.43 Mb. Скачать 1.43 Mb.
|
Препараты альдегидов и их производных.Карбонильная группа – плоская, сильно поляризованная (на кислороде "-" ), высокая реакционоспособность. То наркотики, антисептики, токсические вещества. Дополнительное введение галогена увеличивает активность и токсичность. Введение гидроксильной группы уменьшает токсичность и увеличивает способность образования гидратных связей. Cl3C-CO-H + H2O Cl3C-CH(OH)2 хлоралгидрат (мало токсичен). Химические свойства1. ОВР Легко окисляются до кислот. Эффект реакций не зависят от природы альдегида, а зависят от природы окислителя а) с реактивом Толленса. – реакция серебряного зеркала. В кристально чистой пробирке образуется налет серебра. R-CHO + 2[Ag(NH3)2]NO3 + H2O Реактив готовят: К AgNO3 прибавляют концентрированный NH4OH до растворения осадка. При хранении может образовывать аред серебра (взрывчатый). б) с реактивом Фелинга Реактив – смесь равных объемов раствора Фелинга 1 (CuSO4 + следов. H2SO4 – прозрачная жидкость голубоватого цвета) и раствора Фелинга 2 (сеньетова соль – тартрат калия натрия в растворе щелочи). Собственно реактив Фелинга – прозрачная жидкость ярко-синего цвета, комплекс соли меди (нижеприведенная формула – по Ильиной Татьяне Юрьевне; Трусов же Сергей Николаевич представляет себе комплекс меди с калия натрия татртратом несколько иначе – по его мнению, медь связывается по спиртовым гидроксилам только лишь с одной молекулой винной кислоты). 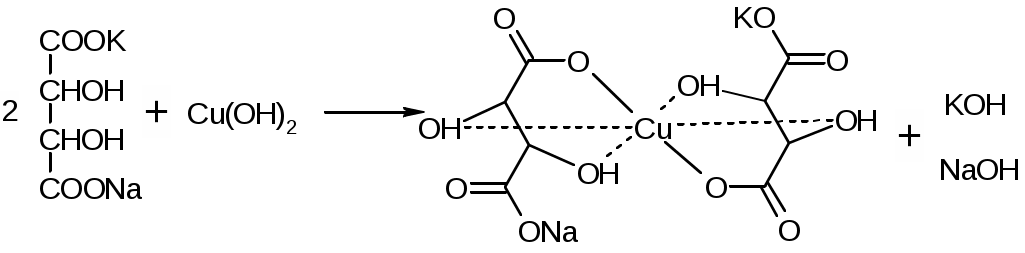 При добавлении альдегида и кипячении на водяной бане, выпадает осадок красно-бурого цвета. Альдегид + комплекс Фелинга + KOH + 3NaOH 2CuOH Cu2O + H2O Гидроксид меди 1 – желтоватого цвета, очень неустойчив и быстро разлагается до кирпично-красного оксида. Реактив Фелинга не реагирует с ароматическими альдегидами, кроме 2,4 дигидроксибензаля. в) с реактивом Несслера. RCHO + K2[HgI4] + 3KOH Hg + RCOOK + 4KI + 2H2O Реакция идет мгновенно с формальдегидом. Кетоны не реагируют. Реакция очень чувствительна, используется для обнаружения примеси альдегида в спиртах, эфирах и для к.о. альдегидов. г) реакция обесцвечивания раствора йода. RCHO + I2 + H2O Реакцию ведут в слабощелочной среде, используют для к.о. альдегида. д) тетразолиевая проба. 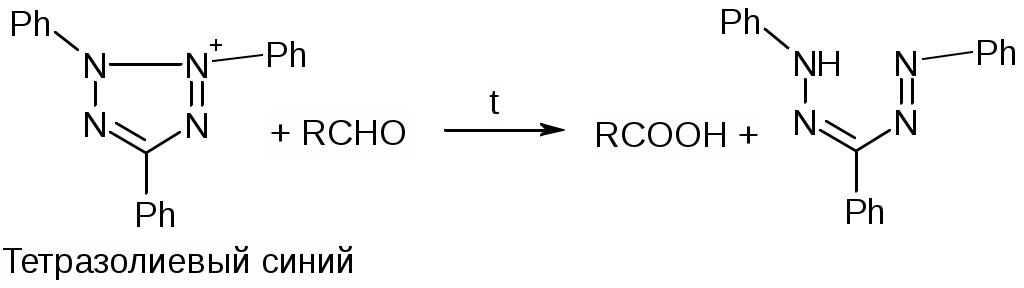 2. Реакции нуклеофильного присоединения. а) с реактивом Шиффа 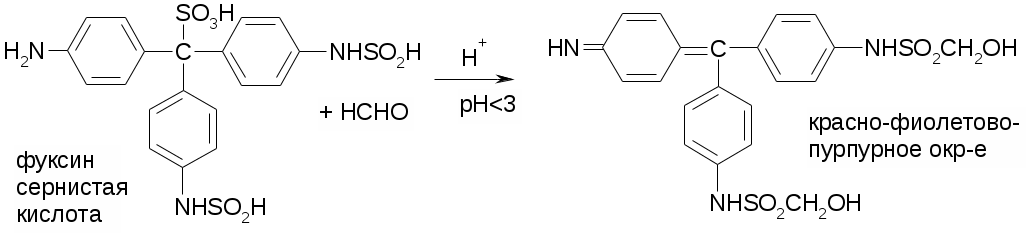 В эту реакцию вступают почти все алифатические альдегиды (кроме хлоралгидрата), некоторые кетоны, ароматические альдегиды. При рН<1 эта реакция специфична для формальдегида. Используют для обнаружения примеси формальдегида и метанола после окисления его до формальдегида б) с азотсодержащими реактивами: R-CHO + NH3 RCH=NH R-CHO + NH2OH R-CHO + NH2-NH2 R-CHO + Ph-NH-NH2 (фенил гидразин) R-CHO + (о,п–NO2)2Ph-NH-NH2 (2,4 динитрофенилгидразин) Применение: Для подлинности, т.к. выпадает кристаллические осадки с четкими температурами плавления. Для к.о. (гравиметрия или тритриметрия). в) Присоединение бисульфита натрия (сульфита натрия). RCHO + NaHSO3 R-CH(OH)-SO3Na При нагревании в кислой среде разрушаются с выделением NaCl, H2O, SO2 Использование: для очистки и разделения смеси альдегидов и метилкетонов. Для количественного определения: RCHO + Na2SO3 R-CH(OH)-SO3Na + NaOH (эквивалентное количество). 3. Реакции конденсации с фенольными соединениями. SE в ядро. а) р. Хичкока. 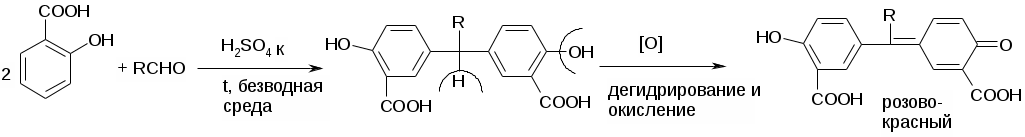 В результате реакции получается ауриновый краситель розово-красного цвета. В случае формальдегида возможно образование триспроизводных трифенилметанового ядра. Реактив Марки – это раствор формаля в концентрированной серной кислоте. б) р. Идрайве. 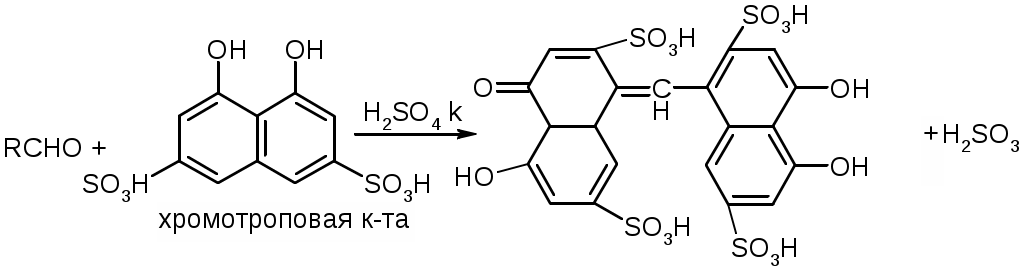 Хромотроповая кислота, она же 1,8-дигидроксинафталин, 3,6-дисульфокислота или ее динатриевая соль. Получается фиолетовое вещество, в случае формаля – пурпурное. 4. Реакция линейной и циклической полимеризации. Используются для получения гексаметилентетрамина и длительном хранении. nHCHO + H2O HCH(OH)2 (HO-CH2-O-CH2-O-)n , -(CH2-O-)n – параформ, белая кристаллическая масса. Физико-химический анализ по карбонильной группе затруднен, т.к. группа – слабый хромофор. ФХМА используются редко. Методы к.о.1. Окислительно-восстановительные (титриметрические). 2. Реакции конденсации (фотометрические методы), гравиметрические методы. Препараты:Solutio Formaldehydi (Formalinum). Формальдегид – водный раствор 37%Описание: бесцветная, прозрачная жидкость со своеобразным острым запахом, смешивается во всех соотношениях с водой и спиртом. В качестве стабилизатора содержит метанол до 1%, он также предотвращает реакцию полимеризации. Получение: 2CH3OH + O2 Подлинность: 1. Реакция серебрянного зеркала (см. химические свойства 1а). 2. C салициловой кислотой (см. химические свойства 3а). Чистота: допустима примесь HCOOH не > 0,2%, ее определяют, титруя щелочью (алкалиметрически) с индикатором ФФ. КО: 1) Обратная йодометрия в щелочной среде. Аликвота + избыток титрованного раствора I2 + щелочь. I2 в щелочной среде диспропорционирует с образованием NaIO, который окисляет HCHO до HCOONa. I2 + 2NaOH NaIO + NaI + H2O побочно: 3NaIO NaIO3 + 2NaI Ставим в темное место, подкисляя H2SO4 HCHO + NaIO + NaOH HCOONa + NaI + H2O NaI + NaIO + H2SO4 I2 + Na2SO4 + H2O Титруем 0,1М Na2S2O3 I2 + Na2S2O3 2NaI + Na2S4O6 f(HCHO) = ½ Параллельно ставим контрольный опыт. Нефармакопейные: 1) С реактивом Несслера – обратная йодометрия по отношению к ртути, избыток йода оттитровываем Na2S2O3. С реактивом Несслера (K2HgI4) образуется свободная ртуть. Hg + I2 HgI2 f= ½ 2) Бисульфитныйметод. HCHO + Na2SO3 HO-CH2-SO3Na•NaOH NaOH + HCl NaCl + H2O Титруют раствором хлороводорода 0,1М. Индикатор – ФФ, до исчезновения розовой окраски. f=1 Параллельно контрольный опыт 3) Окисление перекиси – алкалиметрия в присутствии пергидроля. HCHO + H2O2 + NaOH(изб) Избыток NaOH оттитровываем HCl. Индикатор – ФФ или БТС f=1 Контрольный опыт 4) Гидроксиламиновый HCHO + NH2OH•HCl H2C=N-OH + HCl HCl титруют NaOH. Индикатор БТС. f=1 Расчетная формула без контрольного опыта. 4) Рефрактометрия 5) Спектрофотометрия Применение: Антисептик, дезинфектант Хранение: в склянке оранжевого стекала при температуре не менее 9 С. Рецептура: Если раствор формальдегида, то исходят из фактической концентрации (37%). Если раствор формалина, то 37% раствор принимают за 100% и уже исходя из этого готовят разведение При вдыхании - отравление, слезоточивость, кашель. При употреблении внутрь – тошнота, понос. Chlorali hydras – 2,2,2трихлорэтандиол 1,1. Cl3C-CH(OH)2Описание: бесцветные прозрачные кристаллы с характерным запахом, на воздухе улетучивается, гигроскопичен, легко растворим в воде, спирте, эфире и CHCl3 Подлинность: 1. Гидролиз щелочной при комнатной температуре. Растворяем в воде, добавляем щелочь, взбалтываем. Образуется мутная жидкость с характерным запахом хлороформа. Cl3C-CH(OH)2 + NaOH CHCl3 + HCOONa + H2O 2. С реактивом Толленса. Образуется черный осадок серебра. Мгновенная реакция. Cl3C-CH(OH)2 + [Ag(NH3)2]NO3 Ag + Cl3-C-COOH + NH3 + NH4NO3 Нефармакопейные: 1. Реакция конденсации с фенольными соединениями в щелочной среде. Cl3C-CH(OH)2 + NaOH CHCl3 + HCOONa + H2O CHCl3 + NaOH CCl2 (дихлоркарбен) + NaCl + H2O 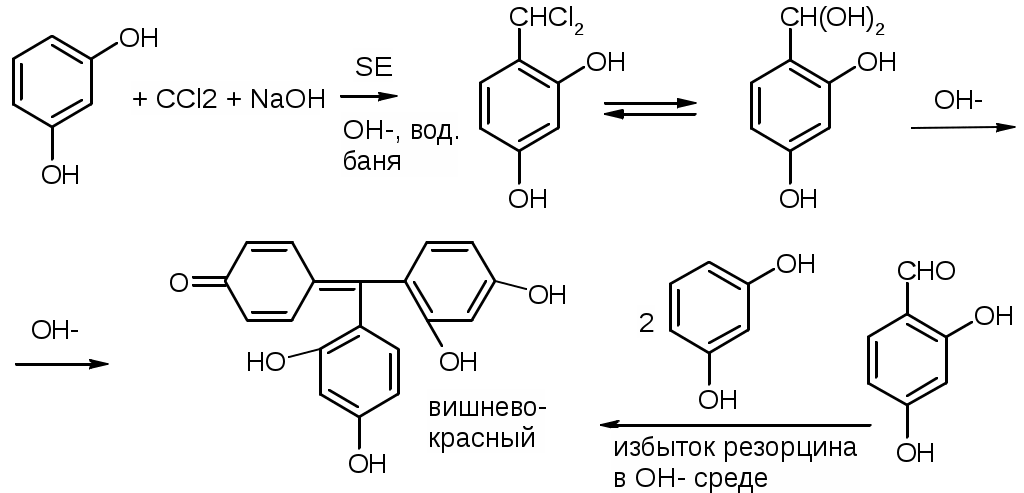 При нагревании с резорцином в щелочной среде. Аналогично - с фенолом и тимолом. Чистота: прозрачность и цветность, кислотность (МО должен быть желтым), органические примеси (обнаруживают по реакции с концентрированной H2SO4). Общедопустимые примеси: хлориды и тяжелые металлы. Специфические недопустимые: хлоральалкоголят (он же моноэтилацеталь хлоральгидрата). Не должно быть осадка и запаха йодоформа при нагревании с йодом в щелочной среде. Йодоформная проба (выпадает желтый кристаллический осадок с характерным запахом): Cl3C-CH(OH)-OC2H5 + NaOH C2H5OH + 4I2 + 6NaOH КО: ОбратнаяАлкалиметрия. Cl3C-CH(OH)2 + NaOH изб CHCl3 + HCOONa После добавления NaOH, ее избыток оттитровывают соляной кислотой. Индикатор ФФ – до исчезновения розовой окраски. f=1 Контрольный опыт. Нефармакопейные: Обратная йодометрия в щелочной среде или среде карбонатного буфера. Аликвота + избыток йода, оттитровывают Na2S2O3 f=1/2 (если окисляется до кислоты) Применение: мягкое успокаивающее, седативное и снотворное, в детской практике. В порошках и клизмах. Противосудорожное. Хранение: по списку Б, в хорошо упакованной таре в темном месте, на свету разлагается с образованием: 2CCl3CHO GlucosumПодлинность: с реактивом Феллинга. Не ГФ: 1) Конденсация с тимолом (с кH2SO4) темно-красное окрашивание.  2) С резорцином (+HCl / H2SO4) (t) розовое, красное окрашивание. 3) Получение озазона глюкозы с фенилгидразоном в кислой среде. Чистота: удельное вращение – правовращающая, в ФС допускается интервал (указ. концентрация раствора, растворитель). Прозрачность, цветность, кислотность, общедопустимые: хлориды, сульфаты, кальций Недопустимые: барий, декстран КО: не проводится. Для инъекций – рефрактометрия. Не ГФ: метод Вильштеттера. Обратная йодометрия. В щелочной или карбонатной среде. + избыток йода, окисляется до … к-ты., Йод оттитровываем Na2S2O3..Международный метод – Na2CO3 вместо щелочи Hexamethylentetraminum (CH2)6N4 – 1,3,5,7 тетраазотрицикло[3,3,1,13,7]-декан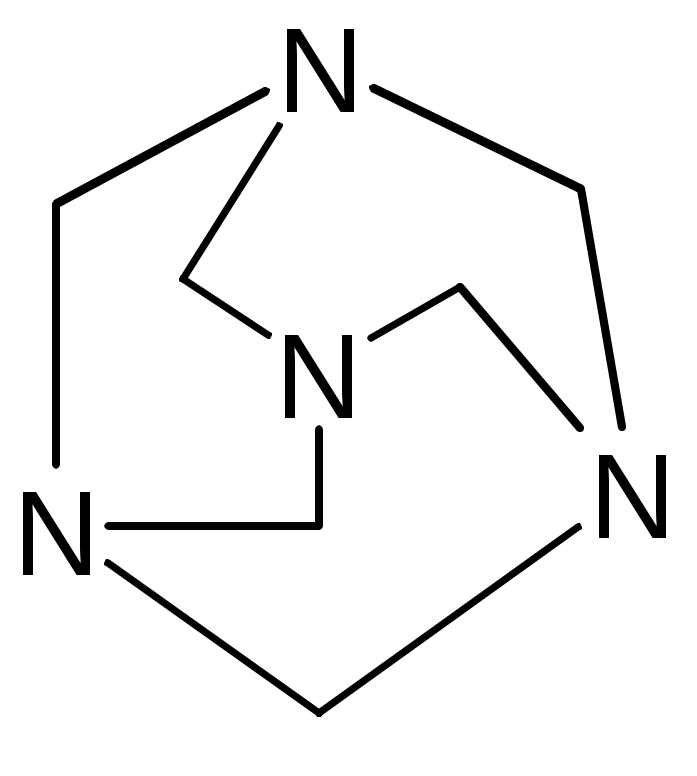 Описание: белый кристаллический порошок без запаха, возгоняем, вкус жгуче сладкий, легко растворим в воде, спирте, растворим в хлороформе, мало растворим в эфире. Подлинность: По новой статье: ИК спектр По ГФ 10 1) Определяют по запаху (CH2)6N4 + H2SO4 + 6H2O 6HCHO(запах) + 2(NH4)2SO4 2) по запаху аммиака и посинению красной лакмусовой бумажки (NH4)2SO4 + 2NaOH (30%) 2NH3 + Na2SO4 НЕ ГФ 1. Обнаружение HCHO – реакция серебрянного зеркала, реакция с ауриновым красителем (розовое окрашивание) и с хромотроповой кислотой (фиолетовое окрашивание) 2. Реакция на третичный азот. С осадительными веществами: с фосфорно-вольфрамовой кислотой бел, амфотерный осадок с фосфорно-молибденовой кислотой желтый осадок с пикриновой кислотой желтый осадок 3. С раствором йода дает полийодид, осадок бурого цвета. (CH2)6N4 + I2 можно использовать эту реакцию для к.о. 4. С бромом образует бледно-желтый осадок, растворимый в избытке реактива. 5. с AgNO3 в нейтральной среде: 2(CH2)6N4 + 3AgNO3 2(CH2)6N4•3AgNO3 белый осадок Чистота: прозрачность, цветность, щелочность, кислотность, рН, органические примеси, общие допустимые (хлориды, сульфаты), недопустимые примеси – соли аммония и параформ (с раствором Несслера не должно быть окрашивания и помутнения раствора). Для инъекций недопустимы амины (реакция с нитропруссидом натрия, или с Несслером в больших концентрациях). Количественное определение: Обратная ацидиметрия. (CH2)6N4 + H2SO4(избыток титр. раствора) + 6H2O 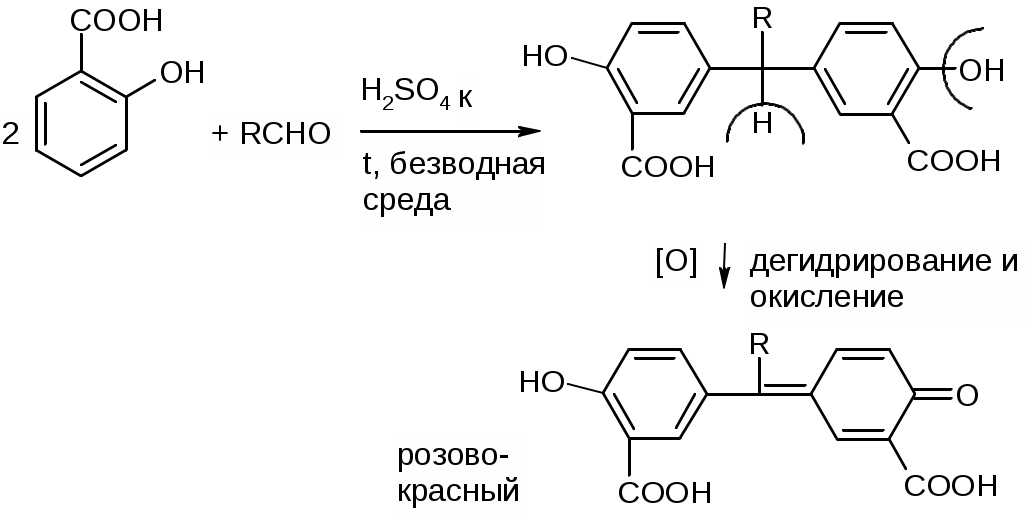 избыток H2SO4 титруем NaOH с индикатором метиленовым Красным. f=1/4 % = T(NaOH/(CH2)6N4) * (Vконтр(NaOH) – Vопыт(NaOH)) * 100/ a Нельзя использовать серную кислоту, т.к. хлорид аммония возгоняется, нельзя использовать ФФ, чтобы не оттитровать (NH4)2SO4 Не ГФ. Прямая ацидиметрия (CH2)6N4 + HCl (CH2)6N4•HCl = [(CH2)6N3NH+]Cl- Протон присоединяется по одной электронной паре. Индикатор – смесь МО и МС. Титруют от зеленой окраски до фиолетовой. f=1 2) Йодометрия (используется редко, т.к. необходим специальный титрованный раствор йода). В результате реакции с йодом образуются перйодиды, которые выпадают в осадок, которые отфильтровывают. Избыток йода титруют тиосульфатом. Если не отфильтровать осадка, он будет разрушаться тиосульфатом. Контрольный опыт. f=1/4 3) Обратная йодхлорметрия (CH2)6N4 ICl (изб. титров. раствора) (CH2)6N4•2ICl комплекс желтого цвета, устойчивый в нейтральной среде. избыток ICl + KI I2 + KCl I2 + Na2S2O3 NaI + Na2S4O6 f=1/4 4) Аргентометрия 2(CH2)6N4 + 3AgNO3 2(CH2)6N4•3AgNO3 белый осадок Определяют: гравиметрически, или титруя избыток нитрата серебра по методу Фаянса Хранение: в хорошо упакованной таре Применение: дезинфицирующее и антисептическое при заболеваниях почек и мочеполовых путей. Принимают внутрь и парентерально. Инъекционные растворы готовят в асептических условиях и не стерилизуют CamphoraНатуральная правовращающая d-camphora получается из камфорного дерева. Синтетическая левовращающая l-camphora из пихтовых. С 1985 г. ФС – испытание рацемической камфоры для инъекционных препаратов. Подлинность – не доказывается. По зарубежным ФС: 1. ИК-спектроскопия 2. УФ спектроскопия спиртового раствора 3. Температура плавления гидразина и оксима камфоры. 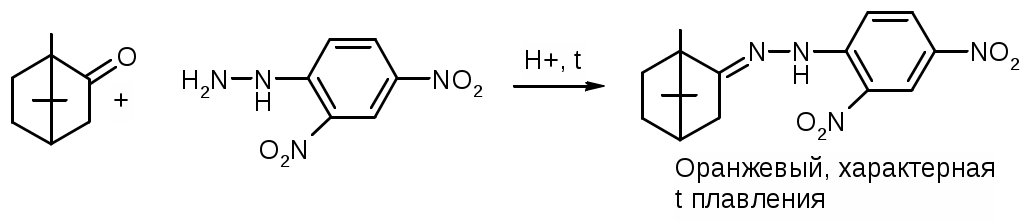 Продукты конденсации с фурфуролом: 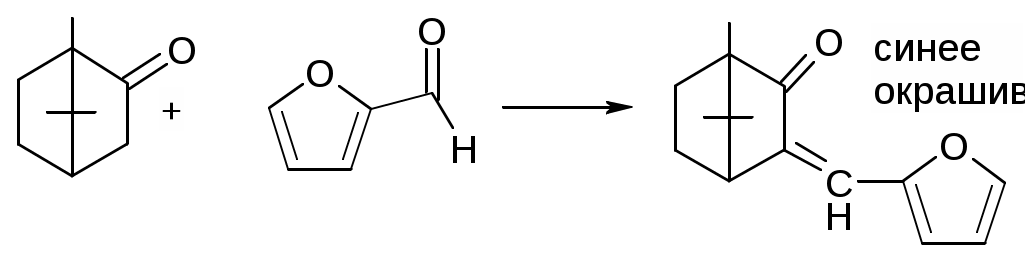 С бензальдегидом дает красное окрашивание. Количественное определение: По ГФ НЕ ТРЕБУЕТСЯ! Хромотография (подлинность, количественное определение, чистота) КО (не ГФ): 1). Гидроксиламиновый (оксимовый). Камфора + NH2OH•HCl Оксим камфоры (вместо =O, =N-OH) + HCl Осадок определяют гравиметрически, или по HCl алкалиметрически (инд БТС, Э=М.м. f=1) 2). Фенилгидразиновый. Камфора + Ph-NH-NH2•HCl Фенилгидразин камфоры (вместо =O, =N-NH-Ph) + HCl Далее все также, как в методе 1. 3). Фотокалориметрия с бензальдегидом. Раствор для инъекций – весовой метод количественного определения. Точную навеску …, охлаждают, взвешивают, по уменьшению массы вычисляют количество камфоры. Применение: наружно – раздражающее CitralumОптически неактивная смесь двух изомеров, запах лимона. В воде не растворим, смешивается со спиртом. 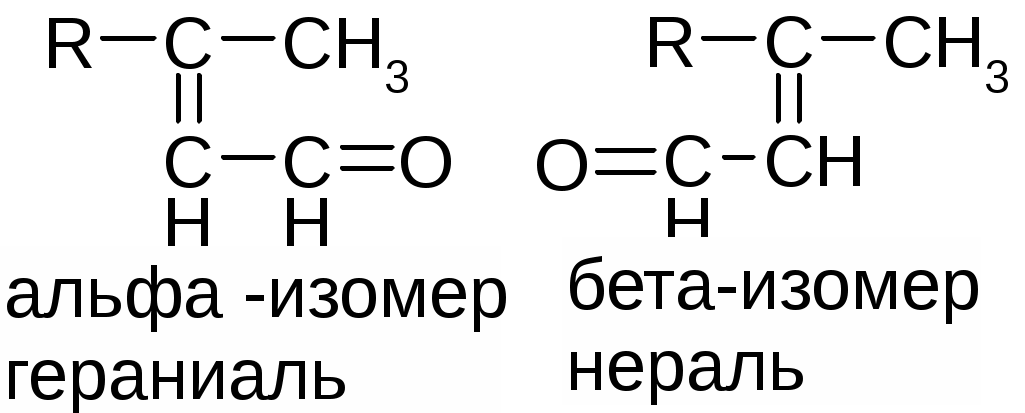 Подлинность: бисульфитное производное => двойная связь, обесцвечивание бромное воды, раствора марганцовки. Реакции, характерные для альдегидов. КО: 1). Оксимный метод. f=1 (см. раньше) 2). Йодхлорметрия f=1/2 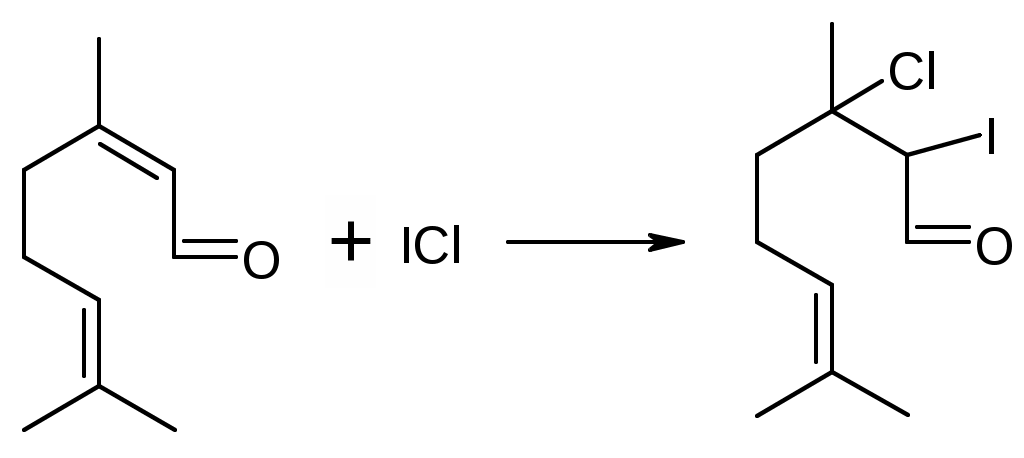 3). Косвенная йодометрия – избыток йода. (контрольный опыт) Применение: антисептик в офтальмологии. Коррелирующее средство в детских микстурах, при гипертонии. |
