Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
§12. Значение периодического закона Д.И. МенделееваПрочитайте слова и словосочетания, переведите их. завершённые электронные слои сила отталкивания незавершённые электронные слои межъядерное расстояние химическая инертность s-элементы энергия ионизации p-элементы энергия сродства к электрону d-элементы эффективный радиус атома f-элементы сила притяжения  Прочитайтетекст1иответьтенавопросысначалаустно,потомписьменно. При сравнении электронных формул элементов с их положением в периодической системе можно сделать следующие выводы: у элементов первого периода не может быть больше двух электронов; у элементов других периодов на последнем уровне не может быть больше восьми электронов; у элементов главных подгрупп число электронов на последнем уровне равно номеру группы; у элементов побочных подгрупп число электронов на последнем уровне равно двум или одному (у хрома, купрума, ниобия, молибдена, рутения, родия, аргентума, платины, аурума – один электрон, у палладия – ноль). У большинства элементов побочных подгрупп сумма электронов на двух последних подуровнях равно номеру группы; элементы, у которых последним заполняется s-подуровень, называются s-элементами, к ним относятся элементы первого периода и элементы главных подгрупп первой и второй групп; элементы, у которых последним заполняется p-подуровень, называются p-элементами, к ним относятся элементы главных подгрупп с третьей по восьмую группу (кроме элементов первого периода); элементы, у которых последним заполняется d-подуровень, называются d-элементами, к ним относятся элементы побочных подгрупп; элементы, у которых последним заполняется f-подуровень, называются f-элементами, к нм относятся лантаноиды и актиноиды, которые находятся внизу периодической системы элементов Д.И. Менделеева; число энергетических уровней у атомов равно номеру периода, в котором находятся атомы данных элементов.  Напишите ответы навопросы.  Сколько электронов может быть на последнем уровне у элементов главных подгрупп? Сколько электронов может быть на последнем уровне у элементов главных подгрупп?Сколько электронов может быть на последнем уровне у элементов побочных подгрупп? Какие элементы называются р-элементами? Какие элементы называются f-элементами? Какие элементы называются s-элементами? Какие элементы называются d-элементами?  Определите количество электронных уровней и количество валентных электронов для следующих химическихэлементов: Магний Mg, купрум Cu, станнум Sn, сульфур S, барий Ba, уран U, силиций Si, бром Br, молибден Mo, кальций Ca, висмут Bi Даны элементы: фосфор, аргон, калий, ванадий, рубидий, кобальт, менделевий, станнум, франций, манган, уран, кюрий. Выпишите отдельно s-, p-, d-, f-элементы.  Прочитайте текст 2 и придумайте к немуназвание. Современная теория строения атома объяснила зависимость химических свойств элемента от строения его атома и положения в периодической системе элементов Д.И. Менделеева. В основе химических реакций лежат процессы перестройки электронных оболочек атома. В химических реакциях участвуют электроны внешних слоёв (валентные электроны = неспаренные электроны). Максимально заполненные орбитали наиболее устойчивые. Электронные уровни, орбитали которых заполнены максимально, называются завершёнными. Атомы инертных газов имеют завершённые внешние электронные уровни, этим объясняется химическая инертность благородных газов. Атомы всех других элементов имеют незавершённые внешние электронные уровни. 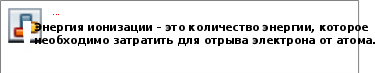 У металлов на внешнем уровне содержится 1, 2 или 3 электрона и они слабо связаны с атомом. В химических реакциях атомы металлов отдают эти электроны. Для сравнения активности металлов используют специальную величину – энергию ионизации I. У металлов на внешнем уровне содержится 1, 2 или 3 электрона и они слабо связаны с атомом. В химических реакциях атомы металлов отдают эти электроны. Для сравнения активности металлов используют специальную величину – энергию ионизации I.Энергию ионизации выражают в килоджоулях на моль (кДж/моль).  У неметаллов на внешнем уровне содержится 4 и более электронов, которые прочно связаны с атомом. В химических реакциях атомы неметаллов обычно присоединяют электроны. Для сравнения неметаллических свойств используют величину – энергию сродства к электрону Е. У неметаллов на внешнем уровне содержится 4 и более электронов, которые прочно связаны с атомом. В химических реакциях атомы неметаллов обычно присоединяют электроны. Для сравнения неметаллических свойств используют величину – энергию сродства к электрону Е.Энергию сродства к электрону также выражают в килоджоулях на моль (кДж/моль). Важным свойством атомов являются их размеры. Определить абсолютные размеры атомов практически невозможно. Можно определить только эффективные радиусы атомов, которые определяются по межъядерным расстояниям в молекулах. Элементы одного периода имеют одинаковое количество электронных уровней. Но по мере увеличения заряда ядра в одном периоде (слева направо) увеличивается сила притяжения электронов к ядру, и это вызывает уменьшение радиуса атомов. У элементов главных подгрупп радиус атомов увеличивается с увеличением порядкового номера элемента (сверху вниз), так как увеличивается количество электронных уровней. У элементов побочных подгрупп с увеличением порядкового номера элемента увеличение радиуса атомов незначительное. Энергия ионизации I характеризует металлические свойства элементов. Чем I ниже, тем сильнее проявляет элемент металлические свойства. В периоде слева направо I увеличивается, поэтому металлические свойства элементов ослабевают, а неметаллические – усиливаются. У элементов одной подгруппы сверху вниз радиус атомов увеличивается, притяжение электронов к ядру ослабевает, I снижается, поэтому металлические свойства усиливаются, а неметаллические – ослабевают. Отсюда следует, что самый активный металл – франций, самый активный неметалл – флуор.  Напишите ответы навопросы. Что лежит в основе химических реакций? Какие орбитали наиболее устойчивые? Что такое энергия ионизации?    Что такое энергия сродства к электрону? Что такое энергия сродства к электрону?Как изменяется радиус атома в периодах и группах? Как изменяются металлические свойства элементов в периодах и группах?  У какого элемента больше выражены: а) металлические свойства; б) неметаллическиесвойства? а) б) Литий ─ Цезий Силиций ─ Карбон Натрий ─ Рубидий Бром ─ Йод Магний ─ Алюминий Фосфор ─ Хлор Кальций ─ Скандий Сульфур ─ Фосфор     Установите соответствие между порядковым номером элемента в ПСХЭ и химическими свойствами его высшегооксида: Установите соответствие между порядковым номером элемента в ПСХЭ и химическими свойствами его высшегооксида: Прочитайте текст 3 и придумайте название для этоготекста. Периодический закон химических элементов оказал большое влияние на последующее развитие химии. Он стал основой для дальнейших исследований. Химия перестала быть описательной наукой. Появилась возможность предсказывать и описывать новые элементы и их соединения. Великий учёный Д.И. Менделеев предсказал существование 13 (тринадцати) новых элементов. Из них три элемента – экабор, экаалюминий и экакремний – были открыты при жизни Д.И. Менделеева. Предсказанные учёным свойства точно совпали со свойствами, которые определили опытным путём (галлий, скандий и германий). На основе периодического закона и периодической системы элементов развилось учение о строении атома. Оно объясняет физический смысл периодического закона и расположение элементов в периодической системе. В таблице Д.И. Менделеева можно обнаружить четыре пары элементов, которые занимают места, не соответствующие их атомным массам. Это аргон (№18, Ar = 39,9) и калий (№19, Ar = 39,1); кобальт (№27, Ar = 58,9) и никель (№28, Ar = 58,7); теллур (№52, Ar = 127,6) и йод (№53, Ar = 126,9); торий (№90, Ar = 232,04) и протактиний (№91, Ar = 231). После выяснения значения порядковых номеров и строения ядра это «нарушение» общей закономерности получило объяснение. Оно связано с наличием изотопов, их различным содержанием. Заряд же ядер (число протонов), который определяет порядковый номер элемента, изменяется строго. Учение о строении атома привело к открытию атомной энергии и использованию её для нужд человечества. Периодический закон помог сформулировать и обосновать такие понятия современной химии, как химическая связь, валентность, электропроводность, он подтвердил наиболее общие законы природы. Периодический закон лежит в основе решения современных задач химической науки производства.  Напишите ответы навопросы. Что произошло с химией как наукой после открытия периодического закона? Какие «ошибки» сделал Д.И. Менделеев? В чём заключается значение периодического закона? ☻Задание для любознательных:Пройдите лабиринт. Go through the maze. Allez dans le labyrinthe.  |
