Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
§11. Строение электронной оболочки атомаПрочитайте слова и словосочетания, переведитеих. пространство положение в пространстве скорость главное квантовое число электронное облако уровень орбиталь орбитальное квантовое число состояние электрона подуровень энергия магнитное квантовое число форма электронного облака спиновое квантовое число наименьшая энергия принцип Паули правило Клечковского правило Хунда  Прочитайте текст и ответьте на вопросы сначала устно, потомписьменно. Электрон может находиться в любой части околоядерного пространства, но вероятность его нахождения в разных частях этого пространства неодинакова.  В этом пространстве электрон находится около 90% (девяноста процентов) времени. Состояние электрона – его энергию, форму электронного облака, положение в пространстве – можно описать при помощи главного, орбитального, магнитного и спинового квантовых чисел.  Главное квантовое число n характеризует энергию электрона и степень его удаления от ядра. Оно может принимать целочисленные значения (n = 1, 2, …, ∞). Электроны с одинаковым значением n образуют энергетический уровень. Главное квантовое число n характеризует энергию электрона и степень его удаления от ядра. Оно может принимать целочисленные значения (n = 1, 2, …, ∞). Электроны с одинаковым значением n образуют энергетический уровень.Орбитальное квантовое число ℓ характеризует форму электронного облака. Оно может принимать целочисленные значения от 0 до n−1. Электроны с одинаковым значением ℓ образуют энергетический подуровень. Число подуровней равно номеру уровня. Магнитное квантовое число mℓхарактеризует положение электронного облака в пространстве. Оно может принимать значения от –ℓ до +ℓ. В общем случае любому значению ℓ соответствует 2ℓ + 1 значений магнитного квантового числа. 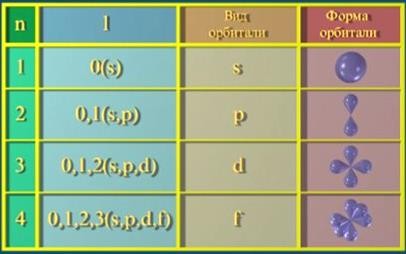 Магнитное спиновое (или просто спиновое) квантовое число ms может принимать только два возможных значения: +1/2 (плюс одна вторая) и –1/2 (минус одна вторая). Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона. Как и любая система, атомы стремятся к минимуму энергии. Это достигается при определённом состоянии электронов, т.е. при определённом распределении электронов по орбиталям. Такое распределение происходит в соответствии с принципом Паули, правилом Хунда, правилом Клечковского. |
| | Австрийско-швейцарский физик. Один из создателей квантовой механики и релятивистской квантовой теории поля. Сформулировал (1925) принцип, который назвали его именем. Включил спин в общий формализм квантовой механики. Предсказал (1930) существование нейтрино. Труды по теории относительности, магнетизму, мезонной теории ядерных сил и др. Нобелевская премия по физике (1945). |
 | Немецкий физик. Работы посвящены квантовой механике, систематике атомных и молекулярных спектров, магнетизму, квантовой химии, истории физики. Принимал участие (1928–1932) в разработке метода молекулярных орбиталей. Сформулировал (1927) правило заполнения атомных орбиталей электронами (правило Хунда). Ввёл представление о π- и σ-электронах и о π- и σ-связях в молекулах. |

 Правило Клечковского:
Правило Клечковского:


По правилу Клечковского, распределение орбиталей по энергии выглядит следующим образом:


Напишите ответы навопросы.
Что такое орбиталь?
Что показывают квантовые числа?
Сформулируйте принцип найменьшей энергии.
Сформулируйте принцип Паули.
Сформулируйте правило Хунда.

Составьте электронные формулы следующихэлементов:
Магний Mg, фосфор P, феррум Fe, хром Cr, хлор Cl, арсен As
Составьте электронно-графические формулы следующихэлементов:
Оксиген O, силиций Si, титан Ti, кальций Ca, манган Mn
Определите элементы, которые имеют электроннуюформулу:
1s22s22p63s23p4 1s22s22p63s23p64s1
1s22s22p63s23p6 1s22s22p63s23p64s13d5 1s22s22p63s23p64s23d10 1s22s22p63s23p64s23d5
Определите элемент, атом которого имеет один неспаренныйэлектрон:
1) Be; 2) N; 3) C; 4) Al.
☻Задание для любознательных:
Отгадайте кроссворд. Guess crossword. Devinez croisés.
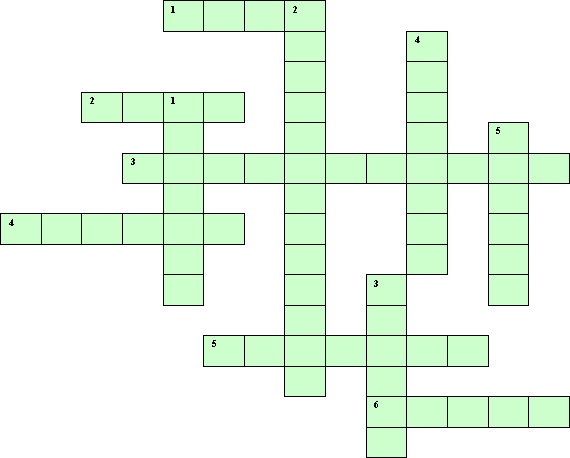 По горизонтали:
По горизонтали:Частица, которая состоит из положительного ядра и отрицательных электронов.
Квантовое число, которое характеризует движение электрона вокруг своей оси.
Химическая связь, которая образуется общими парами электронов при перекрывании орбиталей.
Элементарная частица, которая входит в состав ядра.
Квантовое число, которое определяет размер орбитали.
Ион, который имеет отрицательный заряд.
По вертикали:
Атомы одного элемента с одинаковым зарядом ядра, но разной массой.
Химическая связь, которая образуется между положительно заряженными ионами и обобществленными электронами.
Химическая связь, которая образуется в результате электростатического притяжения между ионами с противоположными зарядами.
Пространство вокруг ядра, в котором находится электрон.
Ион, который имеет положительный заряд.