Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
§13. Ковалентный тип химической связиПрочитайте слова и словосочетания, переведитеих. свободное состояние длина связи инертный газ энергия связи химическая связь направленность валентные электроны насыщаемость ковалентная (атомная) связь полярность кристаллическая решётка незавершённые уровни завершённые уровни перекрывание электронных облаков  Прочитайте текст 1 и ответьте на вопросы сначала устно,потомписьменно.В природе атомы в свободном состоянии встречаются очень редко. Только инертные газы находятся в природе в атомном состоянии. Обычно атомы соединяются друг с другом или с атомами других элементов. При этом образуется большое количество соединений. В каждом соединении между атомами образуется химическая связь. Она образуется в результате движения электронов во взаимодействующих атомах. В этом процессе наибольшую роль играют электроны на внешних энергетических уровнях – наиболее подвижные электроны. Их называют валентными электронами. Электроны внутренних завершённых уровней в образовании химических связей не участвуют. Причина образования химической связи – стремление атомов металлов и неметаллов путём взаимодействия с другими атомами достичь более устойчивой электронной структуры, подобной структуре инертных газов.  74 74Известно, что у атомов на внешнем энергетическом уровне может быть от 1 (одного) до 8 (восьми) электронов. Атомы инертных газов имеют по 8 (восемь) электронов. Атомы других элементов имеют незавершённые энергетические уровни. В процессе химического взаимодействия они завершают их. Это достигается образованием общих электронных пар, присоединением или отдачей электронов.  Различают несколько типов химической связи: ковалентная, ионная, металлическая и водородная. Важными характеристиками ковалентной связи являются: длина связи, энергия, насыщаемость, направленность, полярность связи. Эти характеристики помогают понять свойства веществ.  Напишите ответы навопросы. Что является причиной образования химической связи? Какие электроны играют наиболее важную роль в образовании химической связи? Что такое завершённые и незавершённые энергетические уровни? Какие существуют основные типы химических связей? Какая химическая связь называется ковалентной? Чем характеризуется ковалентная связь?  Прочитайтетекст2иответьтенавопросысначалаустно,потомписьменно. 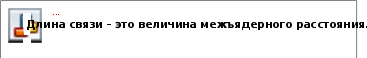 С увеличением длины связь ослабевает.  Энергию связи выражают в килоджоулях на моль. Например, энергия связи Н–Н в молекуле Н2 равна 435 кДж/моль (четыреста тридцать пять килоджоулей на моль), следовательно, при образовании одного моля водорода выделяется 435 кДж/моль. Энергия связи увеличивается с уменьшением длины связи.  Насыщаемость определяется числом орбиталей атома, использование которых для образования химических связей энергетически выгодно. Например, элементы второго периода, у атомов которых внешний энергетический уровень состоит только из четырёх орбиталей (одна s- и три p- типа), могут образовывать не более четырёх ковалентных связей.  Так как орбитали имеют различную симметрию, их взаимное перекрывание может осуществляться разными способами, чем и определяется пространственная направленность ковалентных связей. Так как орбитали имеют различную симметрию, их взаимное перекрывание может осуществляться разными способами, чем и определяется пространственная направленность ковалентных связей. Данное свойство ковалентной связи определяет пространственную структуру молекул. Данное свойство ковалентной связи определяет пространственную структуру молекул.Если общие пары электронов располагаются симметрично относительно обоих ядер, то такая ковалентная связь называется неполярной. В молекулах простых веществ – водорода H2, кислорода O2, хлора Cl2 – атомы соединяются неполярной ковалентной связью.Если общие электронные пары располагаются несимметрично относительно ядер взаимодействующих атомов и сдвигаются к одному из них, то такая ковалентная связь называется полярной. Связь в молекулах воды H2O, аммиака NH3, хлорида водорода HCl полярная ковалентная.  Для оценки способности атома данного элемента притягивать к себе общую пару электронов пользуются величиной электроотрицательности. Определение электроотрицательности дал американский учёный Лайнус Полинг в 1932 (тысяча девятьсот тридцать втором) году. Для оценки способности атома данного элемента притягивать к себе общую пару электронов пользуются величиной электроотрицательности. Определение электроотрицательности дал американский учёный Лайнус Полинг в 1932 (тысяча девятьсот тридцать втором) году.Электроотрицательность имеет размерность энергии. Однако пользоваться её абсолютными значениями неудобно.  Если принять электроотрицательность лития за единицу и сравнить с ней электроотрицательность других элементов, то получаются простые и удобные для сравнения значения относительной электроотрицательности элементов. Если принять электроотрицательность лития за единицу и сравнить с ней электроотрицательность других элементов, то получаются простые и удобные для сравнения значения относительной электроотрицательности элементов.
Вещества с ковалентной связью имеют очень высокие температуры плавления. Они имеют прочные кристаллические решётки.  Эти вещества твёрдые, практически не растворяются в воде. Например, алмаз, кремний, кварц.  Напишите ответы навопросы. Что называется длиной связи? Что такое энергия связи? Чем определяется насыщаемость связи? Что определяет пространственную структуру молекул? Какая характеристика связи определяется распределением электронного облака вдоль оси связи? Что такое электроотрицательность? Что называется кристаллической решёткой? Какие свойства характерны для веществ с ковалентным типом связи? ☻Задание для любознательных:а) Выберите химические элементы I группы; Select the chemical elements in group I; a) Sélectionnez les éléments chimiques du groupeI: Al, K, Cl, Na, Mg, Li, S, Si, Rb, Ag, P, Ar,Cs, Cu, Fr, Fe, H, Au, Ca, Zn б) выберите химические элементы 3-го периода; select chemicals third period; b) sélection les produits chimiques troisièmepériode: Al, K, Cl, Na, Mg, Li, S, Si, Rb, Ag, P, Ar,Cs, Cu, Fr, Fe, H, Au, Ca, Zn с) выберите химические элементы с постоянной валентностью; select the chemical elements with constantvalence; c) choisir les éléments chimiques avec constant: Al, K, Cl, Na, Mg, Li, S, Si, Rb, Ag, P, Ar,Cs, Cu, Fr, Fe, H, Au, Ca, Zn §14. Ионный, металлический и водородный типы химической связи Прочитайте словосочетания, переведитеих. ионная связь обобществлённые электроны металлическая связь электронный газ водородная связь электронная теория  Прочитайте текст 1 и придумайте название длянего.  Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются ионами. Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются ионами.При образовании ионной связи атомы приобретают устойчивую электронную конфигурацию атома благородного газа и превращаются в заряженные частицы – ионы, двумя путями: Отдачей электронов с внешнего уровня. Принятием электронов на внешний уровень. Частица, которая отдаёт электроны, превращается в положительный ион и называется катион. Частица, которая принимает электроны, превращается в отрицательный ион – анион. Ионная связь возникает между металлом и неметаллом. Соединения, которые образуются из ионов, называются ионными. Такие соединения при обычных условиях представляют собой твёрдые кристаллические вещества с высокими температурами плавления и кипения, хрупкие, растворимые, нелетучие. Это объясняется сильным электростатическим притяжением ионов в кристаллах. Кристаллы очень прочные и разрушаются лишь при высоких температурах. Их водные растворы хорошо проводят электрический ток. Например, поваренная соль, основания.  Напишите ответы навопросы. Какая связь называется ионной? Что такое катион? Что такое анион? Между какими элементами возникает ионная связь? Какими свойствами характеризуются вещества с ионным типом связи? Укажите формулу вещества, в котором образуется и ионный, и ковалентный типысвязи: O2 (NH4)2SO4 NaCl HNO3  Прочитайте текст 2 и ответьте на вопросы сначала устно,потомписьменно.В атомах металлов валентных электронов намного меньше, чем свободных орбиталей. Это создаёт условия для свободного перемещения электронов по орбиталям разных атомов одного и того же металла.  Электроны в металле утрачивают связь с отдельными атомами. Электроны как бы становятся одновременно общими для всех атомов, образуют “электронный газ”. Такие вещества пластичные, электро- и теплопроводные с металлическим блеском.  Химические связи возникают не только между атомами, но и между молекулами. Химические связи возникают не только между атомами, но и между молекулами.Такими элементами являются флуор F, оксиген O, нитроген N, реже хлор Cl и сульфур S. В такой молекуле общая электронная пара от гидрогена сильно смещена к атому электро-отрицательного элемента. Положительный заряд концентрируется в малом объёме, поэтому протон взаимодействует с неподелённой парой другого атома или иона и обобществляет её. В результате образуется вторая, более слабая связь. Водородная связь оказывает влияние на свойства многих веществ, на прочность молекул. Электронная теория строения атома объясняет, как атомы объединяются в молекулы, природу и механизм образования химической связи.  Напишите ответы навопросы. Назовите условия для свободного перемещения электронов по орбиталям разных атомов одного и того же металла. Что такое металлическая связь? Назовите физические свойства веществ с металлическим типом связи. Какая связь образуется между молекулами, в состав которых входит гидроген и сильно электроотрицательный элемент? С помощью чего объясняется природа и механизм образования химической связи?  Укажите: 1) элемент, атом которого не образуетсоединений; тип кристаллической решётки поваренной солиNaCl. Au, He, H, Hg; атомная, молекулярная, ионная, металлическая. Напишите электронные и структурные формулымолекул: HBr Br2 CH4 I2 Укажите формулу вещества, между молекулами которого возможно образование водороднойсвязи: CH4 Al2O3 HF H2 Определите тип химической связи в предложенных веществах и обведите в таблице соответствующие цифры, затем сложите обведённыецифры. (Если сумма равна порядковому номеру цезия, задание выполнено правильно).
☻Задание для любознательных:Напишите названия химических элементов. Write the names of the chemical elements. Écrivez les noms des éléments chimiques.   |

