Химия контрольные задания для студентовзаочников всех специальностей
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
Примеры решения задачПример 1. Объясните механизм образования молекулы SiF6 и иона [SiF6]2- Решение. Приводим электронную формулу атома кремния: 14Si-1s2 2s2 2p6 3s2 3p2 Приводим графическую схему распределения электронов по энергетическим ячейкам в: а) невозбужденном состоянии 3s 3p 3d             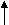 14Si -… 14Si -…              3s 3p 3d 3s 3p 3d б) при возбуждении 14Si* - … Четыре неспаренных электрона возбужденного атома кремния могут участвовать в образовании четырех ковалентных связей с атомами фтора (9F – 1s2 2s2 2p5), имеющему по одному неспаренному электрону с образованием молекулы. Для образования иона [SiF6]4- к молекуле SiF4 присоединяются два иона F- (1s2 2s2 2p6), все валентные электроны которых спарены. Связь осуществляется по донорно-акцепторному механизму за счет пары электронов каждого из фторид-ионов и двух валентных 3d-орбиталей атома кремния. Пример 2. Представьте электронную конфигурацию молекулы О2 по методу МО. Решение. Представим электронную конфигурацию молекулы О2 по методу МО: Электронная формула атома кислорода: 8O – 1s22s22p2x2p1y2p1z . Размещение электронов по молекулярным орбиталям: 2O (1s22s22px22p1y2p1z) = = O2{( σ св 1s)2(σразр 1s)2(σсв 2s)2(σразр 2s)2 (σ св 2px )2(πcв 2py)2(πcв 2pz)2(πразр2py)1(πразр 2pz)1} Определим порядок связи: Псв.= 10 – 6 / 2 = 4/2 = 2 В молекуле кислорода две кратные ковалентные химические связи: O = O Парамагнетизм молекулы кислорода объясняется тем, что на разрыхляющих π- молекулярных орбиталях содержится по одному неспаренному электрону. Контрольные задания 61. Что называется кратностью связи? Приведите примеры соединений, содержащих ординарные, двойные и тройные связи. Отметьте - и -связи в структурных формулах приведенных молекул. 62. Охарактеризуйте типы кристаллических структур по природе частиц узлов решеток. Какие кристаллические структуры имеют: CO2, CH3COOH, алмаз, графит, NaCl, Zn? Расположите их по порядку возрастания энергий кристаллических решеток. Что такое интеркалирование? 63. Почему существует молекула PCl5, но не существует молекула NCl5, хотя азот и фосфор находятся в одной и той же подгруппе VA периодической системы? Какой тип связи между атомами фосфора и хлора? Укажите тип гибридизации атома фосфора в молекуле PCl5. 64. Какая химическая связь называется ионной? Каков механизм ее образования? Какие свойства ионной связи отличают ее от ковалентной? Приведите примеры молекул с типично ионными связями и укажите тип кристаллической решетки. Составьте изоэлектронный ряд ксенона. 65. Согласно теории кристаллического поля определите, какой из ионов (CN- или H2O) влияет сильнее на энергию расщепления 3d-подуровня. Объясните образование комплексных ионов: низкоспинового [Fe(CN)6]4- и высокоспинового [Fe(H2O)6]2+ на основании теории кристаллического поля. 66. Приведите электронную конфигурацию молекулы NO по методу МО. Как изменяются магнитные свойства и прочность связи при переходе от молекулы NO к молекулярному иону NO+? 67. Какая связь называется - и какая - -связью? Какая из них менее прочная и более реакционноспособная? Изобразите структурные формулы этана C2H6, этилена C2H4 и ацетилена C2H2. Отметьте - и -связи на структурных схемах углеводородов. 68. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H2O, HBr, Ar, N2, NH3? 69. Какой тип гибридизации в молекулах CCl4, H2O, NH3 ? Изобразите в виде схем взаимное расположение гибридных облаков и углы между ними. 70. Приведите две схемы заполнения МО при образовании донорно-акцепторной связи в системах с атомными заселениями: а) электронная пара – свободная орбиталь (2+0) и б) электронная пара – электрон (2+1). Определите порядок связи, сравните энергии связей. Какая из рассмотренных связей участвует в образовании иона аммония [NH4]+? 71. Приведите четыре примера молекул и ионов с делокализованными связями. Изобразите их структурные формулы. 72. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа ABn, если связь в них образуется за счет sp-, sp2-, sp3- гибридизации орбиталей атома A ? Приведите примеры молекул с указанными типами гибридизации. 73. На основании положений зонной теории кристаллов охарактеризуйте металлы, проводники и диэлектрики. От чего зависит ширина запрещенной зоны? Какие примеси нужно добавить к кремнию, чтобы превратить его в: а) n-полупроводник; б) р-полупроводник? 74. Приведите две схемы заполнения МО при взаимодействии двух АО с заселениями: а) электрон + электрон (1+1) и б) электрон + вакантная орбиталь (1+0). Определите ковалентность каждого атома и порядок связи. В каких пределах энергия связи? Какие из указанных связей в молекуле водорода H2 и молекулярном ионе 75. На основании строения атомов в нормальном и возбужденном состояниях определите ковалетность бериллия и углерода в молекулах BeCl2, (BeCl2)n, CO и CO2. Изобразите структурные формулы молекул. 76. Что такое дипольный момент? Как он изменяется в ряду сходно построенных молекул: HCl, HBr, HJ? Какой тип связи осуществляется между атомами водорода, хлора, брома и йода в приведенных молекулах? - или -связи в этих молекулах? 77. На основании строения атомов в нормальном и возбужденном состояниях определите ковалентность лития и бора в соединениях: Li2Cl2, LiF, [BF4]-, BF3. 78. Приведите электронную конфигурацию молекулы азота по методу МО. Докажите, почему молекула азота обладает большой энергией диссоциации. 79. Какая химическая связь называется координационной или донорно-акцепторной? Разберите строение комплекса [Zn(NH3)4]2+. Укажите донор и акцептор. Как метод валентных связей (ВС) объясняет тетраэдрическое строение этого иона? 80. Какая химическая связь называется водородной? Приведите три примера соединений с водородной связью. Изобразите структурные формулы приведенных ассоциатов. Как влияет образование водородной связи на свойства веществ (вязкость, температуры кипения и плавления, теплоты плавления и парообразования, диэлектрическую постоянную)? ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ Введение Науку о взаимных превращениях различных видов энергии называют термодинамикой. При химических реакциях происходят глубокие качественные и количественные изменения в системах: рвутся связи в исходных веществах, возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а поглощением теплоты - эндотермическими. С помощью энергетики химических процессов решают многие научные и технологические задачи, например, определения: - условий протекания реакций; - энергий кристаллических решёток; - теплот и температур сгорания; - теплотворной способности веществ; - термической устойчивости веществ - и др. При любом процессе соблюдается закон сохранения энергии, как проявление более общего закона природы – закона сохранения материи. Согласно первому закону химической термодинамики теплота Q, поглощённая системой, идет на изменения ее внутренней энергии ΔU и на совершение работы A: Q = ΔU + A Внутренняя энергия системы U – это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебанийатомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия – полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии Uвеществ не известно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, то есть ее изменение определяется начальным и конечным состояниями системы: ΔU = U2 – U1 А – работа против внешнего давления, в первом приближении А = PΔV, где ΔV – изменение объема системы: ΔV = V2 – V1 Большинство химических реакций протекают в изобарно- изотермических условиях: Р = Const и T = Const, поэтому: QP,T = ΔU + PΔV; QP,T = (U2 – U1) + p (V2 – V1), QP,T= (U2 + pV2) – (U1 + pV1), гдеU + pV обозначим через Н Величину Н называют энтальпией. Таким образом, теплота QP,T при Р = constи Т = const приобретает свойство функции состояния: ее изменение не зависит от пути, по которому протекает процесс. Отсюда QP,T реакции в изобарно-изотермическом процессеравна изменению энтальпии системы ΔН (если единственным видом работы является работа расширения): Qp,Т = ΔН Энтальпия, как и внутренняя энергия, является функцией состояния: ее изменение ΔН определяется только начальным и конечным состояниями системы и не зависит от пути перехода. Теплота химического процесса в изобарно-изотермических условиях называется тепловым эффектам химической реакции. Термохимические расчеты основаны на законе Г.И. Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода. Часто в термохимических расчетах применяют следствие закона Г.И. Гесса: тепловой эффект реакции (ΔНх.р.) равен сумме теплот образования ΔНобр. продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции: ΔНх.р. = ΣΔНпрод.- ΣΔНисх в-в. |
