Химия контрольные задания для студентовзаочников всех специальностей
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
х = [H+] = 1,7.10-3Вычислим значение рН:рН = -lg[H+] = - lg 1,7.10-3= - (lg1,7 + lg10-3) = 2,8 Контрольные задания 181. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdCl2 и K2S; б) КНSiО3 и НСl. Чему равна концентрация каждого иона в насыщенном растворе Ag3PO4? Произведение растворимости (ПР) равно 1,310-20. Ответ: 2,63.10-4;7.9.10-4 182. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Cu2+ + CO32- = CuCO3↓; б) 2Н+ + 2NO2- = NO↑ + NO2↑ + H2O. Исходя из значения произведения растворимости PbСО3, вычислите массу соли, содержащуюся в 100 мл насыщенного раствора. Произведение растворимости равно 7,510-14. Ответ: 0,0072 мг 183. Какое из веществ (KHCO3, CdSO4 или K3PO4) будет взаимодействовать с KOH? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. В растворе HIO концентрации 0,1 М степень диссоциации равна 0,05%. При какой концентрации раствора степень диссоциации увеличится в два раза? Ответ: 0.025 М 184. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) KHCO3 и H2SO4; б) MgSO4 и Na3PO4. Рассчитать концентрацию ионов СlО- в растворе, 1 л которого содержит 0,1 моля хлорноватистой кислоты НСlО и 0,02 моля соляной кислоты HCl, если последняя диссоциирует полностью. Ответ: 1,5.10-7 185. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) 3Bа2+ + 2РО43- = Bа3(РО4)2↓; б) NH4+ + OH- = NH4OH. Чему равна растворимость MnS в моль/л и г/моль? Произведение растворимости равно 2,510-10. Ответ: 1,58.10-5 моль/л;1,37.10-3 г/л 186. Какое из веществ: Zn(ОН)2, CuSO4 или K2CrO4 будет взаимодействовать с КОН? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. В насыщенном растворе фторида стронция концентрация ионов F- равна 1,110-3 моль/л. Вычислите концентрацию ионов Sr2+ в этом растворе. Произведение растворимости равно 2,510-9. Ответ: 2,1.10-3 моль/л 187. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K3BO3 и HNO3; б) K3PO4 и CaCl2. Сколько граммов NaОН находится в состоянии полной диссоциации в 5 л раствора, рН которого равен 12? Ответ: 2 г 188. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) SO32- + 2H+ = H2O + SO2↑; б) Hg2+ + 4Br- = [HgBr4]2-. Вычислите рН 0,1 М раствора NH4OH. Ответ: 11,12 189. Какое из веществ: KHCO3, Cu(NO3)2 или Ca(OH)2 будет взаимодействовать с HCl? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. Вычислите степень диссоциации синильной кислоты HCN, если в 200 мл раствора ее содержится 5,4 г синильной кислоты. Ответ: 2,24.10-5 190. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) AgNO3 и ВаСl2; б) MnCl2 и NH4OH. Вычислите концентрации всех ионов в 0,1 м. растворе NaCl, K2SO4, Na3PO4, если степень диссоциации равна 90%. Ответ: 0,09 М; 0,18 М, 0,09 М; 0,27 М, 0,09 М 191. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Cd2+ + 4NH4OH = [Cd(NH3)4]2+ + 4 H2O; б) СО32- + 2H+ = CO2↑ + H2O. Растворимость BaCrO4 равна 2,35 мг на 1 л. Вычислите ПР этой соли. Ответ: 10-10 192. Какое из веществ: Na2CO3, BaCl2 или Cu(NO3)2 будет взаимодействовать с H2SO4? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. При какой концентрации раствора степень диссоциации фтористоводородной кислоты будет равна 8%? Ответ: 0,097 моль/л 193. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) ZnCl2 и Na2CO3; б) NaNO2 и H2SO4. Вычислите концентрацию ионов СN- в растворе, 1 л которого содержит 0,2 моль НCN и 0,1 моль HCl, считая диссоциацию HCl полной. Ответ: 10-9 194. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а)Pb2+ + 2IO3- = PbIO3↓; б) NH4OH + H+ = NH4+ + H2O. Насыщенный раствор PbI2 объемом 2 л содержит в виде ионов 0,058 г свинца. Вычислите ПР этой соли. Ответ: 1,1.10-11 195. Какое вещество: ZnSO4, ZnCl2 или К2СrO4 будет взаимодействовать с Pb(NO3)2? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. Вычислите концентрацию ионов Н+ в 0,001 М растворе НСl и HCN. Чему равны рН этих растворов? Ответ: 3; 4,15 196. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CH3COOLi и H2SO4; б) Na2S и CoSO4. Насыщенный раствор CаF2 объемом 10 л содержит 0,168 г соли. Вычислите ПР этой соли. Ответ: 4,1.10-11 197. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Mg2+ + 2OH- = Mg(OH)2↓; б) Н+ + НСОО- = НСООН. Вычислите концентрации ионов Ni2+ и S2- в насыщенном растворе NiS. Произведение растворимости равно 210-26. Ответ: 1,4.10-13 198. Какое вещество: H2SO4, Mg(NO3)2 или Na2CO3 будет взаимодействовать с K2SiO3? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. Во сколько раз уменьшится концентрация ионов водорода, если к 1 л 0,01 М раствора синильной кислоты добавить 0, 01 моль цианида натрия NaСN? Ответ: в 4500 раз 199. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) HCOONa и H2SO4; б) Bi(NO3)3 и K3PO4. Степень диссоциации слабой одноосновной кислоты в 0,01 н. растворе равна 6%. Вычислите рН раствора этой кислоты. Ответ: 3,22 200. Составьте молекулярные уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Сr3+ + 4OH- = [Cr(OH)4]-; б) 2Ag+ + CO32- = Ag2CO3↓. Вычислите рН 1%-ного раствора синильной кислоты НCN. Плотность раствора принять равной 1. Ответ: 4,87 ГИДРОЛИЗ СОЛЕЙ Примеры решения задач Пример 1. Записать уравнение гидролиза солей: KCl, Na2CO3, Mn(NO3)2, CH3COONH4. Какое значение рН ( >7, < 7 или ≈7) имеют растворы этих солей? Решение. 1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются, рН водного раствора =7. 2. Карбонат натрия Na2CO3 - соль, образованная сильным основанием NaOH и слабой кислотой H2CO3. Такие соли подвергаются гидролизу по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом: СО32- + Н2О ↔ НСО3- + ОН- Поскольку при гидролизе в свободном виде образуются ионы гидроксила, водный раствор данной соли имеет щелочную среду (рН>7). Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы Na+ , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают: 2 Na+ + СО32- + Н2О ↔ НСО3- + ОН- + 2Na+ Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза: Na2СО3 + Н2О ↔ NaНСО3 + NaОН В результате гидролиза образуется кислая соль NaНСО3. 3. Нитрат марганца Mn(NO3)2 - соль, образованная слабым основанием Mn(OH)2 и сильной кислотой HNO3. Такие соли подвергаются гидролизу по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом: Mn2+ + H2O ↔MnOH+ + H+ Поскольку при гидролизе в свободном виде образуются ионы водорода, водный раствор данной соли имеет кислую среду (рН< 7). Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы NО3- , которые присутствуют в реакционной смеси, но участия в гидролизе не принимают: 2NО3- Mn2+ + H2O ↔MnOH+ + H+ + 2NО3- Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза: Mn(NO3)2 + H2O ↔MnOHNО3 + HNО3 В результате гидролиза образуется основная соль MnOHNО3. 4. Ацетат аммония CH3COONH4 - соль, образованная слабым основанием NН4OH и слабой уксусной кислотой CH3COOH. Такие соли подвергаются гидролизу одновременно по катиону и по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом: NH4+ + CH3COO- + H2O ↔ NH4OH + CH3COOH Поскольку при гидролизе в свободном виде не образуются ни ионы водорода, ни ионы гидроксила водный раствор данной соли имеет близкую к нейтральной среду (рН≈7). Уравнение гидролиза в молекулярной форме имеет вид: CH3COONH4 + H2O ↔ NH4OH + CH3COOH Пример 2. Чему равна степень гидролиза h и значение рН сульфита натрия в растворе концентрации 0,1 моль/л? Решение. Na2SО3 - соль, образованная сильным основанием NaOH и слабой кислотой H2SО3. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом: SО32- + Н2О ↔ НSО3- + ОН- х х Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле: 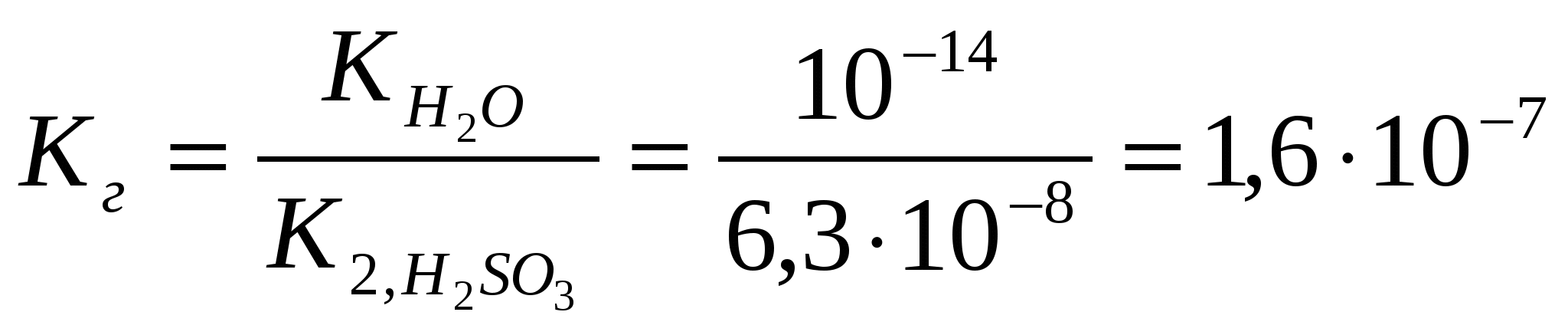 В соответствии с уравнением реакции 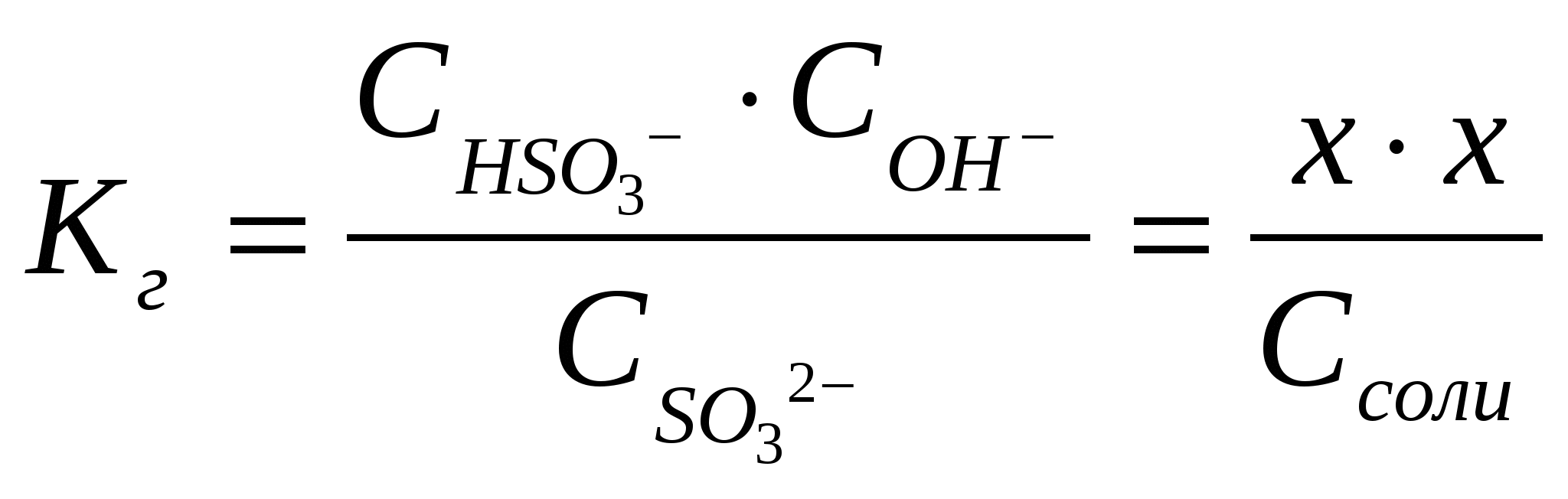 ; отсюда ; отсюда Степень гидролиза h показывает долю прогидролизовавшихся молекул и рассчитывается по формуле: 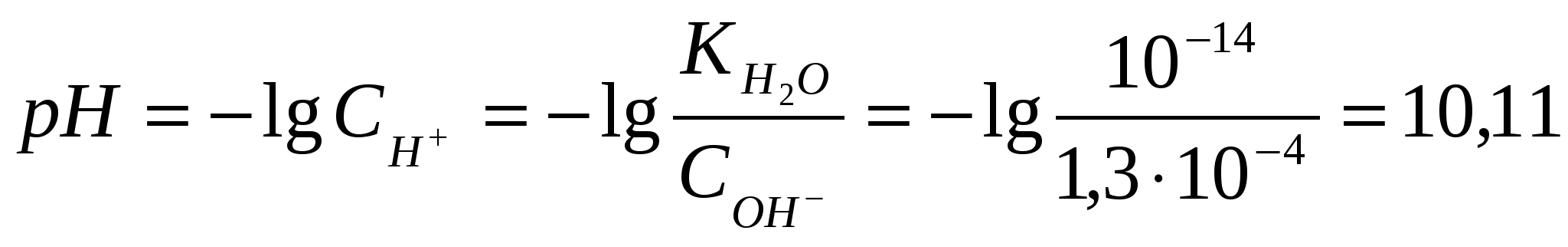 Пример 3. Вычислите константу гидролиза и степeнь гидролиза раствора сульфата хрома Cr2(SO4)3, рН которого равен 3. Решение. Cr2(SO4)3 - соль, образованная слабым основанием Cr(OH)3 и сильной кислотой H2SО4. Гидролиз протекает по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом: Cr3+ + H2O ↔ CrOH2+ + H+ Х Х Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле: 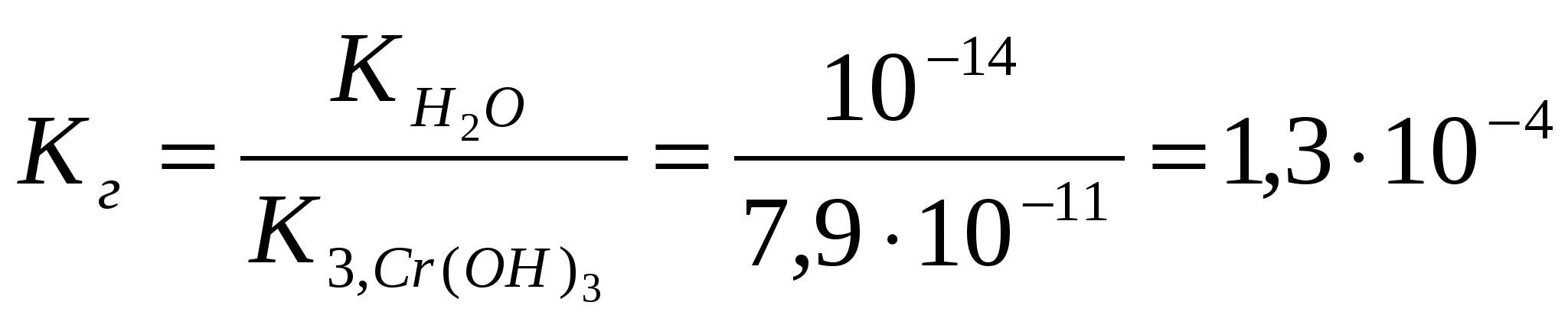 Вычислим концентрацию ионов водорода, исходя из значения рН = -lg Пример 4. Вычислите константу диссоциации селенистоводородной кислоты Н2Se, если рН 0,05 М раствора Na2Se, равен 11,85. Решение. Na2Sе - соль, образованная сильным основанием NaOH и слабой кислотой H2Sе. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом: Sе2- + Н2О ↔ НSе- + ОН- х х Вычислим концентрацию ионов водорода, исходя из значения рН = -lg 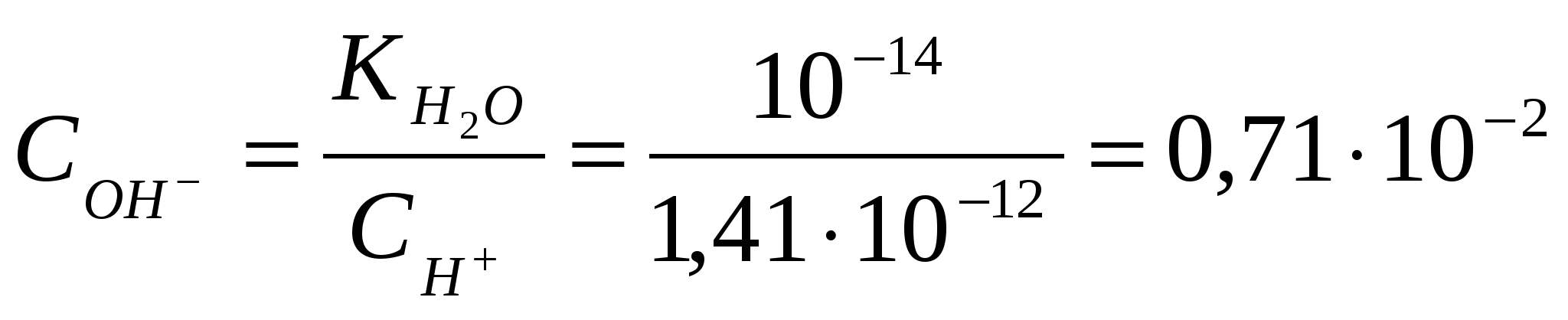 . В соответствии с уравнением реакции . В соответствии с уравнением реакции Константа гидролиза Кг рассчитывается по формуле: 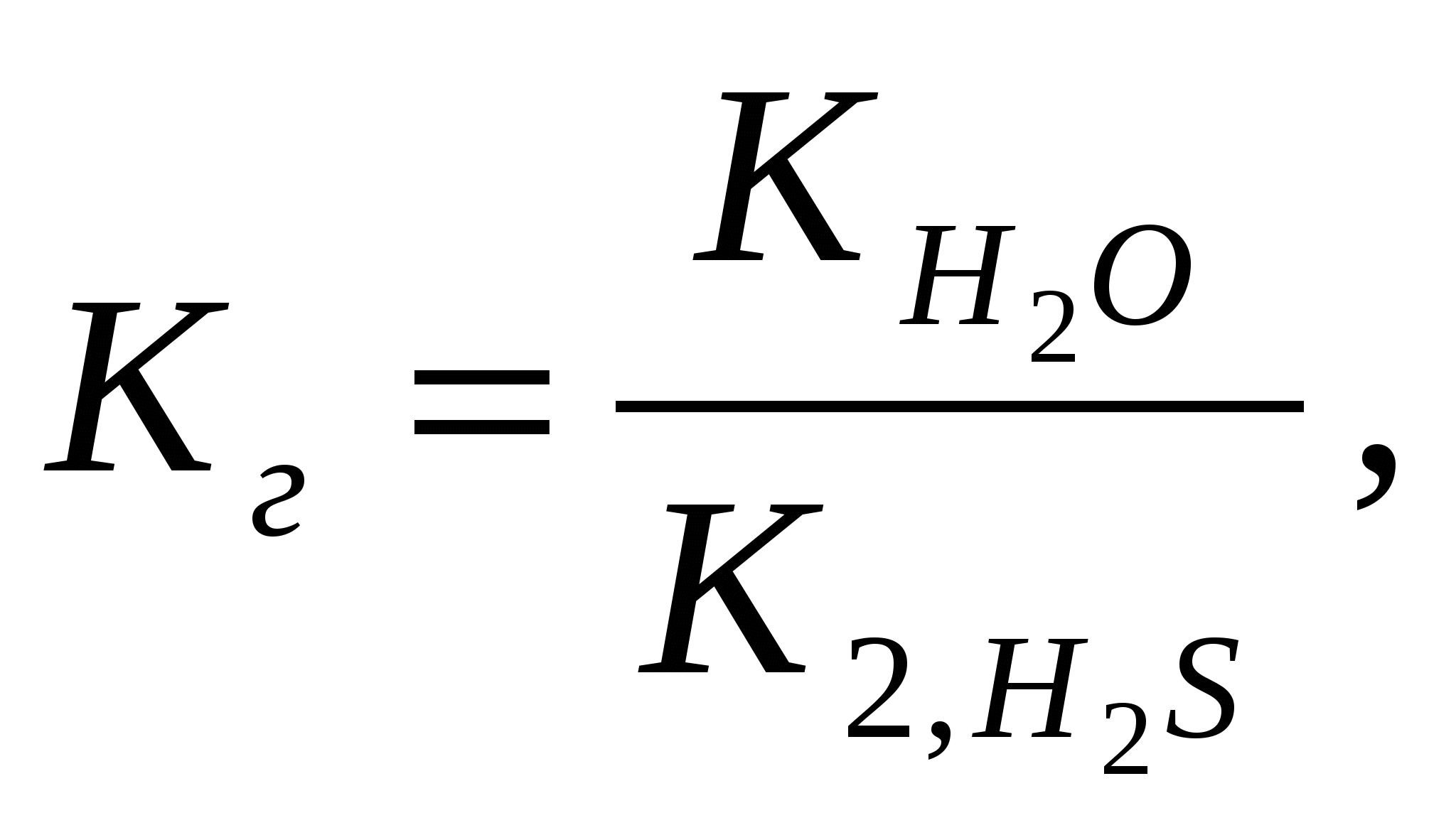 отсюда отсюда Контрольные задания 201. Составьте молекулярные и ионные уравнения гидролиза солей Li3PO4, KCl, CoSO4. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите константу диссоциации селенистой кислоты Н2SeO3, если рН 0,01 М раствора Na2SeO3, равен 10,2. Ответ: 3.10-9 202. Составьте молекулярные и ионные уравнения гидролиза солей CuCl2, KCN, Na2 SO4. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите рН 0,05 н. раствора NaCN. Ответ: 11 203. Составьте молекулярные и ионные уравнения гидролиза солей (NH4)2СO3, МоSO4, LiNO3. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите константу гидролиза и степень гидролиза раствора сульфата меди CuSO4, рН которого равен 5. Ответ: 10-8, 10-3 204. При смешивании растворов солей Cr2(SO4)3 и Na2SiO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза. Вычислите константу гидролиза и степeнь гидролиза раствора нитрата ртути Hg(NO3)2, рН которого равен 3. Ответ: 2.10-4, 0,2 205. Составьте молекулярные и ионные уравнения гидролиза солей NaCN, Pb(NO3)2, K2SO4. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите степень гидролиза и рН раствора иодида аммония NH4I, в 1 л которого содержится 14,5 г соли. Ответ: 7,5.10-5; 5,12 206. Составьте молекулярные и ионные уравнения гидролиза солей Cr(NO3)3, NaNO3, K2SO3. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите рН 0,01 н. раствора NaNO2. Ответ: 7,6 207. При смешивании растворов солей Al(NO3)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза. Вычислите константу диссоциации мышьяковой кислоты Н3AsO4, если рН 0,01 М раствора Na3AsO4, равен 11,7. Ответ: 4.10-12 208. Составьте молекулярные и ионные уравнения гидролиза солей ZnSO4, Na3PO4, CsBr. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите константу гидролиза и степeнь гидролиза раствора сульфата кадмия CdSO4, рН которого равен 4. Ответ: 0,67.10-7; 6,67.10-4 209. Составьте молекулярные и ионные уравнения гидролиза солей Bi(NO3)3, BaCl2, Na2SO3. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите степень гидролиза и рН 0,2 M раствора NH4Cl. Ответ: 1,7.10-4; 4,48 210. При смешивании растворов солей AlCl3 и Na2SO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза. Вычислите степень гидролиза и рН 0,05 н. раствора Na2SiO3. Ответ:11,6 ; 0,16 211. Составьте молекулярные и ионные уравнения гидролиза солей Al2(SO4)3, KF, KI. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите рН 0,01 н. раствора К2SO3. Ответ: 9,4 212. Составьте молекулярные и ионные уравнения гидролиза солей MnSO4, KNO3, NaF. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Сравните рН 0,05 М и 0,0005 н. растворов NaNO2. Ответ: 6,9; 7,9 213. Составьте молекулярные и ионные уравнения гидролиза солей Сd(NO3)2, NaCl, KBrO. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите константу диссоциации гидроксида олова Sn(OH)2, если рН 0,01 М раствора SnSO4, равен 2. Ответ: 10-12 214. При смешивании растворов солей Al2(SO4)3 и K2CO3 каждая из солей гидролизуется необратимо до конца. Выразите этот процесс молекулярным и ионно-молекулярными уравнениями гидролиза. Вычислите концентрацию раствора Na2S, рН которого равен 10. Ответ: 0,25.10-6 215. Составьте молекулярные и ионные уравнения гидролиза солей NiCl2, Na3PO4, NaCl. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите константу гидролиза и степeнь гидролиза раствора сульфата олова SnSO4, рН которого равен 2. Ответ: 0,8.10-2; 0,8 216. Составьте молекулярные и ионные уравнения гидролиза солей Mn(NO3)2, K2SiO3, SrSO4. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите концентрацию раствора СН3СООNa, рН которого равен 8. Ответ: 1,8.10-3 217. Составьте молекулярные и ионные уравнения гидролиза солей MgSO4, Na2CO3, Ca(NO3)2. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите степень гидролиза и концентрацию раствора Pb(NO3)2, рН которого равен 4. Ответ: 0,03; 0,0033 218. Напишите молекулярные и ионно-молекулярные уравнения совместного гидролиза Hg(NO3)2 и K2CO3 . Вычислите константу диссоциации гидроксида алюминия, если рН 0,1 М раствора Al2(SO4)3, равен 3. Ответ: 10-9 219. Составьте молекулярные и ионные уравнения гидролиза солей NiSO4, Na2S, K3AsO4. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Вычислите степень гидролиза рН 0,02 н. раствора сульфата бериллия BeSO4. Ответ: 3,76; 0,1 220. Составьте молекулярные и ионные уравнения гидролиза солей СdBr2, K3PO4, LiI. Какое значение рН (рН 7, рН 7) имеют растворы этих солей? Водородный показатель рН раствора KBrO равен 10. Вычислите степень гидролиза этой соли. Ответ: 0,045 ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Введение Окислительно-восстановительные реакции (ОВР) имеют большое значение в теории и практике. С ними связаны процессы: дыхание, обмен веществ, фотосинтез, гниение, горение, электролиз, коррозия металлов и др. ОВР называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ. Степень окисления (зарядность, окислительное число) – это условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов. Повышение или понижение степени окисления атомов отражается в электронных уравнениях. Окислитель принимает электроны. Процесс приема электронов называется восстановлением, например: Mn6+ + 2e- Mn4+, Мn6+ - окислитель, в процессе реакции восстанавливается до Mn4+. Восстановитель отдает электроны. Процесс отдачи электронов называется окислением, например: Zn0 – 2e- Zn2+, Zn0 – восстановитель, в процессе реакции окисляется до Zn2+. Степень окисления может иметь нулевое, отрицательное, положительное значения. При определении степени окисления следует знать несколько основных положений: (-2) - степень окисления атома кислорода в соединениях: H2+O-2, Cu+2O-2 (исключение: пероксиды: H2 +O2 -1, Na2O2-1, CaO2-1; супероксиды (надперекиси): KO2-1/2, CsO2-1/2; фторид кислорода O+2F2 -). (-1) - степень окисления фтора в соединениях: H+F- , Са+2F2-. ( 0) - нулевую степень окисления имеют атомы в молекулах простых веществ и свободные металлы: H20 , O20 , Cl20 , Zn0 , Cu0 и др. (+1) - степень окисления щелочных металлов (I А погруппа): Na+Cl-, K+Br- и др. (+2) - степень окисления щелочноземельных металлов (II А подгруппа): Сa+2Cl2- , Ba+2O-2 и др. Используя эти данные, можно вычислять степени окисления других атомов в соединениях, зная, что алгебраическая сумма степеней окисления всех атомов, входящих в молекулу, равна нулю. Примеры решения задач Пример. Вычислите степень окисления азота в молекуле азотной кислоты. Определите, окислителем или восстановителем является HNO3. Решение. Обозначим степень окисления азота через х. Расставим степени окисления водорода (+1) и кислорода (-2): H+NxO3-2. Составим уравнение, умножая степени окисления на число атомов в молекуле азотной кислоты: (+1) 1 + х + (-2) 3 = 0. Находим х = + 5. Ответ: степень окисления азота равна +5. НNO3 проявляет только окислительные свойства, так как азот в данном соединении имеет максимально положительную степень окисления +5 (равна номеру группы, в которой находится азот). Увеличить ее N+5 не может, отдавать оставшиеся электроны энергетически невыгодно. Вывод: если элемент в соединении имеет высшую степень окисления, он является только окислителем, в низшей степени – только восстановителем, в промежуточной – и окислителем, и восстановителем. Основные типы окислительно-восстановительных реакций (ОВР) К межмолекулярным относятся реакции, в которых окислитель и восстановитель находятся в разных веществах. Например, в реакции алюминия с азотной кислотой: 8 Al0 + 30 HN+5O3разб. = 8 Al+3(NO3)3 + 3 N+12O + 15 H2O Al – восстановитель, HNO3 – окислитель. К внутримолекулярным относятся реакции, в которых окислитель и восстановитель находятся в одном и том же веществе: 2 KCl+5O3-2 = 2 KCl-1 + 3 O20 В этой реакции атом хлора (окислитель) и атом кислорода (восстановитель) входят в состав одного и того же вещества KClO3. Среди внутримолекулярных реакций выделяют реакции диспропорционирования (самоокисления-самовосстановления). Атом одного и того же элемента является и окислителем и восстановителем: Cl20 + H2O = HCl+1O + HCl-1 В этой реакции часть атомов хлора восстанавливается, изменяя степень окисления от 0 до -1, а другая часть окисляется от 0 до +1. Все химические реакции протекают в соответствии с законом сохранения массы и энергии. В ходе окислительно-восстановительных реакций число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем (закон сохранения зарядности). Полные уравнения окислительно-восстановительных реакций можно составить с помощью методов: а) электронного и б) электронно-ионного балансов. а). Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах. Сущность этого метода можно уяснить на следующем примере. Пример. Составить электронные уравнения для реакции, протекающей по схеме: KMnO4 + H3PO3 + H2SO4 MnSO4 + H3PO4 + K2SO4 + H2O 1). Расставляем степени окисления атомов. K+1Mn+7O4-2 + H3+1P +3O3-2 + H2 +1S+6O4-2 = Mn+2S+6O4-2 + H3 +1P+5O4-2 + K2 +1S+6O4-2 + H2 +1O-2 2). Выписываем элементы, атомы или ионы которых изменяют степени окисления, такими элементами являются Mn и P. 3). Составляем электронные уравнения, то есть схемы изменения зарядов атомов в левой и правой частях реакции: P3+ - 2e- Р5+ 5, процесс окисления Mn7+ +5e- Mn2+ 2, процесс восстановления 4). Общее число электронов, которые присоединяет окислитель, должно быть равно числу электронов, которые отдает восстановитель. Общее наименьшее кратное для отданных и принятых электронов - десять. Делим число 10 на число принятых электронов марганцем и на число отданных электронов фосфором, получим коэффициенты: для марганца - 2, а для фосфора – 5. 5). Найденные коэффициенты 2 и 5ставим перед формулами соединений восстановителя и окислителя. Уравниваем количество ионов калия в правой и левой частях уравнения, подсчитываем число ионов SO42- в правой части, ставим коэффициент 3 перед формулой H2SO4 . Уравниваем число атомов водорода в правой части уравнения, ставим коэффициент 3 перед формулой H2O. Молекулярное уравнение реакции будет иметь вид: 2KMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4 + 5H3PO4 + K2SO4 + 3H2O 6). Проводим проверку по количеству атомов кислорода. Вступило в реакцию 35 атомов кислорода. В продуктах реакции атомов кислорода 35. Следовательно, реакция записана, коэффициенты расставлены правильно. б). Метод электронно-ионного баланса применим к окислительно-восстановительным реакциям, протекающим в водных растворах. Он основан на составлении электронно-ионных балансов двух полуреакций: одной - для процесса окисления и другой – для процесса восстановления. Затем проводится суммирование этих полуреакций. В результате получается общее ионно-молекулярное уравнение окислительно-восстановительной реакции. Пример. Используя метод электронно-ионного баланса, расставим коэффициенты в уравнении реакции: Cu + HNO3 (конц.) Cu(NO3)2 + NO2 + H2O. Решение. Уравнение первой полуреакции – окисление восстановителя: Cu – 2e- Cu2+. Уравнение второй полуреакции – восстановление окислителя – составили так: ион NO3- превращается в NO2 , то есть один атом кислорода в кислой среде связывается с ионами водорода с образованием воды: NO3- + 2H+ NO2 + H2O. Уравняв число зарядов, получим: NO3- + 2H+ + e- NO2 + H2O. Составляем суммарное ионно-молекулярное уравнение: Cu – 2e- Cu2+ 1 NO3- + 2H+ + e- NO2 + H2O 2 Сu + 2NO3- + 4H+ Cu2+ + 2NO2 +2H2O. Правильность составленного уравнения проверяется по балансу числа атомов и зарядов в левой и правой частях уравнения. Уравнение реакции в молекулярной форме имеет вид: Сu + 4HNO3 (конц.) Cu(NO3)2 + 2NO2 +2H2O. Контрольные задания 221. Определите, к какому виду окислительно-восстановительных процессов относятся следующие реакции: а) HCl + KMnO4 KCl + MnCl2 + Cl2 + H2O; б) S + HNO3 H2SO4 + NO; в) Cu + HNO3 (разб.) Cu(NO3)2 + NO + H2O. С помощью метода электронного баланса расставьте коэффициенты в этих уравнениях. 222. Составьте электронные уравнения и расставьте коэффициенты в уравнениях реакций. Укажите, какое вещество является окислителем, какое – восстановителем. а) P + HNO3 + H2O H3PO4 + NO; б) H2S + SO2 S + H2O; в) Zn + H2SO4 (конц.) ZnSO4 + SO2 + H2O. 223. Определите степени окисления всех компонентов, входящих в состав следующих соединений: H2S, S, SO2 , SO3 , H2SO4 . Какие из веществ являются только окислителями, только восстановителями, и окислителями и восстановителями? Расставьте коэффициенты в уравнении реакции: H2S + Br2 + H2O H2SO4 + HBr Укажите окислитель и восстановитель. 224. Используя метод электронного баланса, подберите коэффициенты в уравнениях реакций: a) KMnO4 + H2O + K2SO3 K2SO4+ MnO2+ KOH; б) MnO2 + HCl MnCl2 + Cl2 + H2O. 225. Укажите реакции, в которых азот окисляется, восстанавливается, не изменяет степени окисления. а) HNO2 + Cl2 + H2O HNO3+ HCl; б) С + HNO3 CO2 + NO + H2O; в) NH4NO3 + KOH NH4OH + KNO3. Составьте уравнения электронного баланса, расставьте коэффициенты. 226. Какие из приведенных реакций являются внутримолекулярными? Расставьте коэффициенты в уравнениях реакций. Укажите восстановитель, окислитель. а) KNO3 KNO2 + O2; б) Pb(NO3)2 PbO2 + NO + O2; в) KClO3 KCl + O2. 227. Какие ОВР относятся к реакциям диспропорционирования? Расставьте коэффициенты в реакциях: а) KMnO4 K2MnO4 + MnO2 + O2; б) KClO3 kat KCl + KClO4 . 228. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO2, SO2, KMnO4, F2, HNO3. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции: HNO3 + H2S H2SO4 + NO + H2O. 229. Расставьте коэффициенты в уравнениях реакций. Укажите окислитель, восстановитель. а) HClO3+ H2SO3 HCl + H2SO4; б) H2S + H2SO3 S + H2O. 230. Определите, к какому виду ОВР относятся следующие реакции: а) Cl2 + KOH KCl + KClO3 + H2O; б) K2Cr2O7 + HCl CrCl3 + Cl2 + H2O + KCl; в) S + H2SO4 (конц.) SO2 + H2O. С помощью метода электронного баланса расставьте коэффициенты в этих уравнениях. 231. Определите, к какому типу ОВР относятся процессы, протекающие по схемам: а) Na2SO3 + HCl NaCl + SO2 + H2O; б) H2S + KMnO4 + H2SO4 S + K2SO4 + MnSO4 + H2O; в) Fe3O4 + H2 Fe + H2O. Расставьте коэффициенты в уравнениях реакций. Укажите окислитель, восстановитель. 232. Составьте электронные уравнения, укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях: a) S-2 S+4; б) Zn0 Zn+2; в) N-3 N+5. Используя метод электронно-ионного баланса, расставьте коэффициенты в уравнении реакции, идущей по схеме: NaCrO2 + Br2 + NaOH Na2CrO4 + NaBr + H2O. Укажите окислитель, восстановитель. 233. Исходя из степени окисления хрома, укажите, какие из соединений проявляют только окислительные свойства: Cr, Cr2O3, СrO3, K2Cr2O7 . Почему? Расставьте коэффициенты в уравнении реакции, идущей по схеме: KNO2 + K2Cr2O7 + H2SO4 KNO3 + Cr2(SO4)3 + H2O. Укажите окислитель и восстановитель. 234. Составьте электронные уравнения для реакций, протекающих по схемам: а) SnO + KMnO4 + HCl SnCl4 + MnCl2 + KCl + H2O; б) Si + NaOH + H2O Na2SiO3 + H2; в) Al + H2O Al(OH)3 + H2. К какому виду ОВР относятся эти реакции? Расставьте коэффициенты, укажите окислитель и восстановитель. 235. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление - происходит при следующих превращениях: а) Cl- Cl+7; б) Mn+6 Mn+2; в) K0 K+1. На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: H2S + HNO3 H2SO4 + NO + H2O. 236. Какие соединения и простые вещества могут проявлять как окислительные, так и восстановительные свойства: H2O2 , H2S, S, Cl2, KNO3 ? Почему? С помощью метода электронного баланса расставьте коэффициенты в уравнении реакции: Al + HNO3 (конц.) Al(NO3)3 + NO2 + H2O. 237. Определите, к какому виду ОВР относятся следующие реакции: а) НJ + H2 SO4 J2 + H2S + H2O; б) KMnO4 + H2O + Na2S S + MnO2 + KOH +NaOH; в) HNO3 NO2 + H2O +O2 С помощью метода электронного баланса подберите коэффициенты в этих уравнениях. 238. Реакции выражаются схемами: а) P + KClO3 P2O5 + KCl; б) MnO2 + HCl Cl2 + MnCl 2 + H2O; в) H2S + O2 SO2 + H2O. Составьте электронные уравнения. Расставьте коэффициенты. Укажите окислитель, восстановитель. 239. Определите степени окисления всех элементов, входящих в соединения: F2, Cu, HCl, H2S, KCl, KNO2. Какие из перечисленных веществ проявляют только восстановительные свойства? Расставьте коэффициенты в уравнении реакции, укажите окислитель, восстановитель. KBr + KBrO3 + H2SO4 Br2 + K2SO4 + H2O. 240. Определите, к какому типу ОВР относятся процессы, протекающие по схемам: а) H2S + KMnO4 + H2SO4 S + K2SO4 + MnSO4 + H2O; б) KJ + Cl2 KCl + J2; в) Сu + H2SO4 (конц.) СuSO4 + SO2 + H2O Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите окислитель, восстановитель. ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ И ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ Если металлическую пластину опустить в воду или электролит, то расположенные на ее поверхности катионы металла гидратируются полярными молекулами воды и переходят в воду или раствор электролита. При этом электроны, в избытке остающиеся в металле, заряжают примыкающий к поверхности слой отрицательно. Ввиду сил электростатического взаимодействия катионы металла, перешедшие в электролит, притягиваются к поверхности металла, образуя так называемый двойной электрический слой, по своему устройству напоминающий заряженный плоский конденсатор. Образовавшийся двойной электрический слой препятствует дальнейшему растворению металла и система металл-раствор переходит в состояние термодинамического равновесия. В этом состоянии между металлом и раствором возникает устойчивая разность потенциалов (скачок потенциала), называемая электродным потенциалом металла. Абсолютное значение электродного потенциала определить невозможно. Поэтому определяют относительные электродные потенциалы (разность электродного потенциала исследуемого металла и электрода сравнения). В качестве электрода сравнения выбран водородный электрод, потенциал которого при стандартных условиях (Т = 298 К, Р = 1 атм.) и [H+] = 1 моль/л принимается равным нулю. Стандартным электродным потенциалом металла (Е0) называют его электродный потенциал, возникающий при погружении металла в раствор собственных ионов с концентрацией 1 моль/л, измеренный по сравнению со стандартным водородным электродом. Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов, получаем «ряд напряжений металлов». Чем меньше значение Е0, тем более сильным восстановителем является металл. В электрохимических преобразователях энергии (гальванических и топливных элементах, аккумуляторах) протекают ОВР. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. Примеры решения задач Пример 1. Определите электродный потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л. Решение. Электродный потенциал металла (Е) зависит от концентрации его в растворе. Эта зависимость выражается уравнением Нернста: Е = Е0 + 0,059 lgC , n Е0 – стандартный электродный потенциал; n – число электронов, принимающих участие в процессе; С – концентрация ионов металла в растворе, моль/л. Е0 для никеля равен – 0,25 В (из таблицы). Определим электродные потенциалы металла при данной концентрации: Е = - 0,25 + 0,059 lg10-3 = - 0,339 В. 2 Пример 2. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, погруженные в растворы их ионов с концентрацией 1моль/л. Какой металл является анодом, какой - катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС. Решение. Схема гальванического элемента: (-) Mg Mg2+ Zn2+ Zn (+) Mg имеет меньший потенциал -2,37 В и является анодом, на котором протекает окислительный процесс: Mg – 2e- = Mg2+ (1) Цинк, потенциал которого -0,76 В, - катод, то есть электрод, на котором протекает восстановительный процесс: Zn2+ + 2е- = Zn0 (2) Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов: Mg + Zn2+ = Mg2+ + Zn0 Для определения ЭДС гальванического элемента из потенциала катода вычитаем потенциал анода. Концентрация ионов в растворе 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов: ЭДС = Е0катода – Е0анода = -0,763 - (-2,37) = 1,607 В. Контрольные задания 241. Вычислите стандартную ЭДС гальванического элемента, составленного из магниевого и медного электродов. Напишите уравнение анодного и катодного процессов. Ответ: 2,72 В 242. Вычислите ЭДС гальванического элемента, составленного из алюминиевой и медной пластин, погруженных в их одномолярные растворы. Напишите уравнения анодного и катодного процессов. Ответ: 2,03 В 243. Составьте схемы двух гальванических элементов, в одном из которых свинец является катодом, а в другом – анодом. Напишите для каждого из этих элементов уравнение анодного и катодного процессов. Рассчитайте стандартную ЭДС этих элементов. 244. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и водородного электрода, погруженного в раствор с рН=10. На каком электроде водород будет окисляться, а на каком - восстанавливаться? Ответ: 0,59 В 245. По уравнению токообразующей реакции составьте схему гальванического элемента: Mg + ZnSO4 = MgSO4 + Zn Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС. Ответ: 1,607 В 246. Вычислите электродный потенциал медного электрода в растворе его соли с концентрацией 0,01 моль/л. Составьте схему гальванического элемента, в котором медь является анодом. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента. Ответ: 0,281 В 247. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента. 248. Составьте схему гальванического элемента из цинка и свинца, погруженных в растворы их солей с концентрацией ионов [Zn2+] = 0,01 моль/л, [Pb2+] = 1 моль/л. Ответ: 0,692 249. Вычислите ЭДС концентрационного гальванического элемента, электроды которого сделаны из серебра. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один серебряный электрод погружен в 0,01 М раствор, а другой – в 0,1 М раствор. Ответ: 0,059 В 250. Как изменится (увеличится, уменьшится) или останется постоянной масса свинцовой пластины, погруженной в раствор, содержащий соли Fe (II), Mg, Cu (II), Ag (I). Напишите молекулярные уравнения реакций. 251. Какой должна быть концентрация ионов [Zn2+] в полуячейке, чтобы пара Zn/Zn2+ при Т=298 К имела электронный потенциал - 0,819 В ? Ответ: 0,01 моль /л 252. Вычислите электродный потенциал водородного электрода в водном растворе кислоты с рН=3. Ответ: -0,177 В 253. Серебряный электрод в растворе его соли имеет электродный потенциал 0,623 В. Вычислите концентрацию ионов серебра в растворе. Ответ: 0,001 моль/л 254. ЭДС гальванического элемента, составленного из Ag и Cd электродов, при концентрации [Ag+] = 1 моль/л составила 1,32 В. Какой должна быть концентрация соли кадмия в растворе? Ответ: 1,28 моль/л 255. По уравнению токообразующей реакции Ni + CuSO4 = NiSO4 + Cu составьте схему гальванического элемента. Напишите уравнения катодного и анодного процессов. Рассчитайте стандартную ЭДС этого элемента. Ответ: 0,59 В 256. При какой концентрации ионов в растворе потенциал электрода Bi3+/ Bi равен 0,156 В? Ответ: 0, 01 моль/л 257. Составьте схему гальванического элемента, составленного из Mg и Co . Напишите уравнения электродных процессов. Вычислите ЭДС этого элемента, если [ Mg2+] = 1 моль/л, [ Co2+] = 0,1 моль/л. Ответ: 0,456 В 258. Какой должна быть концентрация соли железа Fe2+ в растворе, чтобы элемент (-) Fe / HCl / Cu (+) при [Cu2+] = 1 моль/л вырабатывал ЭДС = 0,839 В? Ответ: 0,01 моль/л 259.Стандартный потенциал кобальта больше стандартного потенциала никеля. Изменится ли это соотношение, если изменить концентрации ионов никеля в растворе до 0,0001 моль/л, а кобальта – 0,1 моль/л? 260. Как работает свинцовый (кислотный) аккумулятор? Составьте уравнения полуреакций и зарядки – разрядки аккумулятора. ЭЛЕКТРОЛИЗ |
