Химия контрольные задания для студентовзаочников всех специальностей
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
ВведениеСовременная теория строения атомов и молекул базируется на законах движения микрочастиц, обладающих очень малой массой, порядка 10-27 – 10-31 кг. Эти законы были сформулированы в 1923-27 годах и привели к созданию новой науки – квантовой механики. Установлено, что поведение микрочастиц принципиально отличается от поведения микрообъектов, изучаемых классической механикой. Применение законов квантовой механики к химическим явлениям привело к созданию квантовой химии, которая является основой современной теории химической связи и строения вещества. Движение электрона в атоме имеет вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9-0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, m1). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (l) и ориентацию (m1) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя числами (n, l, ml, и ms). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число l (орбитальное) – момент количества движения (энергетический подуровень), число m1(магнитное) – магнитный момент, ms – спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны и атомы должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому на АО могут находиться не более двух электронов, различающихся своими спинами ms = ± 1/2. Заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме – в порядке возрастания числа n. Соответственно по этому правилу последовательность заполнения энергетических уровней и подуровней следующая: 1s2 < 2s2 < 2p6 < 3s2 < 3p6 < 4s2 < 3d10 < 4p6 < 5s2 < 4d10 < 5p6 < 6s2 < 5d1 < 4f14 < 5d9 < 6p6 < 7s2 < 6d1 < 5f14 < 6d9 < 7p6 < 8s2…… Примеры решения задач Пример 1. Напишите электронную формулу атома серы. К какому электронному семейству относится сера? Укажите валентные электроны, распределите их по энергетическим ячейкам в нормальном и возбужденных состояниях. Решение. У атома серы порядковый номер 16 в таблице Д.И. Менделеева, поэтому – 16 электронов и последовательность заполнения энергетических уровней и подуровней совпадает с электронной формулой (что характерно для элементов с порядковыми номерами от 1 до 20): 16S – 1s2 2s2 2p6 3s2 3p4 Последним заполняется p-подуровень, поэтому сера принадлежит к p-электронному семейству; содержит 6 валентных электронов – 3s2 3p4. Представим схему размещения валентных электронов в квантовых (энергетических) ячейках:   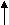     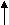        3s 3p 3d 3s 3p 3d  16S - ... 16S - ...  Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS. Валентность серы в нормальном состоянии равна 2, например, в соединениях H2S, Na2S, CaS. У атома серы на 3d-подуровне имеются вакантные орбитали. При возбуждении атома происходит разъединение пар электронов и переход их на свободные орбитали. Представим электронные конфигурации атома серы в возбужденных состояниях: 3s 3р 3d   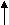             а) 16S* - … , 16S* - … 3s23p33d1 а) 16S* - … , 16S* - … 3s23p33d1Валентность серы равна 4, например, в соединениях SO2, H2SO3 3s 3p 3d                б) 16S*- … S* - … 3s1 3p3 3d2 б) 16S*- … S* - … 3s1 3p3 3d2 Валентность серы равна 6, например, в соединениях: SO3, H2SO4. Вывод: валентность серы в соединениях 2, 4, 6. Пример 2. Составьте электронную формулу атома титана и ионов титана Ti2+ и Ti4+. К какому электронному семейству относится титан? Приведите электронные аналоги титана. Решение. Порядок заполнения энергетических уровней и подуровней следующий: 22Ti – 1s2 2s2 2p6 3s2 3p6 4s2 3d2 Титан принадлежит к d-электронному семейству. Электронная формула титана имеет вид: 22Ti – 1s2 2s2 2p6 3s2 3p6 3d2 4s2 Подчеркнуты валентные электроны. Электронно-графические формулы валентных электронов атома титана в нормальном и возбужденном состояниях: 3d 4s 4p 4d 4f                         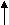 22 Ti -… 22 Ti -… Валентность титана в нормальном состоянии равна 2, например, в соединениях: TiO, TiCl2. Такая валентность обусловлена двумя неспаренными электронами, но вакантные орбитали на 4p-подуровне вносят дополнительный вклад в валентность и титан в некоторых соединениях проявляет валентность, равную 3, например, в соединении TiCl3. При возбуждении атома титана происходит распаривание 4s-электронов и переход их на 4p-подуровень, валентность титана в этом состоянии равна 4 (TiO2, TiCl4): 3d 4s 4p 4d 4f                          22Ti*-… 22Ti*-… 22 Ti* - … 3d2 4s1 4p1 4d0 4f0 Сокращенная электронная формула атома титана: 22 Ti - … 3d2 4s2 Электронные аналоги титана: 40 Zr - … 4d2 5s2; 72 Hf - …5d2 6s2 Электронные формулы ионов титана Ti2+ и Ti4+ соответственно: 22Ti2+ - … 3d2 4s0; 22Ti4+ - … 3d0 4s0. Контрольные задания 21. Структуры валентных электронных слоев выражаются формулами: а) 4s24p2; б) 5d46s2; в) 4s1. Составьте полные электронные формулы, определите порядковые номера, приведите названия элементов, определите принадлежность к электронным семействам. 22. Напишите электронную формулу атома кислорода. Какие элементарные частицы входят в состав атома? Рассчитайте длину волны де Бройля для молекулы кислорода, движущейся со скоростью 1000 м/с, учтите единицы измерения Джоуля [м2кгс-2]. Возможно ли обнаружение волновой природы этой частицы? 23. В чем сущность , -, + - радиоактивного распада? Изотопы какого элемента получатся в результате последовательного излучения 4- и 2-частиц атомным ядром 238U? Напишите сокращенную электронную формулу полученного изотопа элемента. Является ли полученный изотоп устойчивым или радиоактивным? 24. Напишите электронные формулы атома Te и иона Te2-. Докажите, что валентность теллура в соединениях 2, 4, 6. 25. Напишите электронные формулы атома железа, ионов Fe2+ и Fe3+. Докажите с помощью электронно-графической схемы, что максимальная валентность железа в соединениях равна 6. 26. Что такое изотопы? Приведите примеры изотопов какого-либо элемента, напишите электронную формулу изотопов этого элемента. Почему изотопы элемента имеют сходные химические свойства? 27. Определите по правилу Клечковского последовательность заполнения электронами энергетических подуровней, если n+l=7. Какой элемент имеет валентные электроны 7s2? 28. Напишите электронные формулы атома стронция и иона Sr2+. Укажите валентность стронция в нормальном и возбужденном состояниях. Какие значения принимают кантовые числа для внешних электронов атома стронция? 29. Напишите значения всех четырех квантовых чисел для трех любых электронов на 4p-подуровне. Значениями какого квантового числа различаются три электрона указанного подуровня? Почему максимальное число электронов на p-подуровне равно 6? 30. По какому признаку элементы подразделяются на электронные семейства? Напишите электронные формулы атомов любых двух элементов пятого периода, принадлежащих к разным электронным семействам. Какие электроны этих элементов являются валентными? Какой подуровень заполняется раньше: 5s или 4d? Почему? 31. Какое состояние атома называется основным и какое – возбужденным? Чем ион отличается от нейтрального атома? Ответы на вопросы подтвердите написанием электронных формул атома брома и бромид-иона. Изобразите электронно-графические схемы атома брома в нормальном и возбужденных состояниях. 32. Напишите электронные формулы атома водорода и ионов Н+, Н-. Какие элементарные частицы входят в состав атома водорода и ионов? Вычислите энергию связи электрона в электрон-Вольтах (эВ) на первой и пятой стационарных орбиталях атома водорода и сравните (<, >) их величины. 33. Структуры валентных электронных слоёв атомов элементов выражаются формулами: а) 5s25p4; б) 3d54s1; в) 7s2. Определите порядковые номера, приведите названия элементов, а также укажите принадлежность к электронным семействам. 34. Составьте электронные формулы и электронно-графические схемы атомов элементов с порядковыми номерами 23 и 33 в нормальном и возбужденных состояниях. Приведите валентные электроны этих элементов и их электронных аналогов. 35. На примерах галлия и марганца докажите, что имеется взаимосвязь строения атомов элементов с положением их в периодической системе химических элементов Д.И. Менделеева. 36. Напишите электронные формулы и электронно-графические схемы атомов фосфора и ванадия в нормальном и возбужденном состояниях. К какому электронному семейству относится каждый из этих элементов? 37. На каком основании иттрий (Z=39) и индий (Z=49) помещены в одну группу периодической системы элементов Д.И. Менделеева? Почему они в разных подгруппах? Приведите валентные электроны этих элементов и их электронных аналогов. 38. Напишите электронные формулы атома Ba и иона Ba2+. Какую валентность проявляет барий в нормальном и возбужденном состояниях? Структуру какого инертного газа имеет ион Ba2+? 39. Напишите электронную формулу атома технеция. Укажите валентные электроны. Распределите валентные электроны по энергетическим ячейкам в нормальном и возбужденном состояниях. Определите суммарный спин электронов в возбужденном состоянии. 40. Напишите электронную формулу атома меди; учтите, что у меди происходит провал одного 4s электрона на 3d-подуровень. Приведите электронные формулы двух последних уровней электронных аналогов меди. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА Введение В 1869 году Д.И. Менделеев открыл периодический закон, современная формулировка которого следующая: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от зарядов ядер их атомов. Выражением закона является периодическая система Д.И. Менделеева. Электронное строение элементов изменяется периодически, поэтому свойства элементов также изменяются периодически, а именно: размеры атомов, энергия ионизации, сродство к электрону, электроотрицательность, окислительно-восстановительные, кислотно-основные и другие. Примеры решения задач Пример 1. Какой элемент 4 периода – марганец или бром проявляет металлические свойства? Решение. Полные электронные формулы элементов: 25Mn – 1s22s22p6 3s23p63d54s2 35Br – 1s22s22p6 3s23p6 3d10 4s24p5 Марганец является d-элементом VIIB подгруппы, а бром – p-элемент VIIA подгруппы. На внешнем энергетическом уровне у атома марганца два электрона, а у атома брома – семь. Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а, следовательно, способны терять электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем энергетическом уровне содержат более трех электронов, обладают в основном сродством к электрону, а, следовательно, приобретают отрицательную степень окисления и образуют элементарные отрицательные ионы. Таким образом, марганец, как и все металлы, обладает только восстановительными свойствами, тогда как для брома более свойственна окислительная функция. Общей закономерностью для всех групп, относящихся к d-электронному семейству, является преобладание металлических свойств. Следовательно, металлические свойства проявляет марганец. Пример 2. Как зависят кислотно-основные свойства оксидов и гидроксидов от степени окисления образующих из атомов? Какие гидроксиды называются амфотерными (амфолитами)? Решение.Если элемент проявляет переменную степень окисления и образует несколько оксидов и гидроксидов, то с увеличением степени окисления свойства их изменяются от основных к амфотерным и кислотным. Например: оксиды и гидроксиды хрома, марганца, ванадия и др. Это объясняется характером электролитической диссоциации (ионизации) гидроксидов ЭОН, которая в зависимости от сравнительной прочности и полярности связей Э-О и О-Н может протекать по двум направлениям: основному - ЭОН Э+ + ОН- или кислотному - ЭОН ЭО - + Н+ Полярность связей, в свою очередь, определяется разностью электроотрицательностей и эффективными зарядами атомов. Приводим пример диссоциации амфотерных гидроксидов (амфолитов): Эn+ + nОН- Э(ОН)n ; НnЭОn nН+ + ЭОn- основной тип кислотный тип диссоциации диссоциации В кислой среде амфолит проявляет основной, а в щелочной среде – кислотный характер. Рассмотрим амфотерные свойства оксидов и гидроксидов хрома. Приводим сокращенную электронную формулу атомов хрома: 24Cr - … 3d54s1. Хром образует оксиды: Cr+2O, Cr2+3O3, Cr+6O3, которым соответствуют следующие гидроксиды: Cr+2 (OH)2, Cr+3 (OH)3, H2Cr+6 O4 и H2Cr+62 O7. Для CrO и Cr(OH)2 характерны основные свойства, для Сr2O3 и Cr(OH)3 – амфотерные свойства, для CrO3, H2CrO4 и H2Cr2O7 – кислотные свойства. Докажем амфотерные свойства тригидроксида хрома: Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]; Cr(OH)3 + 3OH- = [Cr(OH)6]3-. В данной реакции Cr(OH)3 проявляет кислотные свойства. Cr(OH)3 + 3HCl = CrCl3 + 3H2О, Cr(OH)3 + 3H+ = Cr3+ + 3H2O. В данной реакции Cr(OH)3 проявляет основные свойства. Контрольные задания 41. Составьте формулы оксидов и гидроксидов марганца. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? Подчиняются ли эти соединения общей закономерности изменения свойств оксидов и гидроксидов? 42. Исходя из положения хрома, селена, углерода и серы в периодической системе, определите, какая из кислот является более сильным окислителем: а) H2CrO4 или H2SeO4, б) H2CO3 или H2SO3. 43. У какого элемента наибольшая энергия ионизации: а) Sr или Cd; б) Rb или Ag? У какого элемента наибольшая электроотрицательность: а) As или Sb; б) As или Br? 44. Какую высшую и низшую степени окисления проявляют вольфрам, теллур, серебро в соединениях? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы. 45. Приведите современную формулировку периодического закона. Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя имеют бóльшую атомную массу. Как называются пары таких элементов? 46. Исходя из положения металлов в периодической системе, определите, какой из двух гидроксидов является более сильным основанием: а) KOH или Mn(OH)2; б) Zn(OH)2 или Сa(OH)2; в) Mg(OH)2 или Be(OH)2. 47. Исходя из положения технеция, селена, цезия в периодической системе, составьте формулы следующих соединений: технециевой кислоты, оксида селена, гидрокарбоната цезия, отвечающих их высшей степени окисления. Изобразите структурные формулы соединений. 48. Исходя из положения серы, фосфора и хлора в периодической системе, определите, как изменяются окислительные свойства кислот: H2SO4, H3PO4, HClO4? 49. В ряду кислородных кислот хлора: HClO – HСlO2 – HСlO3 - HClO4 определите, какая из кислот наиболее сильный окислитель, какая из кислот наиболее сильный электролит. 50. На основании строения атомов лития и бериллия поясните, почему первый потенциал ионизации у лития меньше, чем у бериллия, а второй потенциал ионизации лития больше, чем у бериллия? 51. Какие элементы принадлежат к f–электронному семейству? На примерах строения атомов двух любых лантаноидов (или актиноидов) докажите, что химические свойства в группах лантаноидов (или актиноидов) близки друг к другу. 52. Как изменяются кислотно-основные свойства оксидов и гидроксидов в периодах с увеличением порядковых номеров элементов? Ответ мотивируйте строением атомов элементов и величин их важнейших характеристик: радиусов атомов и электроотрицательностей. 53. Составьте формулы оксидов и гидроксидов ванадия. Как изменяется кислотно-основной и окислительно-восстановительный характер этих соединений? 54. Исходя из строения атомов элементов, определите, какое основание более сильное: а) Sr(OH)2 или Fe(OH)2; б) Cu(OH)2 или KOH; какая кислота более сильная: а) H3AsO4 или H2SeO4; б) HClO4 или HMnO4. 55. Какую высшую и низшую степени окисления проявляют молибден, йод и цирконий? Почему? Составьте формулы соединений, отвечающих этим степеням окисления и изобразите их структурные формулы. 56. Как изменяется прочность связи между атомами в молекулах галогенов Cl2 – Br2 – J2? Почему молекула F2 выпадает из общей закономерности? 57. Как изменяются металлические свойства в VВ подгруппе периодической системы? Ответ мотивируйте, исходя из строения атомов элементов и величин важнейших их характеристик: радиусов атомов и энергий ионизации. 58. Исходя из положения галогенов в периодической системе, поясните, как изменяются восстановительные свойства в ряду HCl – HBr – HJ. Почему HF входит в исключение? 59. Как изменяются неметаллические свойства в VIА подгруппе периодической системы? Ответ мотивируйте, исходя из строения атомов элементов и величин важнейших их характеристик: радиусов атомов и электроотрицательностей. 60. В какой степени окисления галогены и элементы подгруппы марганца проявляют наибольшее сходство в свойствах? Приведите примеры сходных соединений. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВ |
