хроматография-лекции. Хроматографические методы. Общая характеристика методов
 Скачать 6.82 Mb. Скачать 6.82 Mb.
|
|
6. Капиллярный электрофорез Введение С начала 80-х годов XX века получил становление и активное развитие новый инструментальный метод, относящийся к комбинированным методам разделения и анализа капиллярный электрофорез (КЭ). Он позволяет анализировать ионные и нейтральные компоненты различной природы с высокой экспрессностью и уникальной эффективностью. В основе КЭ лежат электрокинетические явления электромиграция ионови других заряженных частиц и электроосмос. Эти явления возникают в растворах при помещении их в электрическое поле высокого напряжения. Если раствор находится в тонком кварцевом капилляре, то электрическое поле, наложенное вдоль капилляра, вызывает в нем движение заряженных частиц и пассивный поток жидкости (электроосмотический поток, ЭОП), в результате чего проба разделяется на индивидуальные компоненты, так как параметры электромиграции специфичны для каждого вида заряженных частиц. В то же время, такие возмущающие факторы, как диффузионные, сорбционные, конвекционные, гравитационные и др., в капилляре заметно ослаблены, благодаря чему достигаются рекордные эффективности разделений. Традиционно КЭ сравнивают с высокоэффективной жидкостной хроматографией (ВЭЖХ), поскольку в обоих методах разделение происходит в ограниченном пространстве (капилляре или колонке) с участием движущейся жидкой фазы (буферного раствора или подвижной фазы (элюента)) и для регистрации сигналов используют схожие принципы детектирования и программы обработки данных. Тем не менее, у методов есть отличия, относящиеся к достоинствам капиллярного электрофореза: — высокая эффективность разделения (сотни тысяч теоретических тарелок), недоступная ВЭЖХ и связанная с плоским профилем ЭОП — малый объем анализируемой пробы и буферов (не более 1–2 мл в день), при этом практически не требуется применение высокочистых, дорогостоящих органических растворителей — отсутствие колонки, сорбента, проблем с его старением и, значит, заменой колонки — простая и недорогая аппаратура — экспрессность и низкая себестоимость единичного анализа. Из ограничений КЭ следует отметить невысокую, по сравнению с ВЭЖХ, концентрационную чувствительность и требование к анализируемым соединениям растворяться в воде или водно-органических смесях. В то же время, недостаточную чувствительность определения при использовании УФ-детектирования (из-за малой длины оптического пути, равного внутреннему диаметру капилляра) может скомпенсировать использование таких видов детектирования, как лазерно-индуцированное флуориметрическое или масс-спектрометрическое в сочетании с различными приемами on-line концентрирования пробы (т. н. стэкинг и свиппинг). Системы капиллярного электрофореза «Капель» предназначены для количественного и качественного определения состава проб веществ в водных и водно-органических растворах методом КЭ (табл. 1). Таблица 1. Технические характеристики приборов серии «Капель»
«Капель-103Р» наиболее простая модель с ручным управлением и пошаговым принципом работы. В прибор устанавливается только одна пробирка с анализируемым раствором. На приборе любой модификации без ограничений могут быть реализованы методики, использующие основные варианты КЭ капиллярный зонный электрофорез (КЗЭ) или мицеллярную электрокинетическую хроматографию (МЭКХ). Первый вариант предназначен для анализа только ионных компонентов проб, второй для анализа ионных и молекулярных форм веществ. В системах «Капель» можно задавать и изменять в ходе анализа: давление, напряжение, время анализа, температуру (для систем с жидкостным охлаждением капилляра), длину волны (модели 105/105М). Принятые термины и сокращения Время миграции (tм) время, необходимое компоненту для прохождения им эффективной длины капилляра (Lэфф) от зоны ввода пробы (начала капилляра) до зоны детектирования. Электроосмотический поток (ЭОП) течение жидкости в капилляре под действием приложенного электрического поля. Время, необходимое жидкости для преодоления эффективной длины капилляра вследствие возникающего ЭОП, называют временем ЭОП (tэоп) и экспериментально определяют из электрофореграммы по времени миграции нейтрального компонента маркера ЭОП. Подвижность ЭОП (µэоп) представляет собой отношение скорости ЭОП к напряженности электрического поля. Скорость ЭОП положительна при направлении движения жидкости от входного участка капилляра к детектору и отрицательна при обратном направлении. Скорость ЭОП вычисляют как: vэоп = Lэфф / tэоп. Напряженность электрического поля представляет собой отношение приложенной разности потенциалов (U) к общей длине капилляра (Lобщ). Таким образом, подвижность ЭОП вычисляют из экспериментальных данных: µэоп = Lобщ * Lэфф / tэоп * U. Длину капилляра выражают в см. Электрофоретическая подвижность частицы (µэф) по аналогии с предыдущей величиной представляет собой отношение электрофоретической скорости частицы к напряженности электрического поля и может быть вычислена: µэф = Lобщ * Lэфф / tм* U. В отличие от µэопэлектрофоретическую подвижность частицы нельзя определить непосредственно из электрофореграммы, поскольку время миграции частицы tмв этом случае представляет собой сумму времен миграции собственно частицы и маркера ЭОП. Из эксперимента можно найти так называемую общую подвижность, которая выражается (при положительной скорости ЭОП): µобщ = µэоп+µэф. Зная из эксперимента µобщи µэопможно легко рассчитать µэф. Капиллярный электрофорез (КЭ) метод разделения, реализуемый в капиллярах и основанный на различиях в электрофоретических подвижностях заряженных частиц как в водных, так и в неводных буферных электролитах. Буферные растворы (ведущие электролиты, рабочие буферы) могут содержать добавки (например, макроциклы, органические растворители, полимеры и др.), которые способны взаимодействовать с анализируемыми частицами и изменять их электрофоретическую подвижность. Этот метод известен также как капиллярный зонный электрофорез (КЗЭ). Нейтральные компоненты не разделяются этим методом, все они мигрируют в зоне ЭОП. Мицеллярная электрокинетическая капиллярная хроматография(МЭКХ) метод разделения, основанный на комбинации электрофоретического и хроматографического принципов. В состав буферного раствора вводят поверхностно-активное вещество (ПАВ), которое формирует псевдостационарную мицеллярную фазу. Нейтральные компоненты пробы распределяются между этой фазой и буферным раствором согласно их гидрофобности. Время миграции мицеллыэкспериментально определяют как время миграции компонента, полностью удерживаемого мицеллярной фазой. Маркером мицелл, например, является краситель судан 3. Физико-химические основы метода капиллярного электрофореза Метод КЭ основан на разделении заряженных компонентов сложной смеси в кварцевом капилляре под действием приложенного электрического поля. Микрообъем анализируемого раствора (около 2 нл) вводят в капилляр, предварительно заполненный подходящим буферным электролитом. После подачи высокого напряжения (до 30 кВ) к концам капилляра компоненты смеси начинают двигаться с разной скоростью, зависящей от заряда, массы и величины ионного радиуса, и, соответственно, в разное время достигают зоны детектирования. Полученная последовательность пиков называется электрофореграммой; качественной характеристикой вещества является время миграции, а количественной высота или площадь пика, пропорциональные концентрации вещества. Рассмотрим процессы, происходящие в капилляре, заполненном электролитом и помещенном в продольное электрическое поле. Находящиеся на поверхности кварца силоксановые группы при контакте с водой гидролизуются с образованием удвоенного количества силанольных групп, которые затем гидратируются: 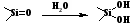 В водном растворе силанольные группы способны к кислотной диссоциации. При рН=2,5 диссоциация силанольных групп практически полностью подавлена, поверхность кварца электронейтральна и не несет никакого заряда. При рН > 2,5 поверхность кварца приобретает некоторый отрицательный заряд, который возрастает при увеличении рН раствора. Константа равновесия ионизации Ка поверхностных силанольных групп SiOH (Si-OH Si-O + Н+) имеет величину порядка 10-7 и характеризует поверхность кварца как слабую кислоту. Диссоциация силанольных групп вызывает на границе раздела кварц – водный раствор электролита образование двойного электрического слоя (ДЭС), рис. 1а. Первую его обкладку составляют неподвижные отрицательно заряженные силанольные группы. Вторую обкладку двойного слоя составляют положительно заряженные катионы, существующие в растворе. Диэлектриком, разделяющим обкладки этого конденсатора, являются молекулы воды, сольватирующие как силанольные группы, так и катионы.  Рис. 1а. Строение двойного электрического слоя. Положительная часть ДЭС делится на две части: первую (неподвижную), непосредственно примыкающую к поверхности кварца, и вторую (диффузную), располагающуюся на некотором удалении от поверхности. В неподвижной части количество положительных зарядов меньше, чем отрицательных зарядов на поверхности кварца из-за увеличения размеров катионов вследствие гидратации. В результате в диффузной части ДЭС образуется избыточная концентрация катионов. Между этими двумя слоями проходит т. н. граница скольжения при наложении вдоль капилляра электрического поля неподвижная часть остается на месте, в то время как диффузная часть начинает мигрировать к катоду, увлекая за собой за счет межмолекулярного сцепления всю массу жидкости в капилляре. Возникает электроосмотический поток (ЭОП), который осуществляет пассивный перенос раствора внутри капилляра. Скорость ЭОП определяется рН: в сильнокислых растворах ЭОП отсутствует, в слабокислых его скорость незначительна, а при переходе в нейтральную и щелочную область рН скорость ЭОП возрастает до максимальной. С другой стороны, эта величина зависит от концентрации электролита в ведущем буфере: чем она больше, тем выше становится доля катионов в неподвижной части ДЭС, а толщина диффузной части уменьшается и, соответственно, уменьшается скорость ЭОП. На рис. 1б показано распределение зарядов в ДЭС. Общий потенциал (), создаваемый диссоциированными силанольными группами, пропорционален заряду поверхности кварца. Часть этого потенциала () нейтрализуется положительными зарядами ионов неподвижной части второй обкладки двойного слоя. Остальная часть положительных зарядов создает в приповерхностном слое раствора электрокинетический или потенциал (дзета-потенциал).  Рис. 1б. Распределение зарядов в ДЭС. Уникальное свойство ЭОП заключается в плоском профиле потока (в отличие от параболического в ВЭЖХ), который при движении зон компонентов внутри капилляра практически не вызывает их уширения (рис. 2). Благодаря этому метод КЭ характеризуется высочайшей эффективностью (105 107 теоретических тарелок). 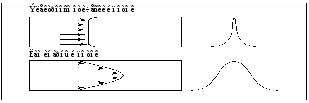 Рис. 2. Влияние профиля потока на ширину зоны вещества. В приборах для капиллярного электрофореза капилляр, заполненный раствором электролита, своими концами опущен в два содержащих тот же электролит сосуда, в которые введены электроды. Электролит должен обладать буферными свойствами, чтобы препятствовать изменению состава раствора в приэлектродных пространствах и стабилизировать состояние компонентов пробы в процессе анализа. При подаче на электроды высокого напряжения в капилляре быстро устанавливается стационарное состояние: через капилляр протекает постоянный ЭОП, на который накладывается взаимно противоположная электромиграция катионов и анионов. Если в капилляр со стороны анода ввести небольшой объем раствора пробы, то ЭОП будет переносить эту зону к катоду в область детектирования, и зона некоторое время будет находиться в капилляре под воздействием электрического поля высокого напряжения. В течение этого времени заряженные компоненты пробы будут перемещаться в соответствии с их электрофоретическими подвижностями. Катионные компоненты пробы, двигаясь к катоду, будут обгонять электроосмотический поток. Скорость их движения складывается из скорости ЭОП и скорости электромиграции, поэтому на выходе капилляра катионы появляются первыми и тем раньше, чем больше их электрофоретическая подвижность. Нейтральные компоненты пробы перемещаются только под действием электроосмотического потока, тогда как анионные будут перемещаться к аноду со скоростями меньшими, чем скорость ЭОП. Медленно мигрирующие анионы появятся на выходе после ЭОП, а те, чья скорость электромиграции по абсолютной величине превышает скорость ЭОП, будут выходить из капилляра в прианодное пространство. Если время нахождения пробы в капилляре (которое можно регулировать изменением напряжения, величины рН и концентрации ведущего электролита) достаточно, чтобы проявились различия в подвижности ионов, то на выходе капилляра у катода наблюдаются зоны раствора, в которых находятся индивидуальные компоненты пробы. Ведущий электролит (рабочий буферный раствор) должен иметь такую концентрацию, при которой электрическое сопротивление раствора в капилляре будет достаточно велико. Это требование связано с тем, что при прохождении электрического тока в проводнике выделяется тепло. При чрезмерном нагреве и закипании жидкости пузыри пара прерывают ток в капилляре, что делает анализ невозможным. Выделяющаяся теплота расходуется на нагревание раствора, кварцевых стенок и полиимидной оболочки капилляра. Низкая теплоёмкость и высокая теплопроводность кварца способствуют эффективному отводу тепла во внешнюю среду, но без специальных мер жидкость в капилляре быстро закипает. Поэтому в приборах для КЭ всегда есть системы воздушного или жидкостного охлаждения. Тепловое равновесие в капилляре устанавливается достаточно быстро и характеризуется небольшим различием температуры раствора в радиальном направлении во внутреннем канале капилляра и устойчивым градиентом температур между внутренней и внешней стенками капилляра. Нагрев жидкости не вызывает появления конвективных потоков, так как нагревание происходит равномерно по всему просвету капилляра. В результате не происходит перемешивание жидкости, приводящее к размыванию зон определяемых компонентов. В зависимости от концентрации электролитов в растворах буфера и пробы поведение компонентов при разделении может несколько различаться. Если электропроводности ведущего электролита и пробы одинаковы, то падение напряжения на всей длине капилляра равномерно, и компоненты пробы равномерно перемещаются каждый с присущей ему скоростью. В этом случае на выходе капилляра (точнее, в зоне окна детектора) ширина пика будет приблизительно равна ширине зоны пробы (если пренебречь размыванием). Следовательно, эффективное разделение может быть достигнуто при введении возможно меньшего объема пробы (но для обеспечения необходимой чувствительности концентрация определяемых компонентов в пробе должна быть возможно выше). Иное поведение наблюдается в случае, если электропроводность раствора пробы меньше электропроводности ведущего электролита. В этом случае в капилляре появляется участок с высоким сопротивлением и в соответствии с законом Ома падение напряжения на участке, занятом пробой, возрастает во столько раз, во сколько раз сопротивление пробы больше, чем сопротивление равного участка ведущего электролита. Таким образом, если сопротивление раствора пробы в капилляре будет в 10 раз больше, чем сопротивление ведущего электролита, градиент потенциала в зоне пробы будет в 10 раз выше, чем в остальной части капилляра. Высокий градиент потенциала в зоне пробы заставляет компоненты пробы быстрее мигрировать к границе зоны, где они в сконцентрированном и предварительно разделенном виде переходят в ведущий электролит, и там продолжают, но уже медленнее, движение к детектору. Описанное явление называется стекингоми широко используется в практике. Оно позволяет получать очень узкие пики определяемых компонентов и, как следствие, концентрация их в пике оказывается значительно выше, чем в исходной пробе. Практически стекинг осуществляется путем разбавления пробы перед вводом специальным буферным раствором (с концентрацией в 10 раз меньше, чем в рабочем буферном растворе) или дистиллированной водой. В случае, когда электропроводность раствора пробы больше, чем электропроводность ведущего электролита, падение напряжения на участке пробы резко уменьшается. В результате скорость электромиграции компонентов пробы уменьшается, они медленнее достигают границы зоны, а при переходе в ведущий электролит скорость их движения увеличивается. Происходит размывание пиков, они накладываются друг на друга, эффективность разделения резко ухудшается. В методе КЭ тонкий кварцевый капилляр, выполняющий основную разделяющую функцию, также служит электролитическим мостиком, замыкающим электрическую цепь. В электрических цепях, содержащих одновременно проводники первого и второго рода, протекание тока невозможно без электрохимических реакций на границах металл–раствор. В КЭ стараются использовать такие составы буферных ведущих электролитов, в которых на электродах происходит разложение воды (одним из самых распространенных буферов является раствор буры). На катоде происходит восстановление Н+, выделение Н2 и образование в прикатодном пространстве ОН-. На аноде окисление ОН-, выделение О2 и образование в прианодном пространстве Н+. На катоде: 2Н2О + 2е Н2 + 2ОН На аноде: 4Н2О – 4е О2 + 4Н+ Эти два элементарных акта электрохимических реакций на электродах эквивалентны переходу через раствор электронов. Образующиеся ионы ОН и Н+ нейтрализуются буферными компонентами ведущего электролита: при использовании боратного буфера в прикатодном слое борной кислотой, в прианодном борат-ионом. Таким образом, в приэлектродных пространствах происходит лишь изменение мольного соотношения компонентов буферной смеси, приводящее к незначительному изменению рН раствора. Нарушение стехиометрии растворов, т. е. образование в приэлектродных слоях избыточных концентраций катионов (в прианодном) и анионов (в прикатодном), а также нарушение электрического баланса в приэлектродных слоях вызывают электромиграцию избыточных ионов ведущего электролита во взаимно противоположных направлениях по эстафетному механизму. Каждый элементарный акт электродных реакций заставляет всю массу ионов в растворе переместиться на величину межионного расстояния в растворе. Скорость перемещения такова, что во всём объёме капилляра в любой его точке и в любой момент времени соблюдается электронейтральность раствора. На рис. 4 показано расположение капилляра и электрода в пробирке с раствором электролита, принятое в системах «Капель». 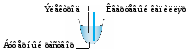 Рис. 4. Типичное расположение капилляра и электрода в пробирке с раствором. Устье капилляра располагается в нижней трети объёма пробирки; электрод находится в верхней трети раствора. При таком расположении продукты электрохимических реакций пузырьки газов и раствор ведущего электролита, содержащий продукты нейтрализации и отличающийся по составу от первоначального, не могут проникнуть в просвет капилляра. В то же время расход ведущего электролита вследствие ЭОП происходит за счет неизменённого раствора из средней трети объёма. Расчет показывает, что за 5–6 анализов буферная емкость ведущего электролита исчерпывается полностью. Для получения воспроизводимых результатов необходимо в среднем через каждые 3–4 анализа заменять свежими порциями растворы ведущего электролита в рабочих пробирках. Основные варианты капиллярного электрофореза Капиллярный зонный электрофорез (КЗЭ) является самым простым вариантом КЭ. Компоненты сложной смеси движутся в среде электролита с разными скоростями, образуя дискретные зоны. Отличительная особенность КЗЭ состоит в том, что он пригоден для разделения только ионогенных компонентов пробы, тогда как нейтральные соединения, не обладающие собственной электрофоретической подвижностью, движутся со скоростью ЭОП и выходят в зоне нейтральных компонентов, зоне маркера ЭОП. В приборах КЭ с кварцевым капилляром полярность входного конца чаще всего положительная (анод), и ЭОП переносит зону пробы к катоду. Вблизи катодного выхода установлен детектор. При этих условиях катионные компоненты пробы, тоже мигрируя к катоду, обгоняют ЭОП и первыми достигают детектора в виде отдельных зон, которые на электрофореграмме регистрируются индивидуальными пиками. Через некоторое время детектора достигает зона исходного раствора, в которой остались нейтральные компоненты пробы. В зависимости от того, поглощают они или нет, на электрофореграмме регистрируется прямой (или обратный) системный пик. Для идентификации системного пика в пробу добавляют соединения маркеры ЭОП, например, бензиловый спирт. Что касается анионных компонентов пробы, то их поведение зависит от соотношения скоростей ЭОП и электромиграции анионов. Если скорость миграции аниона превышает скорость ЭОП, то такой анион рано или поздно выйдет из капилляра в прианодное пространство. Если же скорость электромиграции аниона меньше скорости ЭОП, то такой анион может быть зарегистрирован на той же электрофореграмме после выхода системного пика. В этом варианте КЗЭ с положительной полярностью определяются катионные компоненты проб и большинство органических анионов. Чтобы методом КЗЭ можно было определять все анионные компоненты проб (в основном, неорганические) необходимо изменить полярность прикладываемого напряжения. Однако в этом случае изменится не только направление миграции анионов, но также направление ЭОП. Для преодоления этого противоречия необходимо модифицировать поверхность кварцевого капилляра так, чтобы знаки зарядов двойного электрического слоя поменялись на обратные. Это достигается введением в рабочий буферный раствор катионного поверхностно-активного вещества, например, бромида цетилтриметиламмония (ЦТАБ). Катион ЦТА+ активно сорбируется на кварцевой поверхности, занимая при достаточной его концентрации все вакансии в ближайшем к поверхности слое. Поверхность как бы «ощетинивается» длинными цетильными (С16Н33) цепочками. Ставшая гидрофобной поверхность при дальнейшей промывке рабочим буферным раствором сорбирует еще один слой поверхностно-активного катиона, ориентированного аммонийным концом наружу (сорбция «щетка в щетку»). В результате первый слой двойного электрического слоя становится положительным, а второй, включая диффузную часть, отрицательным, и ЭОП снова движется от входного конца к детектору, несколько отставая от мигрирующих быстрее анионов. Повышение селективности КЗЭ может быть достигнуто за счет изменения рН ведущего электролита и введения в состав буфера различных добавок: ПАВ, макроциклов, органических растворителей. Мицеллярная электрокинетическая хроматография (МЭКХ) объединяет электрофорез и хроматографию; получила наиболее широкое распространение среди других вариантов капиллярного электрофореза за счет способности разделять как ионогенные, так и незаряженные компоненты пробы. Разделение нейтральных соединений стало возможным благодаря введению в состав ведущего электролита поверхностно-активных веществ (ПАВ) мицеллообразователей. Чаще всего используют анионные ПАВ (например, додецилсульфат натрия ДДСН) в концентрациях выше критической концентрации мицеллообразования (ККМ), которая для ДДСН в водном растворе составляет 8 мМ. В этом случае в растворе электролита находятся преимущественно мицеллы и небольшая доля мономерной формы ПАВ. Мономеры состоят из гидрофобного «хвоста» и гидрофильной (в случае анионного ПАВ отрицательно заряженной) «головы». При формировании прямых мицелл мономерные фрагменты агрегируются неполярными концами внутрь, а внешняя сферическая поверхность мицеллы становится отрицательно заряженной. Каждая мицелла окружена собственным двойным электрическим слоем (ДЭС), внешнюю диффузную часть которого формируют катионы, присутствующие в растворе ведущего электролита. Число мономеров, образующих мицеллу, может колебаться от 60 до 100 молекул, однако общий заряд мицеллы существенно меньше из-за наличия в неподвижной части второго слоя ДЭС гидратированных катионов. Ни мицеллярная, ни мономерная форма АПАВ не взаимодействуют со стенкой кварцевого капилляра, но при подаче на капилляр высокого напряжения обе формы мигрируют к аноду, в то время как ЭОП направлен к катоду. Если в капилляр на анодной стороне ввести пробу, содержащую нейтральные и заряженные компоненты, то ЭОП будет переносить их к катоду, а навстречу будет двигаться поток отрицательно заряженных мицелл АПАВ. Нейтральные компоненты пробы распределяются между фазой раствора и мицеллярной фазой, причем константа распределения специфична для каждого соединения. В результате на выходе капилляра регистрируется электрофореграмма нейтральных компонентов, а также медленно мигрирующих анионов пробы. Аппаратура Общее устройство систем КЭ Минимальный состав системы, реализующей метод капиллярного электрофореза, должен включать следующие узлы: кварцевый капилляр, источник высокого напряжения, устройство ввода пробы, детектор и систему сбора, обработки и вывода информации (рис. 5). 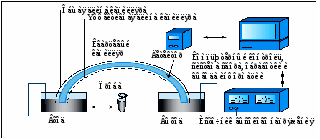 Рис. 5. Устройство системы капиллярного электрофореза. Дополнительными устройствами в системах КЭ являются автосемплер и блок жидкостного охлаждения капилляра. Капилляры В системах КЭ используют капилляры из кварца, прозрачного в УФ-области спектра, с внешним полиимидным защитным покрытием. В случае детектирования внутри капилляра (on-line) полиимидное покрытие в зоне детектирования снимают, оставляя для прохождения света зону чистого кварца. Внутренний диаметр капилляров обычно составляет 50 или 75 мкм, внешний диаметр 365 мкм, длина капилляров 20–100 см. Различают общую (Lобщ) и эффективную (Lэфф) длину капилляра: в первом случае речь идет о полной длине капилляра от входного до выходного конца, а во втором об участке от входного конца до зоны детектирования (рис. 5). Большинство разделений в КЭ ведут на непокрытых изнутри немодифицированных капиллярах. Их подготовка к анализу начинается с промывки раствором щелочи для обеспечения диссоциации силанольных групп кварца и возникновения ЭОП. Анализ соединений, способных адсорбироваться на стенках кварцевого капилляра (белки, красители), или необходимость обращения ЭОП требуют использования покрытых капилляров (ковалентные покрытия или динамические). В зоне ввода пробы торцевой срез должен быть выполнен строго под углом 90° к боковым стенкам капилляра. В противном случае наблюдаются пики с «хвостами» или невоспроизводимый ввод пробы. С точки зрения анализа кондиционное состояние капилляра следует понимать так, что выполняемые последовательно анализы должны быть воспроизводимы по временам миграции пиков и по площадям пиков. Общая скорость электромиграции иона складывается из скорости движения иона под действием электрического поля и скорости движения ЭОП. Первая зависит от природы иона, а вторая от свойств диффузной части двойного электрического слоя в капилляре, мерой которой является -потенциал поверхности. Причиной нестабильности времен миграции может служить изменение диффузной части второй обкладки двойного электрического слоя. Различные примеси из ведущего электролита и растворов проб, сорбируясь на поверхности капилляра, уменьшают -потенциал и, следовательно, увеличивают времена миграции компонентов. Сорбция может быть обратимой или практически необратимой в зависимости от химической природы примесей и состава электролита. Одновременно изменение времени миграции пика изменяет его ширину и площадь (площадь пика пропорциональна времени миграции: поздно мигрирующие компоненты перемещаются через зону детектирования медленнее). При подготовке к работе капилляр обычно промывают раствором кислоты, водой и раствором щелочи. Цель первой операции заключается в удалении с поверхности примесей, в частности, многовалентных катионов, и первичном гидролизе силоксановых групп. Промывка водой способствует удалению кислоты и дальнейшему гидролизу поверхности. Наконец, щелочная промывка предназначена для удаления примесей, не реагирующих с кислотой, и максимальной диссоциации образовавшихся силанольных групп. Финишная промывка водой имеет целью удалить из капилляра щелочь. Для того чтобы теперь привести очищенную и подготовленную поверхность в равновесие с раствором ведущего электролита, капилляр промывают собственно раствором ведущего электролита. При правильно проведенном кондиционировании времена миграции контрольных или тестовых веществ остаются постоянными при последовательных вводах. Если времена миграции тестовых веществ уменьшаются, это свидетельствует о недостаточном времени кондиционирования. При анализе на поверхности кварца могут сорбироваться различные примеси: многовалентные катионы, склонные к образованию гидроксокомплексов, катионные ПАВ, вещества белковой природы, обладающие свойствами амфолитов, нефтепродукты, некоторые полимеры и т. п. Все они нарушают структуру диффузного слоя и уменьшают -потенциал, что приводит к уменьшению скорости ЭОП и к увеличению времени миграции анализируемых ионов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
