Хронический панкреатит, кисты, свищи и опухоли поджелудочной железы
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
Лечение при панкреатогенных свищах Лечение при наружных неполных свищах, в основном консервативное, так как свищи обычно закрываются самостоятельно. При ежедневной потере панкреатического сока через свищ до 500 мл и более необходима компенсация белков и электролитов. Для улучшения оттока панкреатического сока назначаются спазмолитики. Для снижения внешней секреции исключается сокогенная диета, назначают препараты угнетающие секрецию (атропин, сандостатин и др.). Показанием к оперативному вмешательству является наличие: полных и неполных свищей со значительной потерей секрета; длительно существующих свищей. Полные или терминальные наружные свищи могут быть ликвидированы путем пломбировки (окклюзии) протоковой системы полимерными материалами или оперативным путем. Наиболее распространенной операцией при них является: фистулоэнтероанастомоз или фистулогастроанастомоз, а также продольная панкреатоеюностомия. При свищах хвоста поджелудочной железы возможна резекция хвоста. При наличии гнойно-некротической полости необходимо удалить некротизированные ткани и провести наружное дренирование. Опухоли поджелудочной железы Доброкачественные опухоли поджелудочной железы Доброкачественные опухоли поджелудочной железы встречаются крайне редко. К ним относят липомы, миксомы, папилломы, лимфангиомы, гемангиолимфомы, гемангиомы, невриномы, фибромы, ганглионевромы и солидные аденомы поджелудочной железы. Как видно из приведенных названий опухолей, они развиваются из различных тканей: эпителиальной, соединительной, сосудистой, мышечной, нервной. Бывают опухоли сложного строения (энтерокистомы и дермоиды). Несмотря на патологоанатомические различия в строении, перечисленные опухоли имеют общие клинические симптомы, схожие с симптомами кист поджелудочной железы. В диагностике основным является наличие образования в области поджелудочной железы при пальпаторном исследовании органов брюшной полости. При рентгенологическом исследовании выявляются признаки, аналогичные кистам поджелудочной железы. Применение УЗИ, КТ или МРТ не позволяет окончательно установить диагноз. Характер опухоли устанавливается только после гистологического исследования. Больные с доброкачественными опухолями поджелудочной железы подлежат хирургическому лечению. Рак поджелудочной железы Составляет 62% всех раков панкреатобилиарной зоны. Заболеваемость составляет 8,7-9,3 случаев на 100 тыс. населения. От всех раковых поражений рак поджелудочной железы составляет около 7%. Мужчины болеют в 1,5 раза чаще, чем женщины. Локализация опухоли поджелудочной железы от 50 до 80% встречается в головке поджелудочной железы. В 80-90 % случаев опухоль является аденокарциномой. По объему опухоль бывает в диаметре не более 5-8 %. Наиболее частое метастазирование проходит в перипанкреатические лимфоузлы, реже — в парааортальные и в печень, значительно реже — в легкие, мозг, кости, почки и кожу. Опухоль часто прорастает в соседние органы. Вокруг опухоли в поджелудочной железе всегда развивается хронический склеротический процесс. Протоки поджелудочной железы расширяются, а окружающие их ткани склерозируются. Классификация рака поджелудочной железы в системе TNM Т 0 — первичная опухоль не определяется; Т 1 — опухоль ограничена поджелудочной железой; Т 1а — опухоль до 2 см в наибольшем измерении; Т 1б — опухоль более 2 см в наибольшем измерении; Т 2 — опухоль распространяется на любую из следующих структур: двенадцатиперстную кишку, желчный проток, ткани около поджелудочной железы; Т 3 — опухоль, распространяющаяся на любую из следующих структур: желудок, селезенку, ободочную кишку, прилежащие крупные сосуды; N 0 — нет признаков метастатического поражения регионарных лимфатических узлов; N 1 — регионарные лимфатические узлы поражены метастазами; М — отдаленные метастазы в печени, легких, почках, костях. Клиническая картина рака поджелудочной железы зависит от локализации опухоли, от взаимоотношения с общим желчным протоком, Вирсунговым протоком, двенадцатиперстной кишкой и сосудами забрюшинного пространства. Наиболее частым признаком рака поджелудочной железы или большого дуоденального сосочка является боль в эпигастрии и правом подреберье. Желтуха сопровождает опухоли поджелудочной железы и большого дуоденального сосочка у 90—95 % больных. Кожный зуд встречается в более позднем периоде заболевания или вовсе отсутствует. Кроме перечисленных признаков, отмечаются диспепсия, похудание, снижение аппетита, стеаторея. При локализации опухоли в теле и хвостовой части железы боли могут носить опоясывающий характер и иррадиировать в оба подреберья. Боли при опухоли в хвосте поджелудочной железы локализуются в левом подреберье и иррадиируют в подмышечную область, а иногда в левое плечо. В начальном периоде заболевания отмечаются: нелокализованные боли чаще в эпигастрии после еды, чувство переполнения в желудке, отрыжка, тошнота, изжога, иногда рвота, нарастающая слабость. Пальпаторно опухоль поджелудочной железы или большого дуоденального сосочка не определяется. При сдавлении общего желчного протока на фоне желтухи определяется увеличенный, безболезненный желчный пузырь — симптом Курвуазье. Диагноз опухоли поджелудочной железы и большого дуоденального сосочка иногда представляет трудности, так как необходимо дифференцировать опухоль с паренхиматозной желтухой, желчнокаменной болезнью и поражением внепеченочных желчных путей. Наиболее трудно отдифференцировать рак поджелудочной железы от хронического панкреатита, рака желудка и толстой кишки в поздних стадиях процесса. С целью установления диагноза применяют ультразвуковое исследование поджелудочной железы, фиброгастродуоденоскопию, ретроградную холангио-панкреатографию и при необходимости компьютерную или магнитно-резонансную томографию. Окончательный дифференциальный диагноз рака поджелудочной железы от хронического панкреатита проводят во время интраоперационной биопсии. Лечение больных раком поджелудочной железы и большого дуоденального сосочка только оперативное — панкреатодуоденальная резекция (см. выше), субтотальная резекция поджелудочной железы или панкреатэктомия. Эндокринные опухоли поджелудочной железы В 1869 г. Лангерганц [Langerhans], медицинский студент Университета Фридриха Вильгельмса [Friedrich Wilhelms] в Берлине, представил свою диссертацию как кандидат на степень Доктора Медицины и Хирургии по микроанатомии поджелудочной железы и описал клеточные островки, которые теперь носят его имя. Физиологическая функция и важность этих клеток тогда еще не были известны, и только в 1922 г., после выделения инсулина, Бантинг [Banting] и Бест [Best] установили роль поджелудочной железы как эндокринного органа. Николс [Nicholls] в 1902 г. описал первую аденому, берущую начало из островков Лангерганца, а в следующем году, Фабоцци [Fabozzi] (1903 г.) описал первую карциному. У врачей, в частности хирургов, с тех пор возник интерес к этим опухолям, и этот интерес был культивирован развитием и применением методик радиоиммунологического обследования, которые прояснили роль ранее известных гормонов и помогли идентифицировать много новых. Эндокринные опухоли поджелудочной железы встречаются редко, с предполагаемой частотой, составляющей 1 – 5 случаев на 1 миллион человек ежегодно. В сообщениях об исследованиях, основанных на данных аутопсий, эта частота составила от 0,5% до 1,5%. Традиционно полагали, что эндокринные опухоли поджелудочной железы являются производными клеток APUD-системы [amine precursor uptake decarboxylase system], которые эволюционировали непосредственно из островков Лангерганца. В более современных исследованиях предполагается, однако, что они могут образовываться из плюрипотентных клеток в протоковом и ацинарном эпителии. Эндокринные опухоли поджелудочной железы часто манифестируют хорошо описанными клиническими синдромами, непосредственно связанными с гормонами, которые эти опухоли секретируют. Эти синдромы включают гипогликемию, вторичную по отношению к инсулиноме; фульминантный диатез пептических язв при синдроме Золлингера-Эллисона [Zollinger-Ellison]; водянистую диарею, гипокалиемию и ахлоргидрию при синдроме Вернера-Моррисона [Verner-Morrison]; диабет и кожную сыпь при синдроме глюкагономы; гипергликемию, стеаторрею и холелитиаз при соматостатиноме. Некоторые эндокринные опухоли поджелудочной железы не имеют каких-либо клинических проявлений гормональной секреции, их называют нефункционирующими. Эти нефункционирующие опухоли все более и более часто идентифицируются и диагностируются с помощью широкого применения визуализирующих методик обследования брюшной полости и забрюшинного пространства. За исключением инсулиномы, эндокринные опухоли поджелудочной железы часто метастазируют перед своей клинической манифестацией. Даже при метастатической болезни их течение может быть безболезненным. Злокачественное развитие не может быть определено в соответствии с гистопатологическими характеристиками этих опухолей, но требует доказательства локальной инвазии или отдаленного распространения. Генетическое предрасположение для возникновения эндокринных опухолей поджелудочной железы является самым сильным при синдроме MEN I, характеризующемся развитием множественной железистой гиперплазии паращитовидных желез, опухолей островковых клеток поджелудочной железы и аденом гипофиза. Почти у половины всех пациентов с MEN I развиваются манифестирующие эндокринные опухоли поджелудочной железы, и у 100% этих пациентов выявляются небольшие, нефункционирующие эндокринные опухоли поджелудочной железы при гистологическом исследовании железы. Приблизительно у 25% пациентов с гастриномой и у 8% пациентов с инсулиномой имеет место MEN I. Диагностика функционирующих эндокринных опухолей поджелудочной железы может быть затруднительной. Поскольку они встречаются весьма редко, клиницисты часто забывают подумать о них. Кроме того, симптомы могут быть не столь уж драматическими, как можно было ожидать, поскольку пациенты могут быть компенсированы. Пациенты с инсулиномой могут изменять свой рацион, чтобы избежать гипогликемии, а пациенты с гастриномой могут принимать препараты, направленные на решение проблем типа гастро-эзофагеальной рефлюксной болезни и диареи. Клиницист сначала должен предположить, что симптомы пациента могут быть проявлением опухоли островковых клеток. Это распознавание должно привести его к подтверждающему лабораторному обследованию, устанавливающему повышение соответствующего гормона количественными радиоиммунологическими обследованиями сыворотки крови. Различные провокационные тесты и соотношение гормонов могут помочь исключить связанные расстройства. Нефункционирующие эндокринные опухоли поджелудочной железы все более и более часто идентифицируются как случайная находка при современных визуализирующих методах обследования или во время внутрибрюшных операций. Вообще, идеальное лечение эндокринных опухолей поджелудочной железы – резекция этого органа, поскольку только она может быть радикальной. Для пациентов с нерезектабельной опухолью или метастатической болезнью, симптоматический контроль гормональных эффектов и замедление прогрессирования опухоли с помощью химиотерапии – основа паллиативных мероприятий. ИНСУЛИНОМА Инсулинома – самая частая функционирующая эндокринная опухоль поджелудочной железы, частота которой среди других, по данным некоторых исследований, составляет до 60% и более. Опухоль встречается немного более часто у женщин, чем у мужчин, и обычно выявляется у пациентов 40 – 50 лет. Эти опухоли имеют превосходный потенциал для полного излечения после хирургического удаления, поскольку представляют собой в большинстве случаев – небольшие, солитарные, доброкачественные поражения. Клиническая картина У пациентов с инсулиномой сначала проявляются симптомы и признаки гипогликемии, которая может быть подразделена на нейрогликопенический и симпатоадреналовый типы. Поскольку для центральной нервной системы абсолютно необходима глюкоза как энергетический субстрат, симптомы гипогликемии имеют преимущественно нейрогликопеническое происхождение. Когда у данных пациентов возникает гипогликемия, они часто жалуются на головные боли и нечеткое зрение. Они нередко неспособны думать последовательно, забывчивы и часто отличаются причудливым и нетипичным поведением. У пациентов с гипогликемией могут наблюдаться припадки, моторная дискоординация, трудности с речью и направленными движениями. Самое тяжелое проявление гипогликемии – кома. Другие клинические признаки инсулиномы происходят из-за активации автономной нервной системы. Гипогликемия – стресс, который приводит к выбросу катехоламинов. Эта симпатоадреналовая реакция вызывает чрезмерное потоотделение, слабость, тахикардию, дрожь, чувство страха и нервозность. Пища обычно уменьшает нейрогликопенические и симпатоадреналовые симптомы. Пациенты с инсулиномой знают это и увеличивают частоту приемов пищи, чтобы избежать атак гипогликемии. Следовательно, пациенты с инсулиномой часто отмечают увеличение веса в последнее время. Голод, тошнота и рвота также могут иногда иметь место. Диагностика и определение локализации Традиционно, триада Виппля [Whipple] подводила итог клинической картины и диагноза у пациента с инсулиномой. Эта триада состоит из индукции признаков и симптомов гипогликемии после ограничения приема пищи или физических упражнений, характерного снижения уровня глюкозы плазмы крови меньше 50 мг/дл, и уменьшения симптомов после перорального или внутривенного введения глюкозы. Эта триада имеет недостатки в точности и надежности, которые необходимы для современного диагноза. Сегодня диагноз инсулиномы требует проведения радиоиммунологического исследования инсулина сыворотки крови и демонстрации того, что циркулирующий инсулин неадекватно увеличен по сравнению с уровнем глюкозы крови. После мониторируемого голода до развития симптомов гипогликемии или немногим ранее, чем через 72 часа, обычно измеряются концентрации инсулина и глюкозы плазмы крови. Примерно у 3/4 пациентов развивается гипогликемия и ее симптомы в течение 24 часов, а практически у всех пациентов (90-95%) – в течение 48 часов. Соотношение инсулин-глюкоза, составляющее больше 0,4, говорит о наличии инсулиномы. Уровни C-пептида и проинсулина также повышены у пациентов с инсулиномой. Провокационные тесты с толбутамидом, глюкагоном или внутривенным введением кальция редко требуются для диагностики инсулиномы. Эти исследования должны использоваться с осторожностью, поскольку они могут вызвать опасную гипогликемию. Дифференциальная диагностика инсулиномы проводится с реактивной гипогликемией, хронической надпочечниковой недостаточностью, гипопитуитаризмом, печеночной недостаточностью, патомимической (искусственно вызванной) гипогликемией, ферментативными дефектами и незидиобластозом. Гипогликемия при инсулиноме обычно встречается при голодании или после физических упражнений, тогда как реактивная гипогликемия возникает после еды. Измерение уровней циркулирующего проинсулина и C-пептида может помочь исключить патомимическую гипогликемию, поскольку эти вещества не присутствуют при введении коммерчески доступных препаратов инсулина. Скрининг сыворотки крови и мочи на выявление метаболитов сульфонилмочевины может исключить их тайное употребление. Незидиобластоз или первичная гиперплазия островковых клеток может потребовать взятия биопсии во время операции для дифференциальной диагностики с инсулиномой. У большинства пациентов с инсулиномой имеет место солитарная доброкачественная аденома. Эти аденомы встречаются с одинаковой частотой в головке, теле и хвосте поджелудочной железы. Множественные аденомы встречаются у 10% пациентов, чаще у больных с MEN I. Кроме того, у 10% пациентов имеют место злокачественные инсулиномы, представленные либо локальным распространением, либо метастазами. Большинство инсулинóм меньше 1,5 см в диаметре. Многие из них полностью окружены тканью поджелудочной железы и не видны на ее экспонированной поверхности. До появления возможности предоперационных исследований определения локализации и интраоперационного УЗИ 25% инсулинóм не выявлялись во время операции, несмотря на полное хирургическое обследование поджелудочной железы. Предоперационное определение локализации опухоли может быть чрезвычайно полезным для хирурга и уменьшить число безрезультатных ревизий. Трансабдоминальное УЗИ, компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) не всегда могут определить локализацию инсулинóм, вследствие их малых размеров. Из-за широкого распространения, однако, КТ обычно является первым из выполняемых исследований по определению локализации опухоли, обнаруживая как минимум две трети поражений. При наличии возможности использование двухфазной спиральной КТ-технологии более чувствительно для выявления небольших инсулинóм. КТ и МРТ полезны при идентификации наличия или отсутствия метастазов в перипанкреатических лимфатических узлах или в печени. Поскольку только 30% инсулинóм обладают рецепторами к соматостатину II типа, значение сцинтиграфии рецепторов соматостатина (СРС) ограничено. Исторически сложилось, что селективная ангиография поджелудочной железы была исследованием выбора для выявления инсулинóм, которые обычно очень хорошо васкуляризированы. Чрескожный чреспеченочный порто-венозный сэмплинг и внутриартериальная стимуляция кальцием с печено-венозным сэмплингом еще более чувствительны. При чрескожном чреспеченочном порто-венозном сэмплинге, забор инсулина из вен поджелудочной железы может помочь идентифицировать локализацию инсулиномы. Печеночно-венозный сэмплинг включает селективную инфузию кальция в ветви чревного ствола и верхней брыжеечной артерии с осуществлением забора крови из печеночных вен для выявления инсулина. Это инвазивные, дорогие, отнимающие много времени и технически сложные процедуры должны быть предназначены для персистирующего или рецидивирующего заболевания или при безуспешности другие исследований. Эндоскопическое УЗИ (ЭУЗИ) предлагает другой подход для предоперационного определения локализации инсулинóм (рис. 19). Опухоли в головке поджелудочной железы легко визуализируются, тогда как опухоли в дистальной части железы менее подходят для оценки с помощью ЭУЗИ. Качество ЭУЗИ зависит от оператора и требует седации пациента. Сообщается, что чувствительность и специфичность этой методики при обнаружении эндокринных опухолей поджелудочной железы составляет больше 90%. Комбинация ЭУЗИ и двухфазного КТ-сканирования должна выявлять почти все инсулиномы. 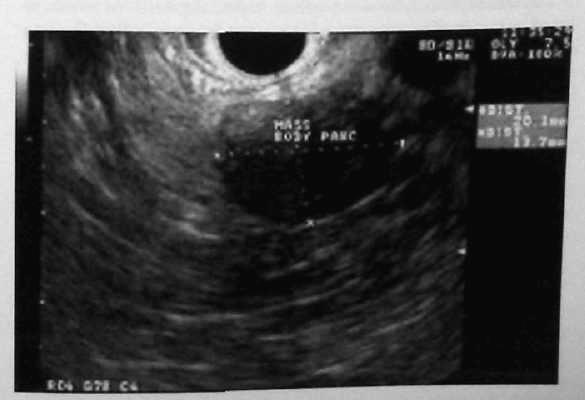 Рис. 19. ЭУЗИ инсулиномы. Развитие интраоперационного УЗИ значительно улучшило идентификацию инсулинóм во время интраоперационной ревизии. Польза интраоперационного УЗИ подчеркивается тем фактом, что некоторые хирурги подвергают сомнению необходимость предоперационных исследований по определению локализации опухоли. Хирургическая ревизия и пальпация в комбинации с интраоперационным УЗИ могут помочь локализовать 95-100% инсулинóм. |
