Хронический панкреатит, кисты, свищи и опухоли поджелудочной железы
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
|
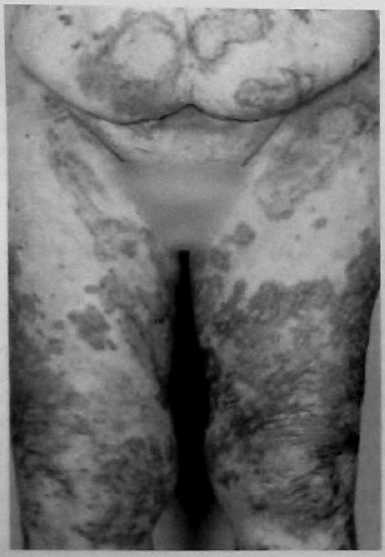
Лечение Медикаментозное лечение инсулинóм состоит из диетических мероприятий, минимизирующих опасность возникновения опасной гипогликемии. Разумный интервал между приемами пищи является решающим в устранении гипогликемии. Диазоксид ингибирует секрецию инсулина и может использоваться для предупреждения гипогликемии во время подготовки пациента к операции. Его негативные побочные эффекты включают выраженный отек и гирсутизм. Аналоги соматостатина, типа октреотида, также могут контролировать симптомы инсулиномы. Адекватное лечение при инсулиноме – оперативное удаление опухоли. Большинство аденом можно энуклеировать независимо от их локализации. Должна быть проявлена осторожность, чтобы не повредить панкреатический проток, выполняя энуклеацию. Для удаления опухолей, расположенных рядом с главным панкреатическим протоком, может потребоваться дистальная резекция поджелудочной железы, если они находятся в хвосте. Интраоперационное УЗИ полезно для идентификации расположения панкреатического протока при локализации опухоли, требующей энуклеации, в головке железы. При наличии больших опухолей в головке поджелудочной железы может потребоваться панкреатодуоденальная резекция (ПДР), поскольку высока возможность малигнизации; однако, это не является обычной практикой. Пациенты могут быть радикально излечены при идентификации аденомы и удалении ее при операции. Если после предоперационной визуализации при интраоперационной ревизии с полной мобилизацией поджелудочной железы, включая прием Кохера для возможности бимануальной пальпации всей железы, а также при интраоперационном УЗИ не возможно идентифицировать опухоль, не рекомендуется производить слепую резекцию. Если опухоль не выявлена, должен быть получен образец ткани поджелудочной железы путем биопсии, чтобы исключить незидиобластоз взрослых, который вообще может быть успешно излечен с помощью субтотальной резекции поджелудочной железы. Образец ткани получают при биопсии, удаляя небольшую часть самого дистального участка хвоста железы. Инсулиномы встречаются с равной частотой по всей поджелудочной железе, и есть небольшая причина полагать, что они более вероятно будут удалены при дистальной резекции поджелудочной железы. Лапароскопическая резекция выполнима, особенно при наличии интраоперационного УЗИ. Поскольку большинство инсулинóм являются одиночными, небольшими, хорошо инкапсулированными и доброкачественными, эти опухоли идеально подходят для лапароскопической резекции. Невозможность для хирурга пропальпировать опухоль пальцами во время лапароскопической операции и 10%-ный шанс наличия более чем одной опухоли является основанием для беспокойства. Хирург во время операции полагается на лапароскопическое интраоперационное УЗИ и предоперационные исследования по определению локализации опухоли. Если опухоль не может быть идентифицирована, нужно рассмотреть возможность конверсии до открытой операции, чтобы пропальпировать всю поджелудочную железу. Частота конверсии до открытой операции может уменьшиться с улучшением технологии и ростом хирургического опыта. У больных с метастатической болезнью должна быть рассмотрена возможность хирургической резекции опухоли и метастатических поражений, чтобы уменьшить симптомы гипогликемии. Часто, из-за безболезненной природы злокачественных инсулинóм, возможна продолжительная выживаемость. Средняя продолжительность жизни без симптомов заболевания, как было сообщено, составляет примерно 4 года у больных, подвергшихся радикальной резекции при злокачественном заболевании. Химиотерапия при злокачественных инсулиномах включает стрептозоцин в комбинации с другими средствами, включая 5-фторурацил или доксорубицин. ГАСТРИНОМА (СИНДРОМ ЗОЛЛИНГЕРА-ЭЛЛИСОНА) Эра кишечных гормонов началась в 1955 г., когда Золлингер и Эллисон сообщили о двух пациентах с тяжелым язвенным диатезом, связанным с не-инсулин-продуцирующими островковоклеточными опухолями поджелудочной железы. Gregory с соавторами в 1959 г. извлекли гастрин из слизистой оболочки антрального отдела желудка, а затем из опухоли поджелудочной железы, удаленной у пациента с синдромом Золлингера-Эллисона. Развитие методики радиоиммунологического обследования, позволяющей измерить уровень циркулирующего гастрина, способствовало установлению того, что синдром Золлингера-Эллисона, или ульцерогенный синдром, происходит вследствие продукции этого гормона не-бета-клеточной опухолью. Гастриномы – самые частые функционирующие злокачественные эндокринные опухоли поджелудочной железы. Несколько чаще встречаются у мужчин, средний возраст начала заболевания – 50 лет. Синдром Золлингера-Эллисона – частая манифестация панкреатического компонента MEN I, и как минимум 30% пациентов с гастриномой попадают в эту категорию. Больше половины MEN I–ассоциированных опухолей поджелудочной железы – гастриномы. Клиническая картина Клинические проявления гастриномы включают фульминантную болезнь пептических язв, диарею, или и то, и другое. Подозрение на синдром Золлингера-Эллисона не гарантирует его наличие у всех пациентов с болезнью пептических язв, но его нужно рассматривать у тех пациентов, у которых развиваются тяжелые язвенные симптомы в раннем подростковом возрасте или развиваются начальные симптомы раньше или позже в течение жизни. Диагноз также должен быть заподозрен у тех пациентов, у которых развиваются рецидивирующие пептические изъязвления после адекватной медикаментозной терапии или общепринятых операций. Это особенно справедливо, если рецидивирующая язва развивается в ранний послеоперационный период. У больных с синдромом Золлингера-Эллисона высокий уровень гастрина стимулирует париетальные клетки желудка, приводя к продукции больших объемов желудочного сока, содержащего высокую концентрацию кислоты. Это чрезмерное кислотопроизводство приводит к пептическим язвам. Другой частый симптом – диарея. Есть много причин возникновения диареи у этих пациентов, включая неспособность кишечника абсорбировать большие объемы жидкости, секретированной желудком, вызванное кислотой повреждение слизистой оболочки тощей кишки, осаждение желчных солей и инактивация панкреатической липазы при снижении pH. Диагностика и определение локализации Диагноз гастриномы требует подтверждения того, что уровень циркулирующего гастрина неадекватно высок по сравнению с уровнем секреции кислоты в желудке. Важность корреляции уровня циркулирующего гастрина с уровнем секреции кислоты в желудке может быть оценена, когда рассматриваются причины гипергастринемии. Сохраненный привратник, почечная недостаточность, синдром короткой кишки, атрофический гастрит, пернициозная анемия и макромолекулярная гипергастринемия связаны с повышенным уровнем циркулирующего гастрина. Кроме ситуации с сохраненным привратником только при синдроме Золлингера-Эллисона будут иметь место высокий уровень сывороточного гастрина и высокая кислотопродукция желудка. С увеличением использования исследования уровня сывороточного гастрина как скрининговой процедуры, пациентов стали идентифицировать по уровням кислотной гиперсекреции и сывороточного гастрина, которые увеличиваются, но не являются определенно диагностическими (150-500 пг/мл). Этим пациентам показан провокационный тест для постановки диагноза и скрининга пациентов с MEN I, у которых существует высокий риск развития гастринóм. Инфузия секретина при наличии гастриномы вызывает парадоксальное увеличение уровня сывороточного гастрина. Увеличение уровня сывороточного гастрина больше, чем на 200 пг/мл выше базального уровня является диагностически значимым для гастриномы. В отличие от инсулинóм гастриномы часто бывают мультифокальными, особенно у пациентов с MEN I. Гастриномы являются злокачественными примерно у 70% пациентов. Подобно большинству островковоклеточных опухолей они обычно медленно растут. Большинство гастринóм (70-90%) обнаруживают в треугольнике гастринóм, что описано Лос-Анжелесской группой Калифорнийского Университета под руководством Пассаро [Passaro]. Это анатомическая область, ограниченная точками слияния пузырного и общего желчного протоков, соединения тела и перешейка поджелудочной железы, а также соединения второй и третьей частей двенадцатиперстной кишки (рис. 20). При обычной ревизии двенадцатиперстной кишки дуоденальные гастриномы идентифицируются более часто, по меньшей мере, в два раза чаще, чем панкреатические гастриномы. Традиционные методики определения локализации включают трансабдоминальное УЗИ, КТ, МРТ, селективную висцеральную ангиографию, селективный венозный сэмплинг из ветвей воротной вены, внутриартериальную инфузию секретина с печеночно-венозным сэмплингом гастрина и обычную ФЭГДС. Более новые методики включают СРС и ЭУЗИ. В отличие от инсулинóм СРС оказалась эффективной при обнаружении гастринóм (рис. 21). Радиомаркированная форма аналога соматостатина – октреотида [октреоскан – прим. автора] может локализовать опухоли с высокоаффинными рецепторами соматостатина. В одном из исследований чувствительность СРС для первичных и метастатических поражений при гастриноме составила примерно 60%, равняясь по чувствительности вместе взятым УЗИ, КТ, МРТ и ангиографии. СРС еще более чувствительна при обнаружении метастатических поражений печени. ЭУЗИ также является многообещающим при выявлении гастринóм. Дуоденальные гастриномы, особенно гастриномы, которые являются небольшими по размеру, по прежнему трудно обнаружить. При использовании только СРС или только ЭУЗИ все еще можно не выявить примерно половину этих опухолей. Комбинация СРС и ЭУЗИ может помочь обнаружить больше 90% этих гастринóм. Когда предоперационные исследования по определению локализации не в состоянии обнаружить гастриному, должна быть предпринята хирургическая ревизия с интраоперационной пальпацией, УЗИ и эндоскопией с трансиллюминацией двенадцатиперстной кишки, особенно при спорадических гастриномах. Лечение Классическое лечение при синдроме Золлингера-Эллисона связано с удалением всей кислото-продуцирующей зоны путем гастрэктомии. Неудачи при достижении этого удаления в прошлом приводили к рецидиву или осложнениям пептических язв, которые часто являлись опасными для жизни в ближайшем послеоперационном периоде. После развития эффективной медикаментозной терапии с применением H2-блокаторов и ингибиторов протонной помпы, гастрэктомия теперь редко показана для контроля гиперсекреции желудочной кислоты. Ингибиторы протонной помпы имеют значительно более низкий показатель неэффективности, чем H2-блокаторы в контроле кислотной секреции при гастриномах. Эффективность ингибиторов протонной помпы подчеркивается тем обстоятельством, что у большего числа пациентов с гастриномой проявляется запущенное заболевание в результате задержки с постановкой диагноза. 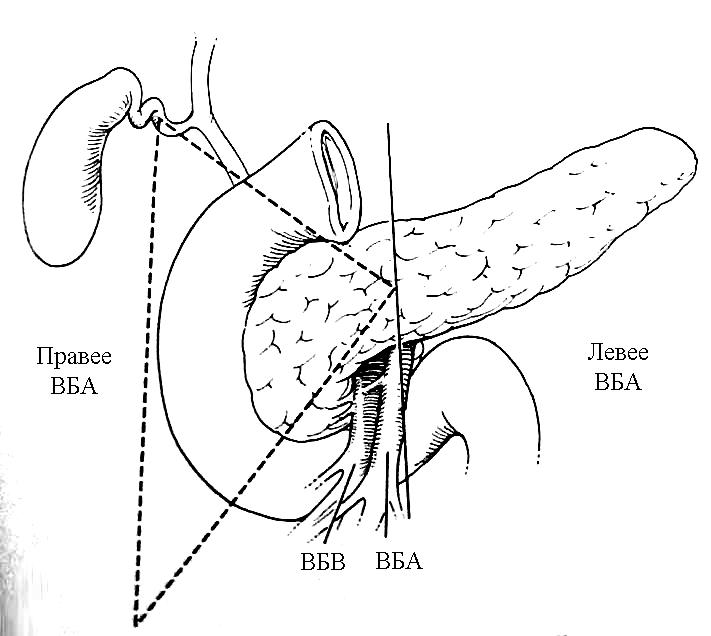 Рис. 20. Треугольник гастринóм. ВБА – верхняя брыжеечная артерия; ВБВ – верхняя брыжеечная вена. 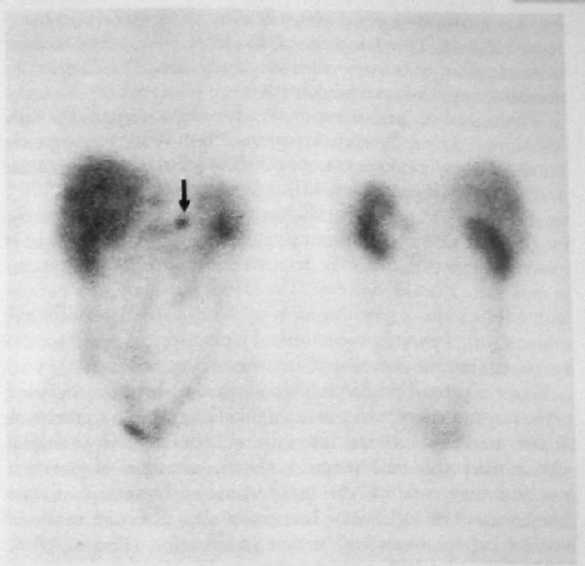 Рис. 21. СРС при гастриноме показывает первичную опухоль (стрелка) и метастазы в печень. Хирургическая резекция предлагает единственный шанс полного излечения при гастриноме. Спорадические гастриномы без метастатической болезни являются самыми подходящими для хирургической резекции. Кроме того, что резекция может устранить потребность в антисекреторной медикаментозной терапии, она может предотвратить также и метастазирование. Одна треть этих пациентов может быть радикально излечена при наличии соответствующего опыта. При интраоперационном УЗИ и пальпации обнаруживается большинство интрапанкреатических поражений. Для обнаружения дуоденальных поражений может потребоваться интраоперационная эндоскопия с трансиллюминацией двенадцатиперстной кишки или дуоденотомия с тщательной пальпацией. Роль хирургической резекции при гастриномах у пациентов с MEN I менее ясна. Резекция гастринóм у этих пациентов, возможно, не приводит к удовлетворительной отдаленной нормализации уровня гастрина. Кроме того, у пациентов с MEN I есть тенденция к менее агрессивному течению заболевания и значительной выживаемости даже без хирургической резекции. Раняя агрессивная резекция при гастриномах, однако, может уменьшить число случаев малигнизации. Начальное лечение у пациентов с MEN I и гастриномой должно контролировать гиперпаратиреоз с помощью паратиреоидэктомии. Гиперкальциемия действует как аналог секретина на уровень гастрина и усиливает гипергастринемию. Поскольку ингибиторы протонной помпы могут эффективно контролировать гиперсекрецию желудочной кислоты, пациенты теперь умирают в результате метастатической болезни, а не болезни пептических язв. Аналоги соматостатина, типа октреотида, уменьшают связанные с повышенной кислотностью симптомы гастринóм и могут стабилизировать прогрессирование метастатической болезни. Интерферон альфа также может способствовать биохимическим реакциям и стабилизации опухоли. Хирургическое уменьшение объема и резекция печеночных метастазов могут облегчить симптомы и помочь увеличить выживаемость в данной группе пациентов. Другие подходы к печеночным метастазам включают радиочастотную абляцию, криоабляцию, эмболизацию печеночной артерии или хемоэмболизацию и ортотопическую трансплантацию печени. Химиотерапевтические средства включают стрептозоцин и 5-фторурацил с или без доксорубицина. ГЛЮКАГОНОМА В 1942 г. Беккер [Becker] с соавторами описали 45-летнюю женщину с диффузным эритематозным везикулярным некротическим дерматозом в сочетании с сахарным диабетом, стоматитом, анемией, потерей веса и томбоэмболической болезнью. Вскрытие трупа женщины выявило островковоклеточную опухоль поджелудочной железы. Более 20 лет спустя, с развитием методик радиоиммунологического обследования, Мак Гавран [McGavran] с соавторами (1966 г.) показали увеличенные уровни глюкагона в крови и опухолевой ткани из альфа-клеток панкреатических островков у подобного пациента с "буллезным и экзематоидным дерматитом", диабетом и анемией. Глюкагономы являются редкими, часто большими (>4 см) опухолями при диагностике и почти всегда выявляются в пределах поджелудочной железы. Возраст пациентов обычно составляет 40 лет и более с одинаковым распределением между полами. Большинство опухолей (60-70%) являются злокачественным. В отличие от инсулинóм и гастринóм, связь с MEN I является редкой. Клиническая картина Клинические проявления глюкагономы разнообразны и включают диабет, типичные высыпания на коже, названые некролитической мигрирующей эритемой, глоссит и стоматит, потерю веса и общую слабость. Менее частые особенности включают ментальные изменения, диарею, артериальный и венозный тромбоз и неврологические изменения. Диабет при глюкагономе обычно легкой степени и не связан с диабетическим кетоацидозом, поскольку секреция инсулина бета-клетками сохранена. Высыпание на коже при глюкагономе, некролитическая мигрирующая эритема, присутствует у 70% пациентов (рис. 22). Это типичное высыпание обычно встречается в областях трения или локальной травматизации, типа стоп, голеней, рук, ягодиц, промежности, или периоральной области, но рассеянные поражения могут встречаться где угодно. Сыпь обычно путают с псориазом, пемфигусом или экземой. Индивидуальные поражения развиваются в рамках типичного цикла, который длится 7 - 14 дней. Сначала – в виде эритематозных макул или папул. Затем, после образования пузырей, поражения выглядят подобно ожогу кипятком. Центральные эрозии в пузырях приводят к мокнутию и образованию корок. В то время как эритематозные края распространяются к периферии, в центре начинается заживление. Наконец, корки отпадают, и эрозии заживают. Отличительное бронзовое изменение цвета может остаться на ранее пораженных областях кожи. Сыпь часто бледнеет и уменьшается, а, следовательно, трудно оценить определенные формы лечения. Дифференциальный диагноз сыпи при некролитической мигрирующей эритеме включает дефицит цинка, пеллагру, квашиоркор, терминальную стадию болезней печени, токсический эпидермальный некролиз, листовидный пемфигус и пустулярный псориаз.
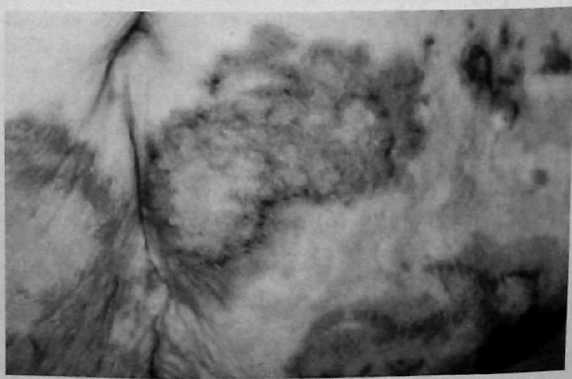
Рис. 22. Некролитическая мигрирующая эритема при глюкагономе. Тромбоз глубоких вен встречается у 30% пациентов с глюкагономой. После постановки диагноза должна быть рассмотрена необходимость антикоагуляционной терапии с помощью аспирина, антитромбоцитарных препаратов и подкожного введения гепарина или низкомолекулярного гепарина. Неврологические проявления глюкагономы включают атаксию, деменцию и слабость проксимальных мышц. Лабораторные данные при глюкагономе включают повышение уровня глюкозы плазмы крови, нормохромную нормоцитарную анемию и генерализованное уменьшение уровня аминокислот плазмы крови. Уменьшение уровня аминокислот связано со стимуляцией глюконеогенеза и окислением аминокислот с помощью глюкагона. Коррекция гипоаминоацидемии, как сообщалось, уменьшает сыпь при некролитической мигрирующей эритеме. Уменьшение уровня глюкагона плазмы крови – лучший способ излечить сыпь. Диагностика и определение локализации Поскольку многие из симптомов являются неспецифичными, глюкагонома часто диагностируется относительно поздно в ходе своего течения. Типичная сыпь при некролитической мигрирующей эритеме может усилить начальное подозрение на глюкагоному, но обычно сначала рассматриваются другие причины сыпи. Повышение уровня циркулирующего глюкагона подтверждает диагноз. Измеренный натощак уровень глюкагона сыворотки выше 1000 пг/мл (норма 0-150 пг/мл) является фактически диагностическим. Другие условия, которые могут вызвать увеличение уровня глюкагона (обычно <500 пг/мл), включают ограничение приема пищи, сепсис, панкреатит, операции на органах брюшной полости, синдром Кушинга [Cushing] и почечную или печеночную недостаточность. Уровень глюкагона менее 500 пг/мл является диагностическим для глюкогономы у пациентов с классическим синдромом. Поскольку глюкагономы обычно представляют собой большие опухоли при манифестации, КТ брюшной полости с внутривенным введением контрастного вещества часто достаточна для определения локализации, обнаружив 86% опухолей в одном исследовании. КТ брюшной полости также идентифицирует печеночные метастазы. ЭУЗИ может быть полезным, особенно при небольших опухолях, легко не визуализируемых с помощью КТ брюшной полости. Другие методики визуализации, типа СРС, ангиографии и порто-венозного сэмплинга, являются очень чувствительными, но редко необходимыми. |