ВКР Сотина. Исследование фазовых эффектов и методов разделения азеотропных смесей, утверждена приказом ргу имени С. А. Есенина от 20 г
 Скачать 1.21 Mb. Скачать 1.21 Mb.
|
2. СОВРЕМЕННЫЕ МЕТОДЫ РАЗДЕЛЕНИЯ ФАЗОВЫХ ЭФФЕКТОВ В АЗЕОТРОПНЫХ СМЕСЯХАзеотропами называют растворы, которые отвечают максимуму или минимуму диаграммы «состав - температура кипения». Перегонка данных растворов осуществляется без существенного изменения состава, так как состав жидкости и пара у них идентичен. Существует большое количество примеров биазеотропных смесей. Так азеотроп с минимумом точки кипения (78,174°С) образуют этиловый спирт и вода (4% воды, 96% спирта), а с максимумом точки кипения образуют соляная кислота и вода. В таблице 4 представлены точки кипения и состав ряда азеотропных растворов. Таблица 4. Азеотропные растворы при 1 атм.
Система соляная кислота - вода досконально изучена; состав этой постоянно кипящей смеси применяют за эталон в количественном анализе. Если какой-нибудь раствор соляной кислоты в течение некоторого времени кипит при 760 мм рт. ст., то его температура будет постепенно повышаться до 108,58°С, а раствор, кипящий при температуре, будет содержать 20,222 весовых процента хлористого водорода. Изменение давления вызывает понижение максимума. При 700 мм рт. ст. максимум температуры 106,42°С. Всякий раз, когда есть максимум, должны существовать по крайней мере два противоположных фактора, один из которых способствует возрастанию [14]. 2.1. ДистилляцияДистилляция (перегонка) - это физико-химический процесс разделения смесей двух или более жидкостей, который основывается на их различных температурах кипения. Процесс перегонки базируется на различии в составах жидкости и образующегося из нее пара. В ходе дистилляции происходит частичное испарение жидкости и дальнейшая конденсация пара. В колбе (перегонном кубе) жидкость нагревается до температуры кипения, пары, пропуская через холодильник, сгущают, в результате образуется очищенный от посторонних веществ дистиллят (например, дистиллированная вода). Отогнанная фракция (дистиллят) богата более летучими (низкокипящими) компонентами, а неотогнанная (кубовый остаток) - менее летучими (высококипящими) компонентами смеси. Фракционная (дробная) дистилляция или разгонка заключается в отгонке нескольких фракций. В ходе разгонки осуществляется разделение жидких смесей, при этом выделяются фракции (погонов) дистиллята, которые кипят в установленном температурном интервале. 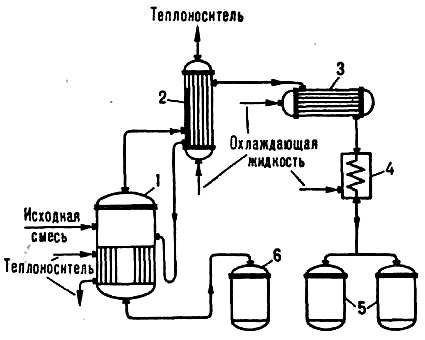 Рис. 15. Дистилляционная установка: 1 - испаритель; 2 - дефлегматор; 3 - конденсатор; 4 - холодильник; 5,6 -сборники соответствующего дистиллята и кубового остатка. Дистилляционная установка (рис. 15) состоит из испарителя 1 и устройства теплообмена, который подводит к раствору нужное количество теплоты; дефлегматора 2 - частичная конденсация пара, выходящего из испарителя (при фракционной дистилляции); конденсатора 3 - сжижение отбираемого пара; холодильника 4; сборников дистиллята 5 и кубового остатка 6. В зависимости от параметров процесса дистилляцию разделяют на простую и молекулярную. Первая фракция дистиллята богата низкокипящим компонентом. При дистилляции с дефлегмацией идет процесс обогащения паров дистиллята более высоколетучими компонентами смеси, при этом происходит их частичная конденсация. В дефлегматоре осуществляется конденсация паров с получением флегмы. Объем возвращаемой в куб (колонну) флегмы, определяет выход и чистоту разделяемых компонентов смеси, что дает насыщение дистиллята низкокипящими компонентами и высокую степень разделения исходной жидкой смеси. Это обусловлено тем, что при дефлегмации лучше конденсируются более высококипящие компоненты. Процессы многократной дистилляции, многократного чередования испарения жидкой и конденсации паровой фаз обеспечивают полное разделение смеси на чистые компоненты. Разделение смесей на чистые компоненты при обычной и фракционной дистилляции идет не полностью. Для разделения термически неустойчивых компонентов, таких как, жирных кислот, эфирных масел и т. п., используют дистилляцию с применением носителя. Процедуру дистилляции осуществляют при температуре ниже точки их кипения и в атмосфере инертного носителя (паров воды или инертного газа). Это позволяет не допустить термического разложения (осмоления) веществ. Дистилляцию с водяным паром в основном применяют для отгонки летучих веществ от нелетучего остатка или выделения нерастворимых в воде компонентов. Применение инертного газа позволяет вести дистилляцию при более низких температурах, но при этом, потери перегоняемого вещества выше, чем при дистилляции с использованием обычного водяного пара. Дистилляцию растворов в низкой температуре осуществляют в вакууме, что дает частичное удаление воздуха из аппарата перегонки. Молекулярная дистилляция базируется на разделении жидких смесей посредством их свободного испарения в сильном вакууме 10-2 - 10-6 Па (10-4 - 10-8 мм рт. ст.) при температуре ниже точки кипения этих смесей. Молекулярная дистилляция характеризуется взаимным распределением поверхностей переноса на расстоянии, меньшем средней длины свободного пути молекул перегоняемого вещества. Это гарантирует переход молекул из одной фазы в другую с минимальным числом соударений. Перегонка может быть осуществлена однократным, многократным или постепенным испарением. Постепенное испарение заключается в постепенном нагреве системы, при этом образующиеся пары отгоняются из смеси в момент их образования. Однократное испарение низкокипящих фракций совершают при более низких температурах, так как это сопровождается переходом низкокипящих фракций в пары, которые снижают парциальное давление испаряющихся высококипящих фракций. При этом, пары низкокипящих фракций остаются в аппарате. При постепенном испарении, наоборот, легкие фракции отгоняют сначала, а тяжелые - в конце. Поэтому легкие фракции, которые превратились в пары и были выведены из аппарата, не влияют на температуру кипения тяжелых фракций. Применение однократного испарения позволяет снизить точку кипения перегоняемого сырья на 50-100°С при сравнении с постепенным испарением [46]. Дистилляцию используют в химической, гидролизной, нефтеперерабатывающей и во многих отраслях пищевой промышленности. Простую дистилляцию и дистилляцию с дефлегмацией используют, например, в ликеростроводочной промышленности, дистилляцию с носителем – в производстве масел, молекулярную дистилляцию – в фармацевтическом производстве. [5] | |||||||||||||||||||||||||||||||||||||||||||||
