Пирлиева Сона Оразовна. Изучение физикохимических свойств пальмового масла
 Скачать 1.27 Mb. Скачать 1.27 Mb.
|
Для измерения необходимо соблюдение температурного режима, так как показатель преломления измеряется строго при следующей температуре:20оC – для жиров и масел, полностью жидких при этой температуре; 40оC – для жиров и масел, полностью расплавленных при этой температуре, но не расплавившихся при температуре 20 оC; 50оC - для жиров и масел, полностью расплавленных при этой температуре, но не расплавившихся при температуре 40 оC; 60оC - для жиров и масел, полностью расплавленных при этой температуре, но не расплавившихся при температуре 50 оC; 80оC или выше - для других жиров и масел, например, для полностью отверженных жиров или восков. Таблица 3 – Показатели преломления растительных масел
К методам анализа пальмового масла относят методы определения влаги и летучих веществ - это потеря массы продукта в результате нагревания его при температуре 100-105°С при определенных условиях. Сущность метода заключается в нагревании анализируемой пробы до полного удаления влаги и летучих веществ и определении потерь ее массы. Отбор проб производят по методике ГОСТ 5471-83[10]. Пробу испытуемого масла хорошо перемешивают. Стаканчик для взвешивания предварительно высушивают в течение 30 мин при температуре 100 - 105 °С, охлаждают в эксикаторе и взвешивают. Испытания проводят в предварительно высушенный стаканчик взвешивают около 5 г испытуемого масла на аналитических весах с записью результата до четвертого знака после запятой и высушивают его при температуре 100 - 105 °С до постоянной массы. Первое взвешивание производят после высушивания масла в течение 20 мин, последующие взвешивания - после 15 мин высушивания. Постоянная масса считается достигнутой, если уменьшение массы при двух последовательных взвешиваниях не превышает 0, 0005 г. Массовую долю влаги и летучих веществ в испытуемом масле (X) в процентах вычисляют по формуле (1) 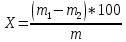 (1) (1)где m - масса испытуемого масла, г., m1 - масса стаканчика с маслом до высушивания, г., m2 - масса стаканчика с маслом после высушивания, г. Допускаемые расхождения между параллельными определениями не должны превышать 0, 04%. Содержание минеральных веществ в пищевых продуктах зависит от природы исходного сырья и технологии получения. В среднем в съедобной части продуктов питания содержится около 1% минеральных веществ (0,7–1,5%). Их количество увеличивается при добавлении в продукты поваренной соли (1,5–3,0%). При переработке пищевого сырья, происходит снижение содержания минеральных веществ. В растительных продуктах они теряются с отходами при приготовлении круп и муки. При очистке овощей и картофеля теряется до 10–30% минеральных веществ. Мясные продукты, рыба и птица теряют такие макроэлементы как кальций и фосфор, при отделении костей. При тепловой обработке теряется в зависимости от технологии от 5 до 30%. Зольность – нормируемый показатель для многих продуктов, который представляет собой количественное выражение содержания минеральных веществ, образующихся при сжигании продукта до золы и измеряется в процентах. В заранее прокаленный при температуре 500 оС и охлажденный тигель взвесить на аналитических весах 5–25 г анализируемого продукта. Жидкие продукты предварительно упаривают на водяной бане до сухого остатка, а затем высушивают в сушильном шкафу (100–120 оС) и осторожно обугливают на электрической плитке. Обугленный продукт прокалить в муфельной печи при температуре 450 оС, не допуская воспламенения и разбрызгивания продукта. После прокаливания тигель охладить в эксикаторе над осушителем и взвесить на аналитических весах. Озоление продолжать до получения постоянной массы золы. Процесс озоления можно ускорить, добавив к охлажденному зольному остатку 1–2 мл 90% этилового спирта. Полученный сухой остаток дополнительно прокалить в муфельной печи до полного озоления пробы, постепенно повышая нагрев до 450–500 оС. Массовую долю золы (Сз, % ) в исследуемом материале рассчитать по формуле (2): 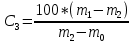 , (2) , (2)где m1 – масса тигля с исследуемым продуктом, г., m2 – масса тигля с золой, г., m0 – масса тигля, г.,100 – коэффициент пересчета в проценты. Определение количества золы необходимо для оценки общего содержания зольных элементов в растениях и характеристики качества кормов. Сухое озоление используют как подготовительный этап при проведении количественного анализа растительных материалов на содержание отдельных зольных элементов питания растений – фосфора, калия, кальция, магния, других макро- и микроэлементов. Принцип метода это сжигание растительной пробы в муфельной печи, в результате которого органические вещества сгорают с образованием летучих соединений, а в золе в виде оксидов остаются содержащиеся в растениях элементы минерального питания. Золу при этом называют «сырой», так как в ней кроме оксидов могут содержатся соли угольной кислоты, обуглившиеся частицы органических веществ, механические примеси песка и глины. Для определения фосфорсодержащих веществ в жирах и маслах применяют различные химические и физические методы. Результаты выражают в процентах фосфора, оксида фосфора (Р2О5) (табл.4). Таблица 4 – Содержание фосфолипидов в растительных маслах
В качестве физического метода определения фосфорсодержащих веществ применяют метод атомно-абсорбционной спектроскопии (ГОСТ Р 52676–2006. «Масла растительные. Методы определения фосфорсодержащих веществ»). Названный метод позволяет оценить содержание фосфора в жиросодержащем материале в диапазоне концентраций 0,20–230 мг (в пересчете на оксид фосфора – 5*10–4–5,3*10–1%). Метод основан на испарении анализируемой пробы жира, смешанной с модификатором, в графитовой кювете и последующем измерении поглощения свободными атомами фосфора при длине волны 213,5 нм. Матричный модификатор представляет собой раствор лантан-органометаллического стандарта в циклогексане (с массовой долей лантана 5000 мг/кг в 10 мл циклогексана). Содержание фосфора находят по величине интегрального аналитического сигнала и рассчитывают по калибровочному графику. Калибровочные растворы готовят из 2%-го раствора соевого лецитина в контрольном образце масла с добавлением 4 г циклогексана. В качестве контрольного образца масла применяют жидкое рафинированное масло с содержанием фосфора менее 2 мг/кг, его же используют для приготовления калибровочных растворов. Содержание фосфора в контрольном образце масла находят колориметрическим методом. В основе химических методов лежит окисление образца различными окислителями (минерализация), которое проводят двумя способами – путем сухого или мокрого сжигания. В случае мокрого сжигания окислителем выступает смесь концентрированных кислот (азотной и серной); в методе сухого сжигания – сухой порошок окиси магния. В обоих случаях органическая часть сгорает, а фосфор, входящий в состав фосфорсодержащих веществ жира, образует фосфорные кислоты или их соли. Полученные в результате сжигания фосфорные кислоты или их соли осаждают в присутствии азотнокислого аммония и азотной кислоты избытком молибденовокислого аммония в виде желтого осадка фосфорномолибденовокислого аммония следующего состава. К методам количественного анализа пальмового масла относят титриметрическое определение кислотного числа. Кислотное число характеризует присутствие свободных жирных кислот в жире и выражается количеством гидроксида калия (мг), необходимым для нейтрализации свободных жирных кислот и нейтрализуемых щелочью сопутствующих триацилглицеридам веществ, содержащихся в 1 г жира (мг КОН/г жира). Значение кислотного числа характеризует глубину гидролитического распада жиров и определяет товарный сорт, доброкачественность пищевых жиров, нормируется ГОСТом и техническими условиями. Например, масло, полученное из зрелых семян, имеет низкое содержание свободных жирных кислот, а содержание свободных жирных кислот в масле из незрелых семян – высокое. Кислотное число изменяется в зависимости от глубины очистки масла. Для нерафинированных масел значение кислотного числа выше, чем рафинированных. Величина кислотного числа для рафинированных растительных масел не должна превышать 0,4 мг КОН/г жира (ГОСТ Р 50457–92 (ИСО 660–83). «Масла растительные. Определение кислотного числа и кислотности»). При несоблюдении условий и сроков хранения жиров кислотное число увеличивается, что обусловлено главным образом гидролизом триацилглицеридов. Гидролиз происходит под действием ферментов микроорганизмов, высоких температур, влажности, света и других факторов. В результате гидролиза высвобождаются жирные кислоты, содержание которых определяется через показатель кислотного числа. В связи с тем, что свободные жирные кислоты окисляются быстрее, чем связанные, нарастание кислотного числа ускоряет процессы как химического, так и ферментативного окислительного прогоркания ненасыщенных жирных кислот. С другой стороны, окисление свободных ненасыщенных жирных кислот липооксигеназами способствует повышению кислотного числа. Однако повышенное кислотное число не всегда служит признаком порчи жира. Часто жиры с высоким кислотным числом не бывают прогорклыми, в то же время кислотное число прогорклых жиров может быть небольшим. Спектрофотометрический анализ используют для определения анизидинового числа – это показатель качества жира, который характеризует содержание в нем вторичных продуктов окисления (соединений, содержащих карбонильную группу). Многие карбонильные соединения токсичны и придают жирам соответствующие специфические посторонние привкусы. Так, рыбный привкус вызывают насыщенные и ненасыщенные альдегиды (С5–С11), прогорклый вкус – гептаналь. Данный показатель позволяет более полно оценить безопасность и сохраняемость масел, выявить нарушения технологических режимов. Высокое анизидиновое число исходного жира свидетельствует о том, что данный жир хранился в течение продолжительного времени либо в неудовлетворительных условиях, также, возможно, что он подвергался длительному механическому и термическому воздействию (например, частому перекачиванию и нагреву). При использовании такого жира в качестве исходного сырья в производстве специализированных жиров неизбежны проблемы по такому важному показателю, как органолептика. Даже если готовый продукт получит высокую дегустационную оценку, при хранении может отмечаться реверсия вкуса, т. е. возврат вкуса и запаха, присущие недезодорированным маслам. Концентрация полученных окрашенных соединений оценивают по изменению оптической плотности раствора при длине волны 350 нм. В качестве растворителя используют изооктан (2, 2, 4-триметилпентан), имеющий нулевую оптическую плотность в пределах длин волн 300–380 нм. Технические свойства растительных жиров также зависят от содержания в них остатков жирных кислот с двумя и тремя двойными связями: чем их больше в составе масла, тем оно легче окисляется и быстрее высыхает на воздухе и тем выше качество олифы, лаков и красок, производимых на основе этих жиров. Для характеристики содержания в жирах ненасыщенных жирных кислот используется показатель – йодное число, которое выражается количеством граммов йода, способного связываться со 100 граммами жира. Поскольку йод связывается с жирами при разрыве двойных связей в остатках ненасыщенных жирных кислот, этот показатель характеризует степень непредельности ацилглицеринов жира. Чем больше двойных связей в кислотных остатках жира, тем выше его йодное число. Животные жиры, преимущественно включающие остатки насыщенных жирных кислот, имеют низкие йодные числа (30-70). Растительные жиры, содержащие в своём составе главным образом остатки ненасыщенных жирных кислот, отличаются более высокими йодными числами – 80-180. Растительные масла с хорошими техническими свойствами имеют йодные числа в пределах 140-180, пищевые масла – 90-130. Йодные числа растительных масел, выделяемых из семян масличных культур, характеризуются следующими данными приведёнными в таблице (5). Таблица 5 – Йодные числа растительных масел.
Также в методах качественного определения пальмового масла – ферментативно-алкалиметрический. Данный способ позволяет различить пальмовое и сливочное масла. Метод заключается в ферментативном гидролизе масла с последующим титриметрическим определением количества выделившихся жирных кислот с визуальным фиксированием точки эквивалентности. Титрантом является вводный раствор гидроксида натрия (0,1 моль/дм3), индикатором – фенолфталеин. В качестве фермента в данном методе применяется панкреатическая липаза [11]. Помимо определения, данным способом также можно изучить влияние активности фермента, рH-среды, температуры и времени на гидролиз пальмового и сливочного масел. Особенностью этого способа является использование неоптимальных условий проведения расщепления липидов, что позволяет снизить скорость реакции для установления тонких различий гидролиза жиров различного состава[11]. В ходе алкалиметрического титрования продуктов расщепления липидов могут возникнуть трудности на стадии фиксирования точки эквивалентности из-за мутности титруемого раствора. В этом случае титрование следует проводить, сверяя окраску с контрольным образцом. Для его приготовления в один из образцов после гидролиза добавляют 0,5 мл сернокислого кобальта 2,5 масс. % [30,5]. Предлагаемый метод является одним из самых экономичных и простых в исполнении. Также существенным плюсом данного метода является то, что работа ведется при низких и удобных показателях температуры, в интервале 17-27 °С. Широкое применение в качественном анализе пальмового масла нашли методы термического анализа. Основными методами термического анализа являются: дифференциальная сканирующая калориметрия (ДСК), термогравиметрический анализ (ТГА) и дифференциально-термический анализ (ДТА). Чаще всего они используются для качественного анализа пальмового масла в эмульсионных масложировых продуктах (сметана, майонез). Метод дифференциальной сканирующей калориметрии позволяет качественно определять наличие жиров немолочного происхождения по температуре плавления в области 30-50°C. Методами термогравиметрического и дифференциально-термического анализа помимо качественного состава можно исследовать и количественное содержание основных компонентов жировых продуктов [27,36]. Метод дифференциальной сканирующей калориметрии реализуется на дифференциальном сканирующем калориметре, чаще всего модели Shimadzu DSC-60 (Япония) в диапазоне температур от -70 до +90°С. Ниже представлен пример кривой ДСК (рисунок 1) при исследовании жировых продуктов (сметана) [6,38,22,26]. 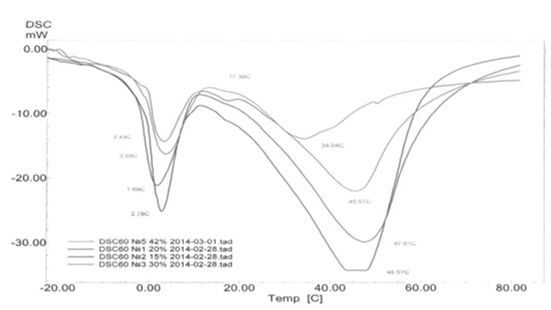 Рисунок 1 – Кривая ДСК жировых продуктов (сметана) Термогравиметрический и дифференциально-термический также довольно часто применяются в химическом анализе, но на порядок реже чем ДСК. Свою актуальность они приобретают тогда, когда помимо качественного анализа ведется ещё и количественное определение содержания пальмового масла. Они проводятся на термоанализаторе, чаще всего это Shimadzu TGA/DTA-60 (Япония). Диапазон температур существенно отличается от метода ДСК и составляет от 20 до 500°С. Эти процессы также ведутся в атмосфере азота. Скорость нагрева образцов, расход газа и масса навески аналогичны методу ДСК (10 град/мин, 40 см3/мин, 5 мг). Объекты исследования – эмульсионные жировые продукты различной степени жирности [9,26]. Еще один метод, которым можно определить наличие растительного масла (в том числе и пальмового), основан на определении природы вещества по цвету свечения флуоресцентного излучения. Он базируется на фундаментальном свойстве люминесценции в ультрафиолетовых лучах многих органических веществ. Молочный жир будет флуоресцировать различными оттенками жёлтого цвета, а растительные жиры – фиолетово-голубым. Этот метод воплощен в таких несложных приборах, как флюориметр, люминоскоп и спектрофлуориметр [39]. Люминесцентный метод анализа нашёл применение в различных областях науки и техники. В сельском хозяйстве и пищевой промышленности люминесценция используется для определения доброкачественных и недоброкачественных продуктов. Анализ осуществляется с помощью визуальных наблюдений и количественного определения компонентов с использованием флуоресценции. Люминесцентный метод исследования масел и жиров основан на свойстве определённого вида жира люминесцировать в потоке УФ-лучей. Кусочек пробы масла или жира помещают в кювету, которую переносят в смотровую камеру прибора. Для определения вида масла пользуются таблицей 6. Таблица 6 – Цвета растительных масел при дневном свете и в УФ излучении
Минеральные масла (технические) дают яркую сине-сиреневую люминесценцию, поэтому даже небольшая добавка минерального масла к растительным маслам меняет исходный цвет люминесценции [20,49]. 1.4.2 Методы идентификации пальмового маслаПотребление человеком значительных количеств пальмового масла влияет на его здоровье, вызывая переедание, привыкание к определенной марке продукта, ожирение, заболевания сердечнососудистой системы, увеличение содержания холестерина и риска развития онкологических заболеваний. В настоящее время для обнаружения пальмового масла в продуктах масложировой промышленности рекомендуется применять газовую хроматографию [3]: 1) арбитражный способ – ГОСТ 31979-2012, включающий в себя омыление анализируемых липидов (30 мин), получение осадка дигитонинов стеринов (12 ч), растворение их и экстракция пентаном с последующим газожидкостным хроматографированием. 2) способ, основанный на определении соот-ношения массовых долей эфиров определенных жирных кислот (ГОСТы 31663-2012, 31665-2012) с предварительным выделением органической фазы из анализируемого масла с последующим омылением и очисткой (фильтрование, центрифугирование). При проведении технического контроля на предприятиях масложировой промышленности для определения присутствия молочного жира в спредах применяют число Рейхерта-Мейссля [3] (объем раствора щелочи необходимый для нейтрализации летучих водорастворимых жирных кислот, полученных из 5 г жира) и методику (ГОСТ 34178-2017, ГОСТ Р 52100-2003) включающую омыление пробы жира (20 мин), перегонку с водяным паром (30 мин) с последующим титрование дистиллята. Известно применение метода инфракрасной спектроскопии для опре-деления подлинности молочного жира. Длительность и сложность пробоподготовки, применение дорогостоящего оборудования в рекомендуемых методиках, определяет актуальность поиска новых, более экспрессных методов анализа, в том числе для работы в небольших лабораториях. Пальмовое масло в отличие от других масел, в том числе молочного жира, характеризуется повышенной устойчивостью к внешним воздействиям – у него самые высокие для масел температура плавления, индекс окислительной устойчивости. Это позволяет предположить повышенную устойчивость пальмового масла к ферментативному воздействию липаз. Изучен ферментативный гидролиз пальмового (ПМ) и сливочного домашнего (СлМ) масел, катализируемый панкреатической липазой (Ф) 20000 (6000) [2]. Для растворения липазы использовали среду с различными рН (6,0 – дистиллированная вода; 7,9 – водный раствор тетрабората натрия 1% масс.; 8,4 – водный раствор карбоната натрия 1% масс.). При расщеплении липидов образуются жирные кислоты [7], количество которых можно оценить по объему раствора гидроксида натрия V(NаОН), затраченного на реакцию с превращенным субстратом. За основу разработки способа расщепления липидов выбрана методика определения активности липазы [6]. Для реверсного применения подхода необходимо изменить основные условия проведения реакции – рН, температура (t, °С), время (τ, мин или ч) – так, чтобы снизить скорость реакции для установления тонких различий гидролиза жиров различного состава. При алкалиметрическом титровании продуктов расщепления липидов могут возникнуть трудности на стадии фиксирования точки эквивалентности из-за мутности титруемого раствора. В этом случае титрование следует проводить, сверяя окраску с контрольным образцом окраски. Для его приготовления в один из образцов после ферментативного гидролиза добавляют 0,4 см3 сернокислого кобальта 2,5 масс. % (фиксирование точки эквивалентности аналогично методу определения кислотности молока, ГОСТ Р 54669-2011). Известно, что максимальная активность панкреатической липазы достигается при рН = 8-9, температура 36,7 °С [7]. При соблюдении этих условий происходит практически полное разложение всех жиров в течение 1 часа. Особенностью разработанного способа является использование неоптимальных условий проведения гидролиза, что позволяет провести реакцию с меньшей скоростью. Так, при темпера-туре 20 °С при рН среды 8,4 полное разложение триглицеридов сливочного масла Ф 20000 происходит за 4 ч вместо 1 ч, при рН 6,0 необходимо более 5 ч. Различия гидролиза сливочного и пальмового масел особенно проявляются в течение первого часа проведения реакции. Применение неоптимальных условий гидролиза определяет задержки начала расщепления масел во времени – индукционный период (ИП). Более высокие значения объемов гидроксида натрия, затраченные на титрование продуктов гидролиза сливочного масла объясняются наличием в нем свободных жирных кислот. При применении панкреатическая липазы 6000 при рН 6,0 и 7,9 индукционный период наблюдается при гидролизе и пальмового, и сливочного масел, следовательно, эти условия не пригодны для идентификации. При рН 8,4 ИП выявлен только при расщеплении ПМ, в первые 10 мин реакции кислоты присутствуют только в превращенном субстрате сливочного масла, в титруемом образце пальмового масла их нет. Однако объемы гидроксида натрия, затраченные на титрование в обоих случаях различаются незначительно, что затрудняет идентификацию. Панкреатическая липаза 20000 значительно активнее Ф 6000, ферментативное расщепление триглицеридов сливочного и пальмового масел при рН = 8,4 не имеет индукционного периода.При рН 7,9 и 6,0 ИП наблюдается только при гидролизе пальмового масла. Объемы гидроксида натрия, затраченные на титрование его образцов не изменяются в течение первых 20 мин реакции, в то время как результаты титрования превращенного субстрата с образцами сливочного масла значимо отличаются во времени. Различия в скорости накопления кислот максимальны при рН 7,9. При выбранном рН (водный раствор тетрабората натрия 1% масс.) в присутствии панкреатической липазы 20000 расщепление пальмового масла начинается через 25 мин после начала опыта, сливочного – через 10 мин. Оптимальное время гидролиза, позволяющее отличить пальмовое масло от сливочного – 20 мин. Идентификацию масел можно провести сравнением результатов алкалиметрического титрования продуктов расщепления масел через 5 мин (V5) и 20 мин (V20) после начала гидролиза изучаемого масла с панкреатической липазой 20000. Если анализируемая проба содержит только сливочное масло, то V20/V5. Численно равные значения V5 и V20 получаются при анализе пальмового масла. Величина V20/V5, находящаяся в интервале от 1 до 2, свидетельствует, что анализируемый образец – спред, и чем ближе значение V20/V5 к 1, тем больше в пробе пальмового масла. Проведение анализа при неоптимальной для гидролиза липаз температуре нивелирует ее влияние на эффективность работы фермента (таблица 7), позволяя работать в большом диапазоне температур, упрощая обязательные условия анализа. Таблица 7 - Влияние температуры на эффективность ферментативного гидролиза сливочного масла, катализируемого панкреатической липазой 6000, рН = 7,9
На основании полученных результатов разработан способ идентификации сливочного и пальмового масел с применением ферментативно-алкалиметрического анализа. Для этого проводят ферментативный гидролиз образца панкреатической липазой 20000 при рН = 7,9 (водный раствор тетрабората натрия 1% масс.), t = 22 ± 5 °С, время гидролиза 5 и 20 мин с по следующим титрованием продуктов гидролиза водным раствором гидроксида натрия с моляр-ной концентрацией 0,1000 моль/дм3. Таким образом, применение пальмового масла не ограничивается пищевой промышленностью. Его также используют в косметике, где оно входит в составы средств для ухода за сухой и увядающей кожей, чтобы смягчить и увлажнить кожу. Дешевизна и характеристики пальмового масла, которых нет у других растительных жиров, способствуют его популярности широкому использованию как для жарки, так и для изготовления маргаринов, соусов, майонезов, мороженого, кондитерских начинок, кремов, сухих пищевых продуктов, некоторых видов косметики и многого другого. Пальмовое масло в отличие от других масел, в том числе молочного жира, характеризуется повышенной устойчивостью к внешним воздействиям – у него самые высокие для масел температура плавления, индекс окислительной устойчивости. Это позволяет предположить повышенную устойчивость пальмового масла к ферментативному воздействию липаз. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
