|
|
Кафедра биологической химии
Тема 5.1. АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ПИЩИ.
ОБЩИЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ.
Вопросы для самоподготовки
Что такое азотистый баланс? Назовите виды азотистого баланса.
Назовите условия, определяющие биологическую ценность белков.
Что такое заменимые и незаменимые аминокислоты? Перечислите незаменимые аминокислоты.
Что представляют собой глюко- и кетогенные аминокислоты?
Назовите кетогенные аминокислоты.
Назовите аминокислоты, являющиеся одновременно глюко- и кетогенными.
Напишите структурные формулы незаменимых аминокислот.
Напишите структурные формулы условно-заменимых аминокислот.
Напишите структурные формулы заменимых аминокислот.
Что такое «резервные» белки организма? Какие белки можно рассматривать как резервные?
Назовите продукты гидролиза белков, всасывающиеся из кишечника в кровь.
Назовите аминокислоты, подвергающиеся гниению в кишечнике.
Назовите продукты гниения фенилаланина, тирозина, триптофана, лизина, орнитина, цистеина и метионина. Напишите структурные формулы этих продуктов.
Где происходит обезвреживание продуктов гниения аминокислот? Как выделяются продукты обезвреживания из организма?
Что представляет собой ФАФС и УДФГК? Как продукты гниения обезвреживаются этими соединениями?
Что такое дезаминирование? Назовите виды дезаминирования аминокислот.
Назовите вид дезаминирования аминокислот, преобладающий в тканях животных и человека. Напишите этот процесс.
Какая из аминокислот подвергается окислительному дезаминированию с наибольшей скоростью?
Что представляет собой трансаминирование?
Назовите ферменты, осуществляющие процесс трансаминирования. К какому классу ферментов они относятся?
Назовите кофермент, необходимый для осуществления трансаминирования.
Напишите процесс трансаминирования с участием соответствующего кофермента.
Что представляет собой трансдезаминирование?
Напишите процесс трансдезаминирования аспарагиновой кислоты. Назовите ферменты, катализирующие этот процесс.
Напишите процесс трансдезаминирования аланина. Назовите ферменты и коферменты, катализирующие этот процесс.
Что представляет собой восстановительное аминирование?
Назовите аминокислоты, синтезируемые путем восстановительного аминирования.
Напишите процесс восстановительного аминирования пировиноградной, α кетоглутаровой и щавелевоуксусной кислот.
Напишите процесс декарбоксилирования аминокислот. Какие продукты образуются при декарбоксилировании?
Укажите судьбу продуктов декарбоксилирования аминокислот.
Напишите процесс декарбоксилирования гистидина и триптофана.
Укажите физиологическую роль продуктов декарбоксилирования гистидина и триптофана.
Напишите процесс декарбоксилирования глутаминовой и аспарагиновой кислот. Назовите образовавшиеся при этом продукты.
Укажите физиологическую роль продуктов декарбоксилирования глутаминовой и аспарагиновой кислот.
Назовите конечные продукты распада аминокислот в организме животных и человека.
Вопросы, задачи и упражнения для самоконтроля
Вспомните формулы аминокислот, участвующих в синтезе белков и их свойства, заполните таблицу:
№
|
Аминокислота
|
Формула
|
Свойства
радикала
|
Группа по
возможности
синтеза в
организме
|
|
Аланин
|
|
Гидрофобная
|
Заменимая
|
…
|
|
|
|
|
…
|
|
|
|
|
20.
|
|
|
|
|
Биологическая роль аминокислот в организме определяется их использованием в синтезе (использовать таблицу 1-го задания):
1) гема;
2) белков;
3) биогенных аминов и гормонов – производных аминокислот (адреналин, тироксин);
4) жирных кислот;
5) глюкозы.
Пищевая ценность белка зависит от:
1) присутствия всех 20 аминокислот
аминокислотного состава;
2) порядка чередования аминокислот;
3) наличия всех незаменимых аминокислот;
4) возможности расщепления в желудочно-кишечном тракте.
Из перечисленных ниже физиологических состояний выберите те, при которых наблюдается:
1) старение; а) положительный азотистый баланс;
2) взрослый человек (нормальное б) отрицательный азотистый баланс;
питание; в) азотистое равновесие.
3) длительное тяжелое заболевание;
4) период роста;
5) голодание.
Соляная кислота желудочного сока:
1) денатурирует белки пищи;
2) создает оптимум рН для пепсина;
3) активирует пепсин аллостерическим путем;
4) обеспечивает всасывание белков;
5) вызывает частичный протеолиз пепсиногена.
Протеолитические ферменты синтезируются в:
1) химотрипсин; а) активной форме;
2) аминопептидаза; б) неактивной форме;
3) оба; в) поджелудочной железой;
4) ни один. г) желудком.
Биологическое значение переваривания белков:
1) источник аминокислот, необходимых для синтеза собственных белков организма;
2) источник незаменимых аминокислот;
3) образование продуктов, лишенных антигенной специфичности;
4) образование продуктов, которые легко всасываются в клетки слизистой оболочки кишечника;
5) источник аминокислот, необходимых для синтеза биологически активных соединений.
Реакции трансаминирования используются в:
1) синтезе заменимых аминокислот;
2) начальном этапе катаболизма аминокислот;
3) перераспределении аминного азота в организме;
4) синтезе незаменимых аминокислот;
5) образовании аминокислот в клетках.
Центральная роль глутаминовой кислоты в промежуточном обмене аминокислот определяется тем, что глутамат:
1) участвует в трансаминировании как универсальный донор аминогруппы;
2) легко образуется из -кетоглутарата – универсального акцептора аминогруппы;
3) дезаминируется НАД-зависимой глутаматдегидрогеназой;
4) является заменимой аминокислотой;
5) подвергается непрямому дезаминированию.
Назовите аминокислоты-предшественники биогенных аминов:
триптофан;
серин;
глутамат;
тирозин.
|
а) ацетилхолин;
б) ГАМК;
в) серотонин;
г) дофамин;
д) норадреналин.
|
Выберите витамины, необходимые для синтеза и инактивации биогенных аминов:
синтез;
инактивация;
оба процесса;
ни один.
|
а) пантотеновая кислота;
б) пиридоксин;
в) рибофлавин;
г) никотиновая кислота.
|
Объясните, почему ГАМК в виде препаратов аминалона или гаммалона используется в клинике при лечении заболеваний, связанных с резким возбуждением коры головного мозга?
Литература
Николаев А.Я. Биологическая химия. – М.: Высшая школа, 1989. –
С. 303-315.
Николаев А.Я. Биологическая химия. – М.: Высшая школа, 2001. –
С. 303-315.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – С. 322-350.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 409-446.
Северин Е.С., Николаев А.Я. Биохимия. Краткий курс с упражнениями и задачами. – М.: ГЭОТАР-МЕД, 2001. – С. 227-235, 243-246, 253-255.
Задания для самостоятельной работы студентов лечебного и медико-профилактического факультетов.
Тестовые задания по биохимии.
Лекционный материал.
Лабораторная работа. Алейникова Т.В., Рубцова Г.В. Руководство к практическим занятиям по биологической химии. – М.: Высшая школа, 1988. – Лабораторная работа № 49.
Дополнение к лабораторной работе. Данные для построения калибровочного графика расчета содержания пировиноградной кислоты.
Оптическая плотность (Е)
|
Содержание пировиноградной
кислоты в ммолях
|
0,071
0,099
0,142
0,212
0,242
0,383
0,411
|
0,05
0,10
0,15
0,20
0,25
0,40
0,45
|
Клинико-диагностическое значение. Определение активности аминотрансфераз в сыворотке крови имеет исключительно важное значение для диагностики заболеваний сердца и дифференциальной диагностики болезней печени.
Тема 5.2. ПУТИ ОБЕЗВРЕЖИВАНИЯ АММИАКА.
Вопросы для самоподготовки
Назовите пути обезвреживания аммиака в организме.
Назовите основной путь обезвреживания аммиака в организме.
Аминокислоты, участвующие в обезвреживании аммиака.
Назовите органы, в которых осуществляется процесс синтеза мочевины.
Напишите в формулах процесс синтеза мочевины.
Назовите ферменты, катализирующие процесс образования мочевины.
Укажите этапы фиксации аммиака, образующегося при дезаминировании аминокислот.
Напишите схему орнитинового цикла. Покажите на схеме места возможных метаболических блоков.
Назовите фермент, дефект которого характеризуется аргининоянтарной аминоацидурией.
Назовите фермент, дефект которого характеризуется гипераргининемией.
Назовите фермент, дефект которого характеризуется цитруллинемией.
Назовите фермент, дефект которого характеризуется гипераммониемией.
Сколько молекул аммиака обезвреживается при синтезе 1 моль мочевины?
Сколько молей АТФ затрачивается в орнитиновом цикле на синтез 1 молекулы мочевины?
Объясните возможный механизм токсического действия аммиака на клетки головного мозга.
Укажите взаимосвязь цикла мочевины и цикла трикарбоновых кислот.
Напишите процесс образования глутамина.
Напишите процесс образования аспарагина.
Назовите фермент, катализирующий образование глутамина.
Назовите органы, в которых аммиак обезвреживается путем образования амидов.
Назовите амид, синтез которого идет наиболее интенсивно.
Назовите три аминокислоты, образующиеся в процессе восстановительного аминирования в тканях человека и животных.
Какие аминокислоты называются первичными?
Напишите биосинтез аланина в процессе восстановительного аминирования.
Напишите процесс восстановительного аминирования для α-кетоглутарата.
Напишите процесс восстановительного аминирования для оксалоацетата.
Назовите ферменты, участвующие в процессе восстановительного аминирования.
Назовите коферменты ферментов, осуществляющих процесс восстановительного аминирования.
Напишите процесс гидролиза амидов.
Назовите фермент, катализирующий гидролитическое расщепление глутамина.
Напишите путь обезвреживания аммиака, преобладающий в почках.
Напишите реакцию образования хлорида аммония. Какова его роль в сохранении щелочных резервов крови?
Задачи и упражнения для самоконтроля
Источником аммиака в организме является:
1) дезаминирование аминокислот;
2) катаболизм пуриновых нуклеотидов;
3) инактивация биогенных аминов;
4) процессы гниения белков в кишечнике;
5) распад мочевины.
Выберите конечные продукты азотистого обмена.
1) глутамин;
2) карнитин;
3) мочевина;
4) аланин;
5) аммонийные соли.
Сравните реакции обезвреживания аммиака в печени и мышцах.
мышцы;
печень;
обе ткани;
ни одна.
|
а) синтез карбамоилфосфата;
б) синтез глутамина;
в) образование аммонийных солей;
г) синтез аланина в больших количествах.
|
Напишите реакцию обезвреживания аммиака в мозге. Назовите фермент. Какова судьба продукта реакции?
Сравните ферменты:
карбамоилфосфатсинтетаза;
глутаминаза;
глутаминсинтаза;
глутаматдегидрогеназа;
АЛТ.
|
а) используется для обезвреживания аммиака в печени;
б) используется для дезаминирования аланина в печени;
в) необходим для расщепления глутамина в почках.
|
Заполните цепь реакций, подставив вместо цифр названия метаболитов:
2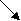 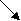   _____ 4 ____ _____ 4 ____
N    H3 1____ цитруллин 3_____ аргинин + фумарат H3 1____ цитруллин 3_____ аргинин + фумарат
Назовите ферменты, которые участвуют в этих реакциях.
Какие из перечисленных ферментов локализованы в митохондриях?
1) карбамоилфосфатсинтетаза;
2) аргиназа;
3) орнитинкарбамоилтрансфераза;
4) аргининосукцинатлиаза;
5) аргининосукцинатсинтетаза.
Выберите ферменты, которые нуждаются в источнике энергии:
1) орнитинкарбамоилтрансфераза;
2) карбамоилфосфатсинтетаза;
3) аргининосукцинатсинтетаза;
4) аргиназа;
5) аргининосукцинатлиаза.
Напишите формулами реакции, которые катализируют выбранные Вами ферменты.
При энзимопатиях ферментов орнитинового цикла нарушен синтез ферментов:
орнитинкарбамоилтрансфераза;
аргининосукцинатлиаза;
карбамоилфосфатсинтетаза;
аргиназа;
аргининосукцинатсинтетаза.
|
а) гипераммониемия;
б) цитруллинемия;
в) гипераргининемия.
|
При нарушениях орнитинового цикла в крови повышается содержание:
1) аланина;
2) орнитина;
3) глутамата;
4) глутамина;
5) аммиака.
Литература
Николаев А.Я. Биологическая химия. – М.: Высшая школа, 1989. –
С. 315-323.
Николаев А.Я. Биологическая химия. – М.: Высшая школа, 2001. –
С. 315-323.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1990. – С. 350-354.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – С. 446-451.
Северин Е.С., Николаев А.Я. Биохимия. Краткий курс с упражнениями и задачами. – М.: ГЭОТАР-МЕД, 2001. – С. 235-243.
Задания для самостоятельной работы студентов лечебного и медико-профилактического факультетов.
Тестовые задания по биохимии.
Лекционный материал.
Лабораторный практикум:
Количественное определение аммиака по методу Мальфатти
Принцип метода состоит в том, что при действии формалина аммонийные соли мочи образуют уротропин и выделяется эквивалентное количество кислоты. Количественное содержание кислоты определяется титрованием.
Ход определения. В колбочку отмеривают пипеткой 10 мл мочи, добавляют отмеренные цилиндром 30 мл дистиллированной виды, 2 капли 1% раствора фенолфталеина и титруют при перемешивании 0,1н раствором щелочи до появления бледно-розового окрашивания. Затем к раствору добавляют 3-5 мл формалина, предварительно нейтрализованного раствором щелочи в присутствии фенолфталеина. Смесь обесцвечивается вследствие разложения аммонийных солей и появления кислот. Последние оттитровывают 0,1н раствором щелочи до появления бледно-розового окрашивания. Расчет производят по формуле: Х = а 0,0017 150, где Х – количество (грамм) аммонийных солей в суточном количестве мочи; а – количество (мл) 0,1н раствора щелочи, пошедшее на последнее титрование.
Норма: 0,6-0,8 г.
|
|
|
 Скачать 1.43 Mb.
Скачать 1.43 Mb.
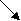

 _____ 4 ____
_____ 4 ____ 


 H3 1____ цитруллин 3_____ аргинин + фумарат
H3 1____ цитруллин 3_____ аргинин + фумарат