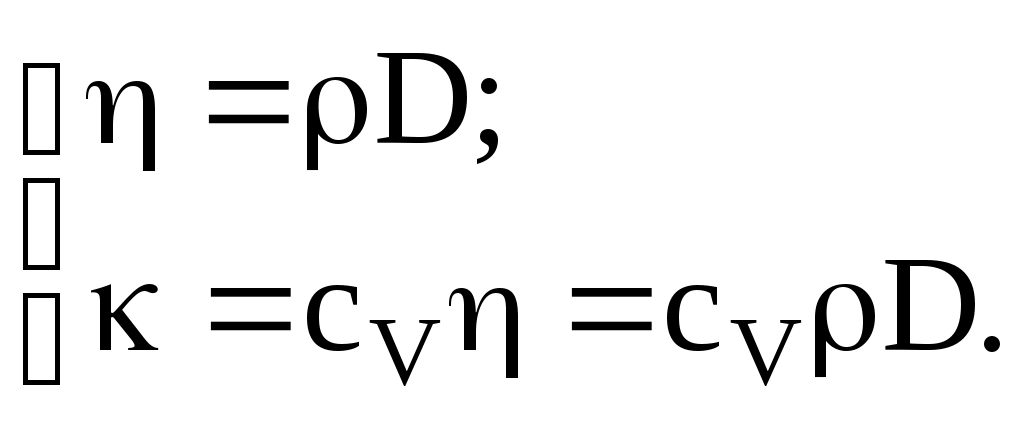|
|
2_Учебное пособие. 2_Учебное пособие doc. Конспект лекций для 1 семестра изучения курса Физика I. Механика и элементы специальной теории относительности 1
Первый постулат Эйнштейна: никакими физическими опытами, производимыми внутри инерциальной системы отсчета, невозможно установить, покоится эта система или движется прямолинейно и равномерно.
В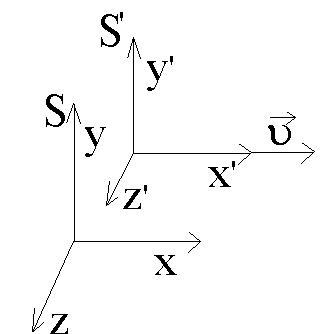 торой постулат Эйнштейна: скорость света в вакууме одинакова во всех инерциальных системах отсчета и не зависит от движения источников и приемников света. торой постулат Эйнштейна: скорость света в вакууме одинакова во всех инерциальных системах отсчета и не зависит от движения источников и приемников света.
Рассмотрим две системы отсчета S и S (рис. 8). Систему S будем считать условно неподвижной. Система  движется относительно движется относительно  со скоростью со скоростью 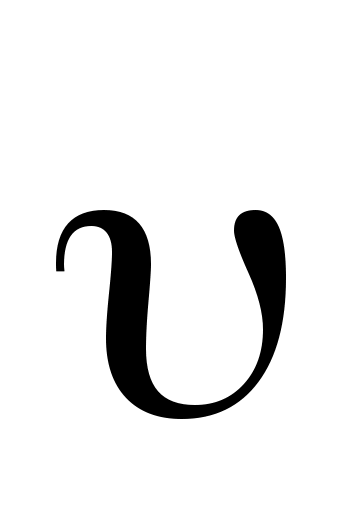 вдоль оси X системы вдоль оси X системы  . Для перехода от одной системы отсчета в другую в специальной теории относительности используются преобразования Лоренца. . Для перехода от одной системы отсчета в другую в специальной теории относительности используются преобразования Лоренца.
Пусть в начальный момент времени начала координат обеих систем и направления соответствующих осей совпадают.
Рис. 8
Тогда: 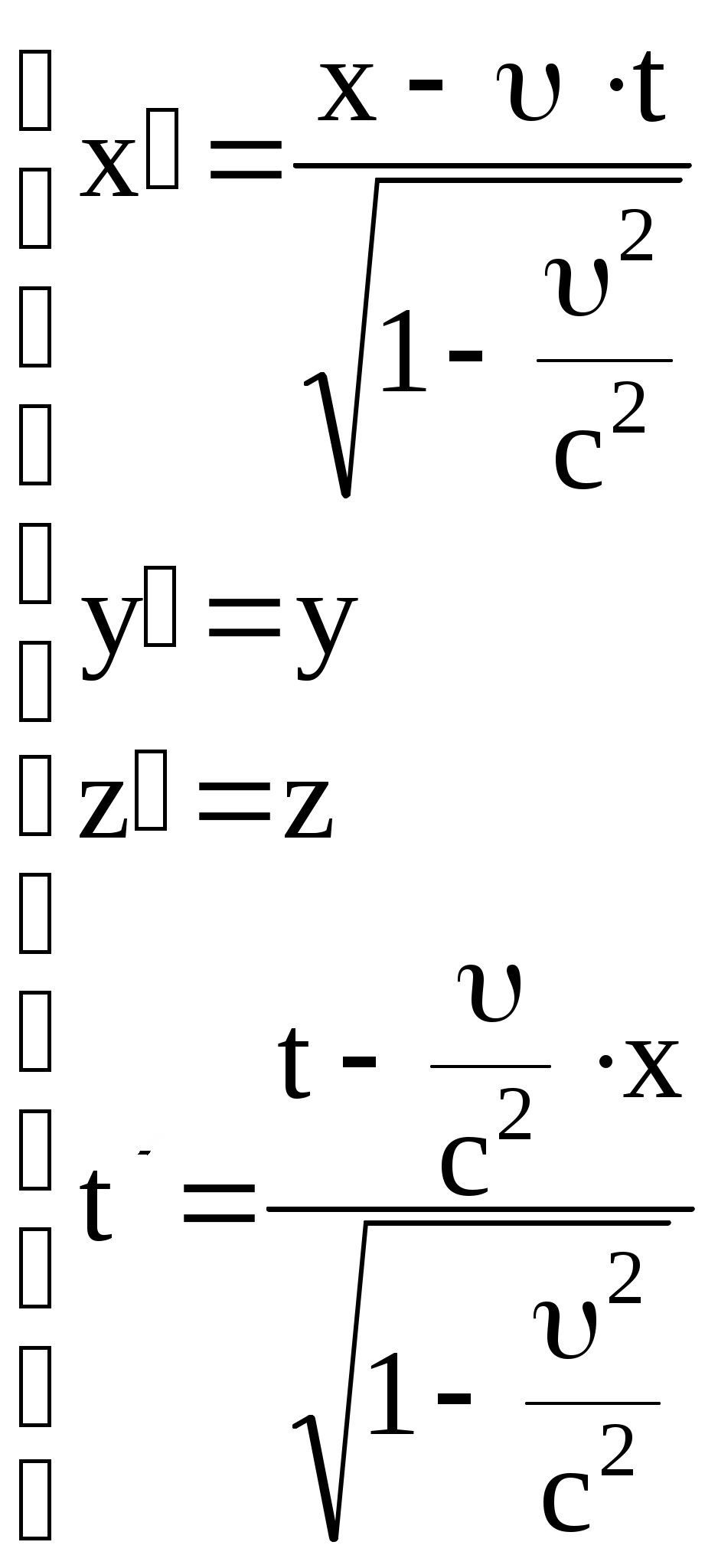 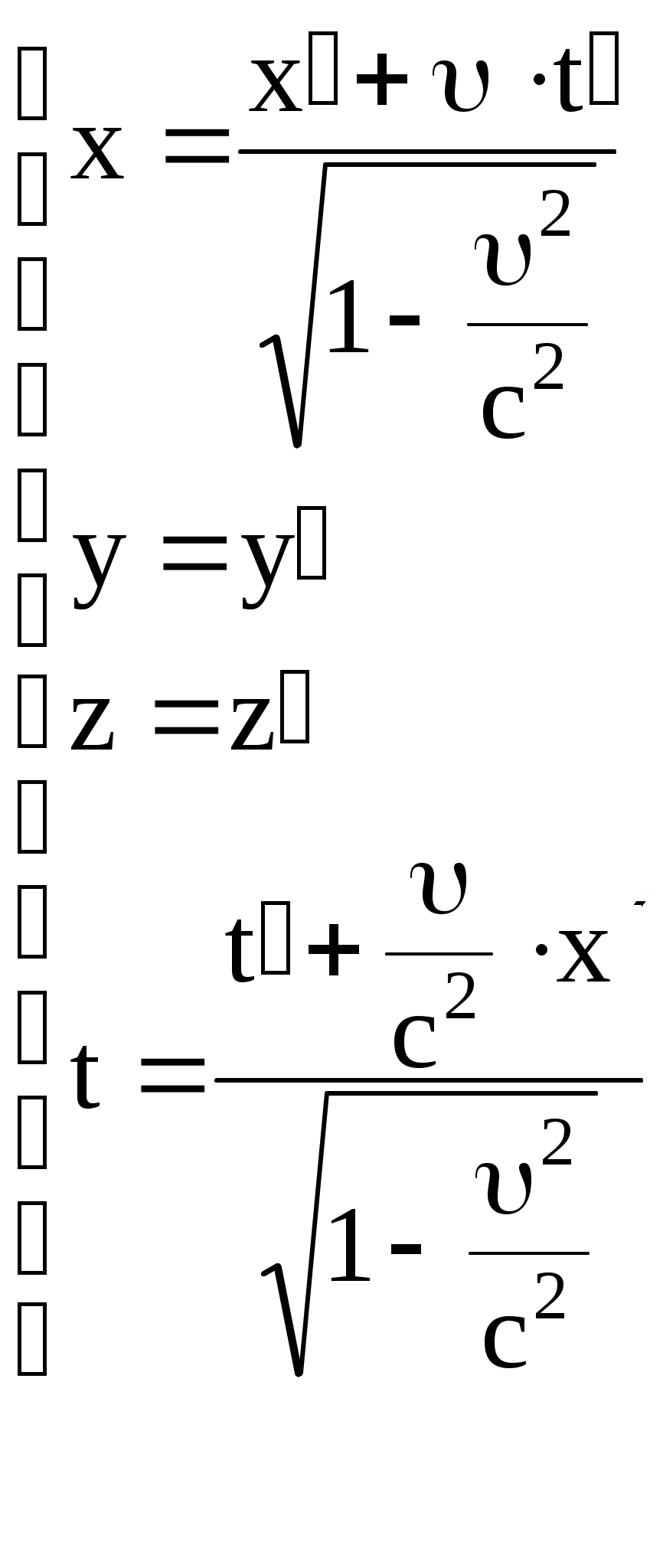 Здесь с = 3108 м/с – скорость света в вакууме.
5.2. Следствия из преобразований Лоренца
Рассмотрим системы  и и  (рис. 8). (рис. 8).
Относительность промежутков времени между событиями:
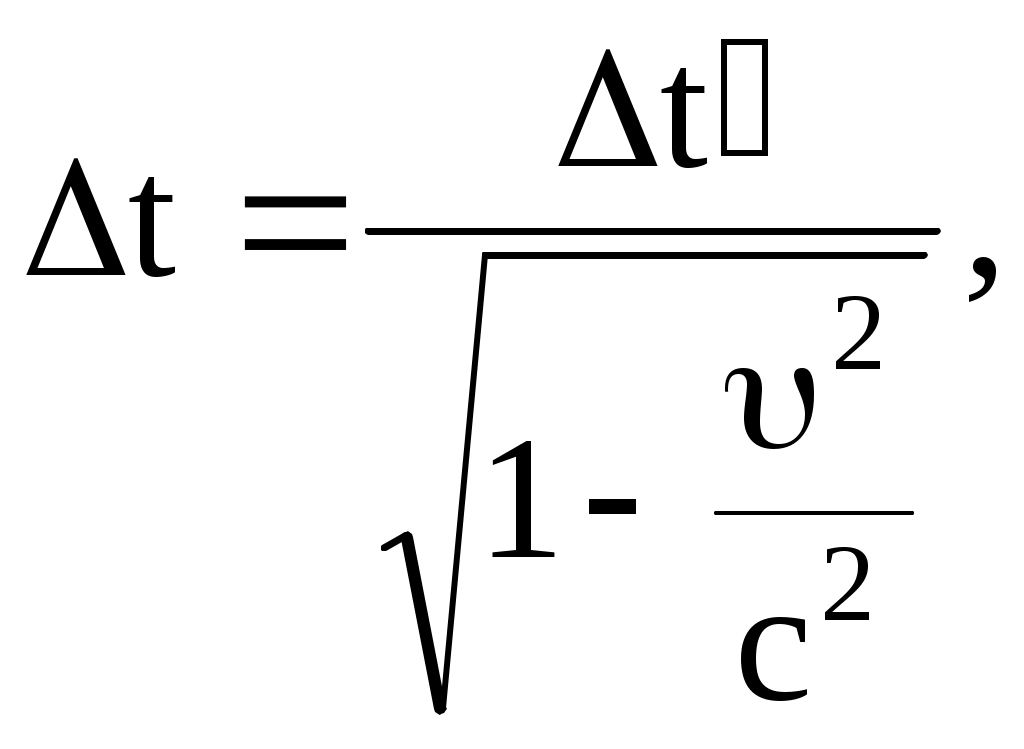
где  – промежуток времени между событиями, произошедшими в системе отсчета – промежуток времени между событиями, произошедшими в системе отсчета  ( ( отсчитывается по часам, находящимся в системе отсчитывается по часам, находящимся в системе  ); );  – промежуток времени между этими событиями, отсчитанный по часам, находящимся в системе – промежуток времени между этими событиями, отсчитанный по часам, находящимся в системе  . .
Изменение размеров движущихся тел
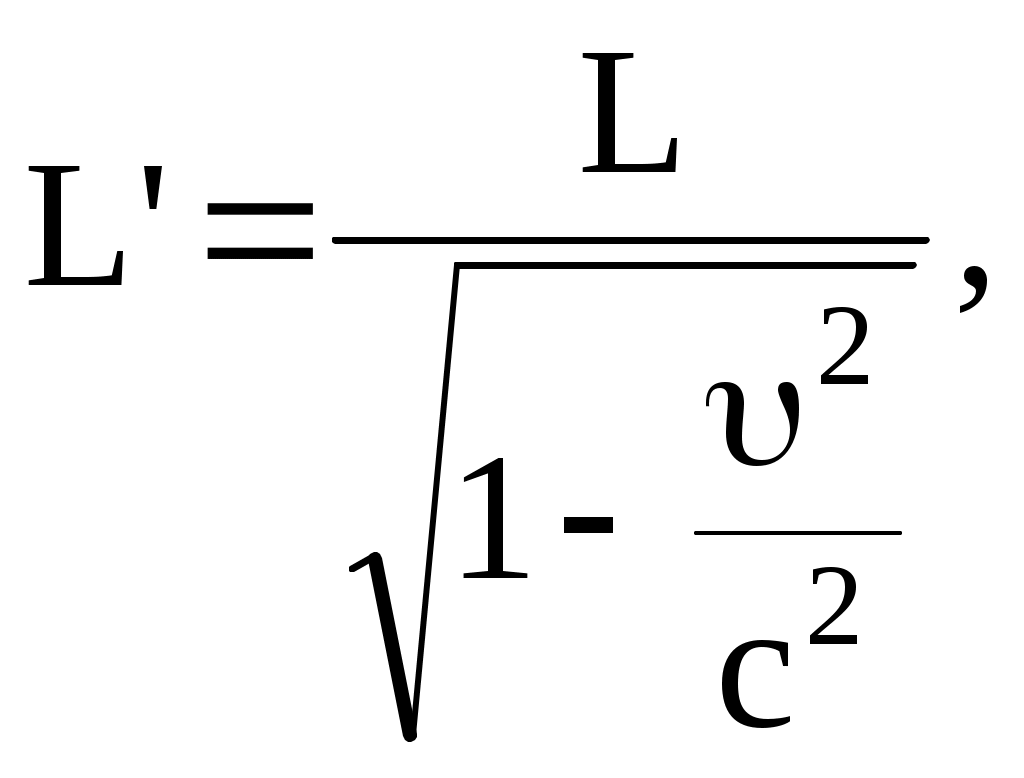
где L – длина стержня, расположенного вдоль оси 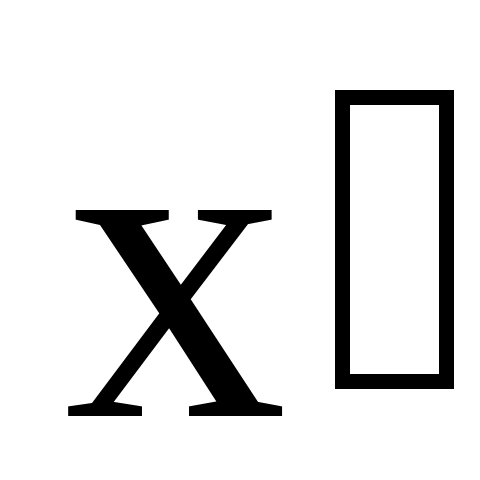 и покоящегося в системе S (отсчитывается в системе отсчета S); L – длина этого же стержня, измеренная в системе отсчета и покоящегося в системе S (отсчитывается в системе отсчета S); L – длина этого же стержня, измеренная в системе отсчета  . .
Релятивистский закон сложения скоростей:
Пусть некоторое тело движется вдоль оси x в системе отсчета  со скоростью со скоростью 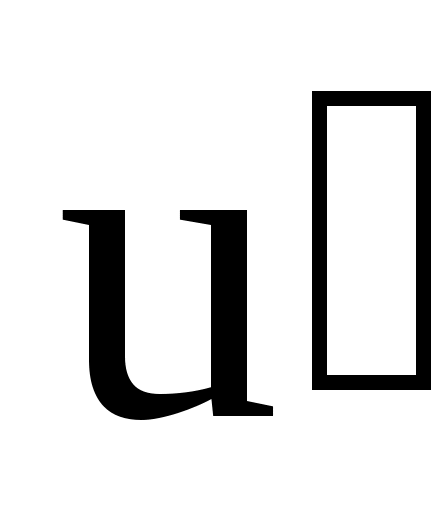 относительно последней. Найдем проекцию скорости относительно последней. Найдем проекцию скорости 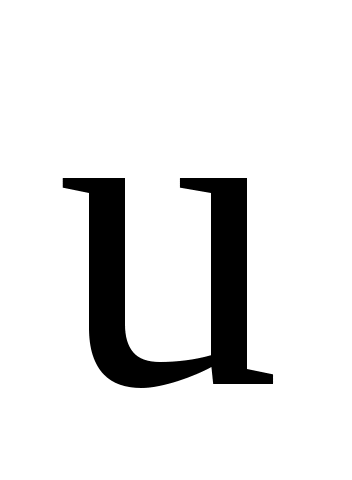 этого тела в системе отсчета этого тела в системе отсчета  на ось х этой системы: на ось х этой системы:
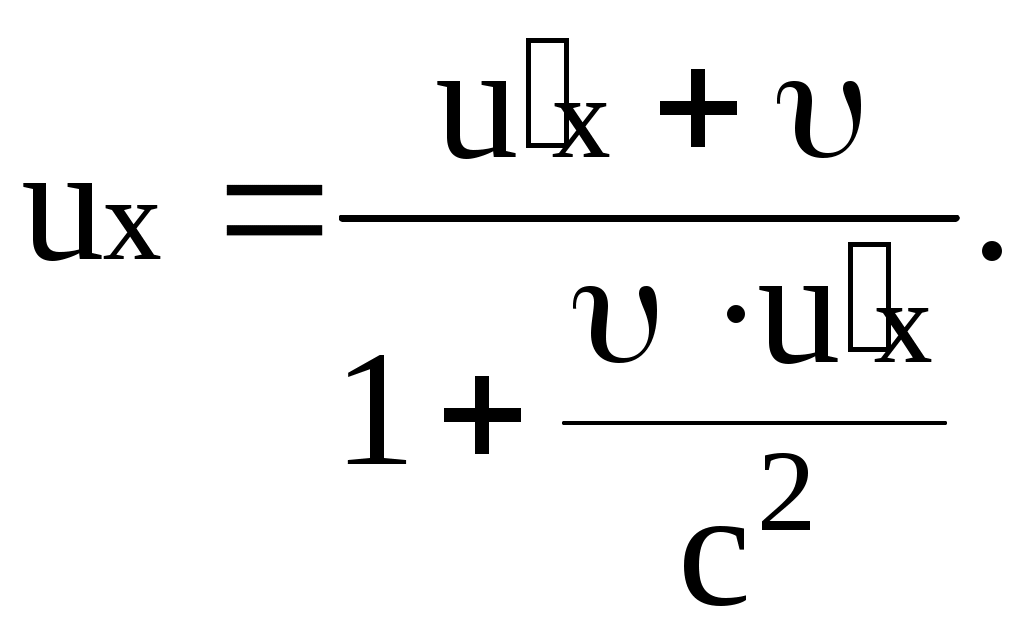
5.3. Релятивистские масса и импульс. Взаимосвязь массы и энергии
Эйнштейн показал, что масса тела зависит от его скорости:
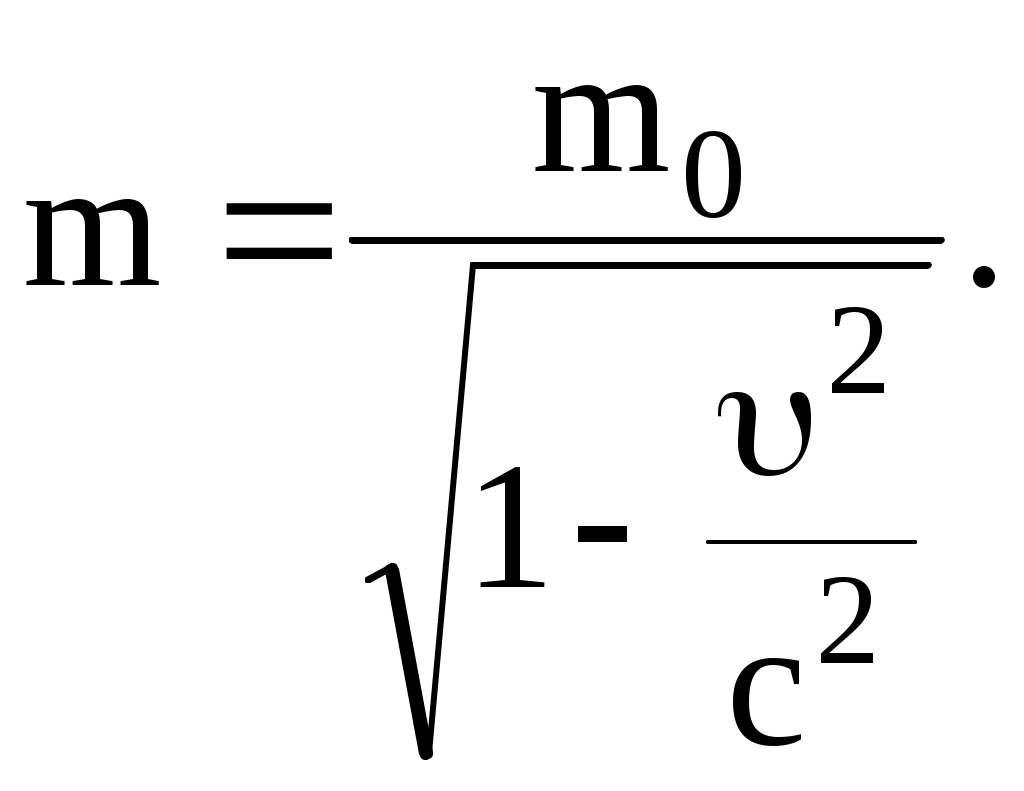
где m0 – масса тела в той системе отсчета, где тело покоится (масса покоя); m – масса тела в той системе, относительно которой тело движется (релятивистская масса); – скорость тела относительно системы отсчета, в которой определяется масса m.
Релятивистский импульс
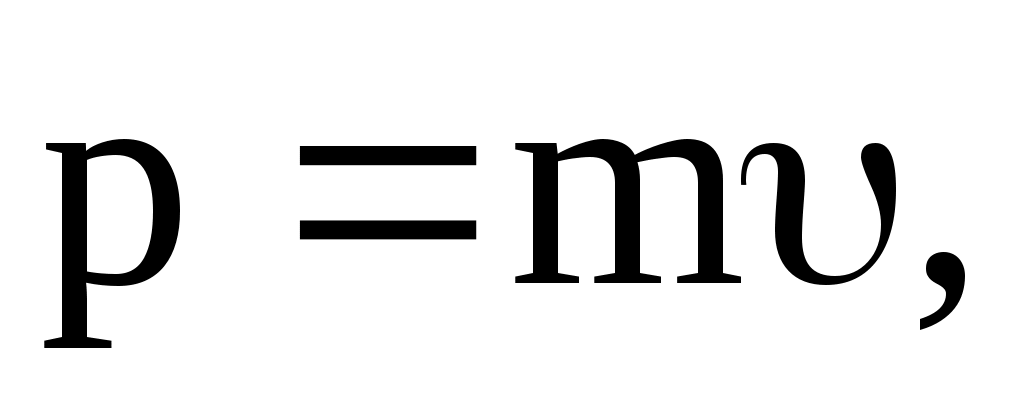
где m – релятивистская масса.
Закон взаимосвязи массы и энергии:
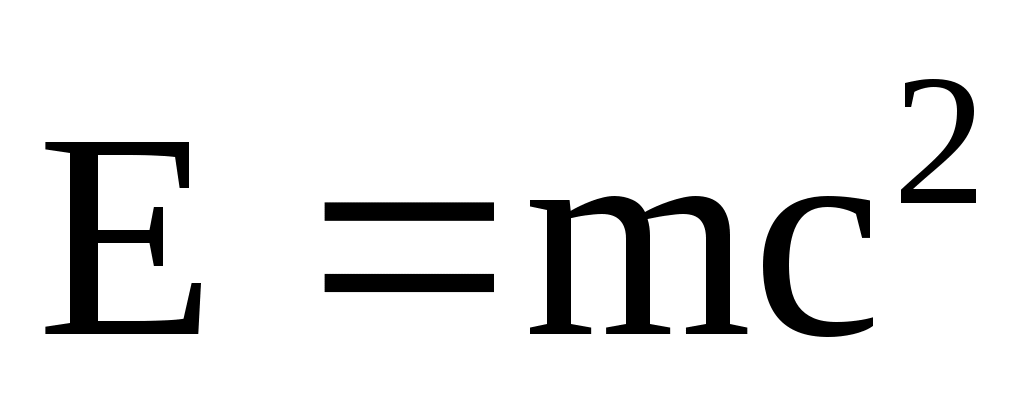 , ,
где m – релятивистская масса; Е – полная энергия материального объекта.
Кинетическая энергия объекта
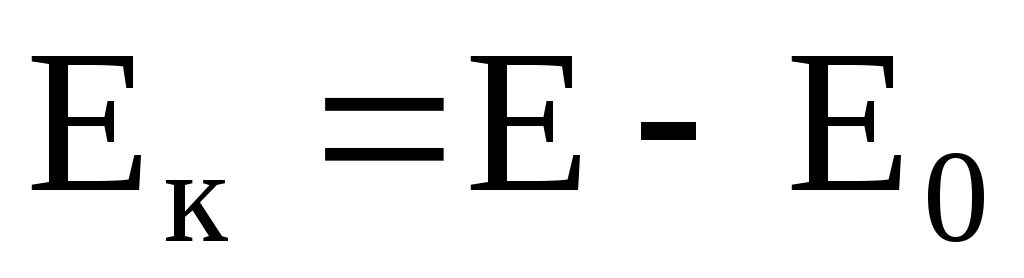 , ,
где 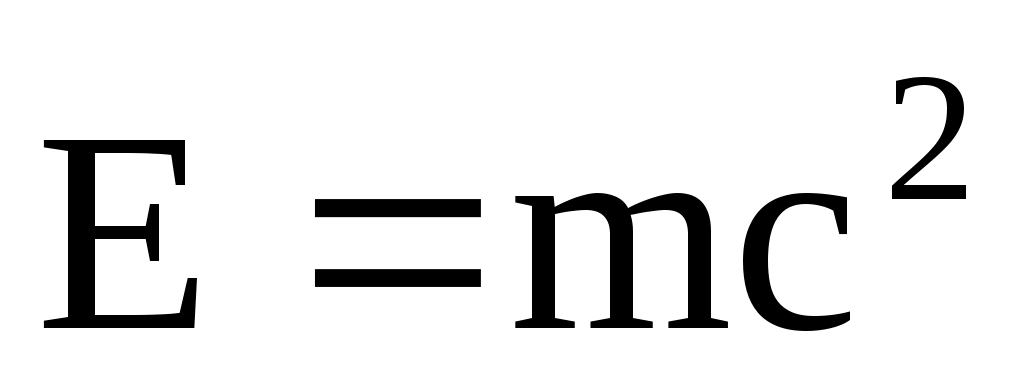 – полная энергия; – полная энергия; 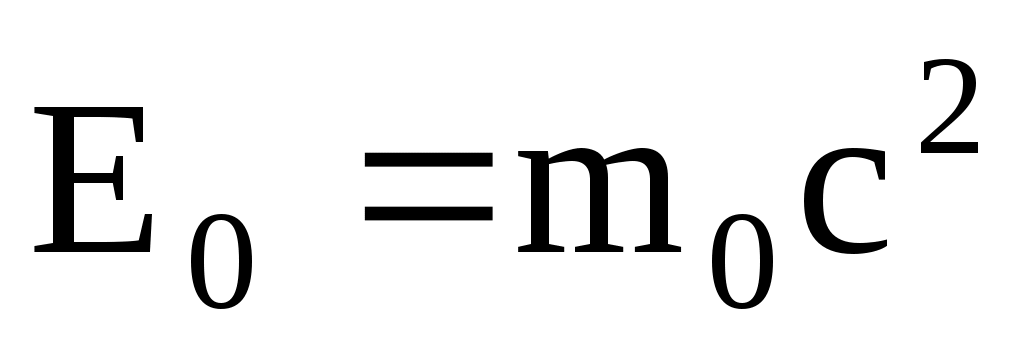 – энергия покоя. – энергия покоя.
Из закона взаимосвязи массы и энергии следует, что всякое изменение массы тела на m сопровождается изменением его энергии на E:
E=mc2.
II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ
Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул (макроскопические системы). Для исследования этих процессов применяются два качественно различных метода: статистический и термодинамический. Первый лежит в основе молекулярной физики, второй – термодинамики.
Молекулярная физика изучает макроскопические процессы исходя из представлений об атомно-молекулярной природе вещества и рассматривает теплоту как беспорядочное (тепловое) движение атомов и молекул. Тепловое движение определяет внутреннее состояние любого макроскопического тела (системы).
Термодинамика является аксиоматической наукой, она не вводит каких-либо конкретных представлений о строении вещества и физической природе теплоты. Ее выводы основаны на общих принципах или началах, которые являются обобщением опытных фактов. Теплота рассматривается как какое-то внутреннее движение без его конкретизации.
Важным свойством теплового движения является его способность «заставлять» макроскопическую систему «забывать» свое начальное состояние, если исключены меры, поддерживающие начальное состояние. Если систему поместить в неизменные внешние условия, то независимо от начального состояния системы она перейдет в стационарное состояние (не меняющееся со временем). При отсутствии движения через границы системы вещества, энергии, импульса, электрического заряда такое состояние называется состоянием теплового или термодинамического равновесия (равновесное состояние).
Свойства равновесного состояния не зависят от деталей движения отдельных частиц, а определяются поведением всей их совокупности. Это поведение характеризуется небольшим числом величин, называемых термодинамическими параметрами. Равновесное состояние системы характеризуется постоянством во времени ее параметров. Термодинамические параметры определяют некую усредненную картину движения частиц системы, поэтому они имеют смысл средних значений физических величин, описывающих поведение отдельных частиц системы. Это проявляется в существовании статистических флуктуаций значений термодинамических параметров, которые в равновесном состоянии очень малы.
Процесс самопроизвольного перехода системы в равновесное состояние называется релаксацией, а время этого процесса временем релаксации. До истечения времени релаксации состояние системы остается неравновесным, а сам процесс релаксации является неравновесным.
При изменении внешних условий или воздействии на систему параметры состояния будут изменяться и система перейдет в новое состояние. Этот процесс перехода называется термодинамическим процессом, он может быть равновесным или неравновесным. Процесс называется равновесным, если в ходе его система проходит последовательность равновесных состояний. Равновесными процессами являются бесконечно медленно протекающие процессы (хорошим приближением являются процессы, время протекания которых много больше времени температурной релаксации). Равновесное состояние и равновесный процесс изображаются на диаграмме состояний соответственно точкой и линией.
Рассмотрим основные термодинамические параметры: V – объем системы или тела; Р – давление (абсолютное значение средней силы, действующей со стороны вещества жидкости или газа на каждую из поверхностей помещенной в них единичной площадки); Т – абсолютная температура, характеризует интенсивность теплового движения частиц системы. В случае классического характера движения частиц системы средняя кинетическая энергия поступательного движения одной частицы пропорциональна температуре:
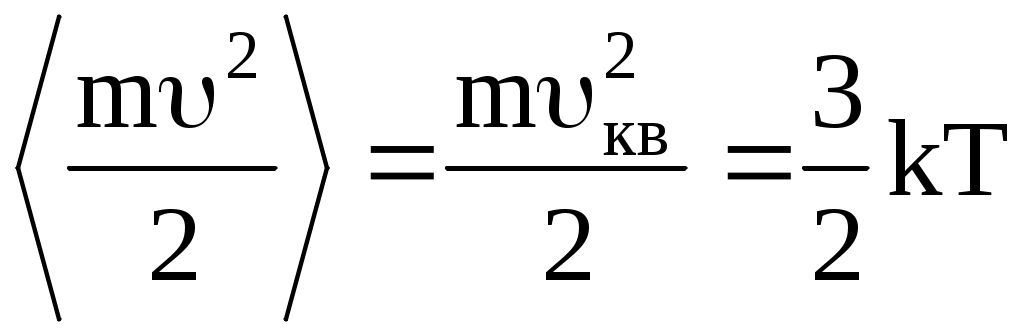 , ,
где m – масса одной частицы, – ее скорость, кв – средняя квадратичная скорость движения молекул, k = 1,3810-23Дж/К – постоянная Больцмана.
1. Молекулярно-кинетическая теория идеальных газов
1.1. Уравнение состояния
В состоянии термодинамического равновесия объем V, давление Р и температура Т находятся в функциональной зависимости, которую можно выразить уравнением
F (P,V,T) = 0.
Это соотношение называется уравнением состояния тела (системы). Вид функции F(P,V,T) различен для разных тел и точно установлен только в одном случае, а именно для идеального газа. Идеальным называется газ, в котором
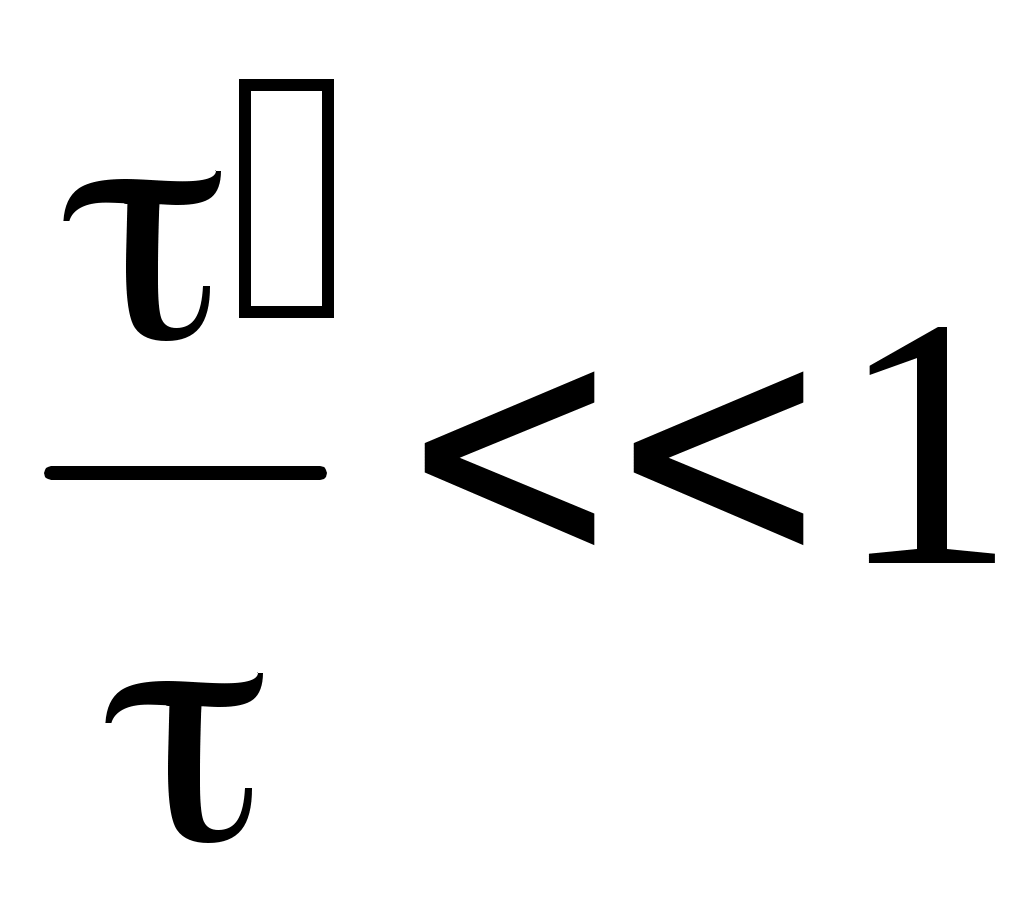 , ,
где среднее время столкновения частиц, среднее время свободного пробега частиц. При этом средняя длина свободного пробега частиц должна быть много меньше размеров сосуда, в котором заключен газ. Данные условия выполняются достаточно хорошо для газов, молекулы которых имеют простое строение даже при давлениях, близких к атмосферному.
Уравнение состояния идеального газа можно получить, рассмотрев давление, создаваемое газом на стенку сосуда. Оно возникает в результате передачи импульса участку стенки при столкновениях с ним молекул газа. Учитывая, что в равновесном состоянии соударения молекул в среднем носят упругий характер, давление идеального газа оказывается пропорциональным средней энергии поступательного движения частиц, заключенных в единице объема:
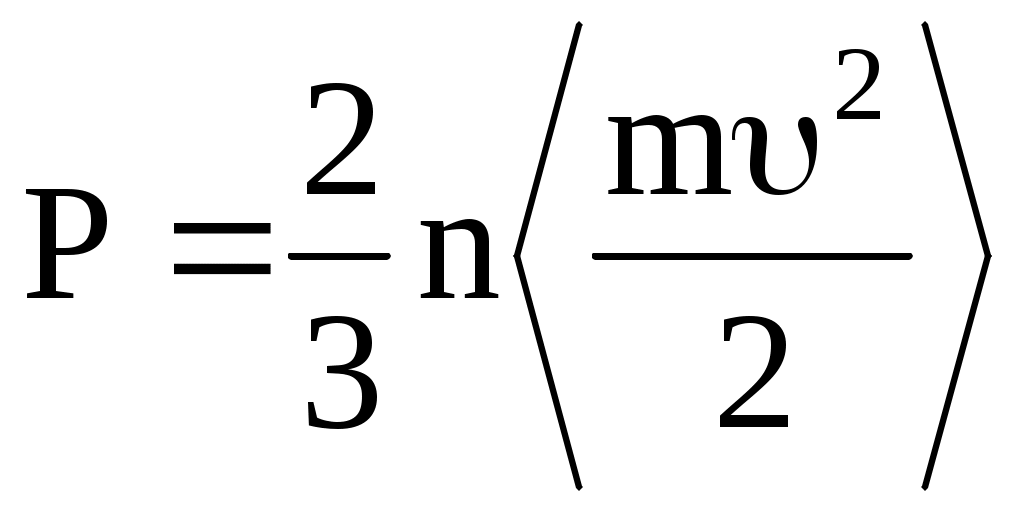 , ,
где n – плотность (концентрация) частиц, n = N/V, N – число частиц.
Используя связь кинетической энергии молекул и температуры, получаем
P = nkT.
Существует несколько форм записи этого уравнения:
PV = NkT;
PV = 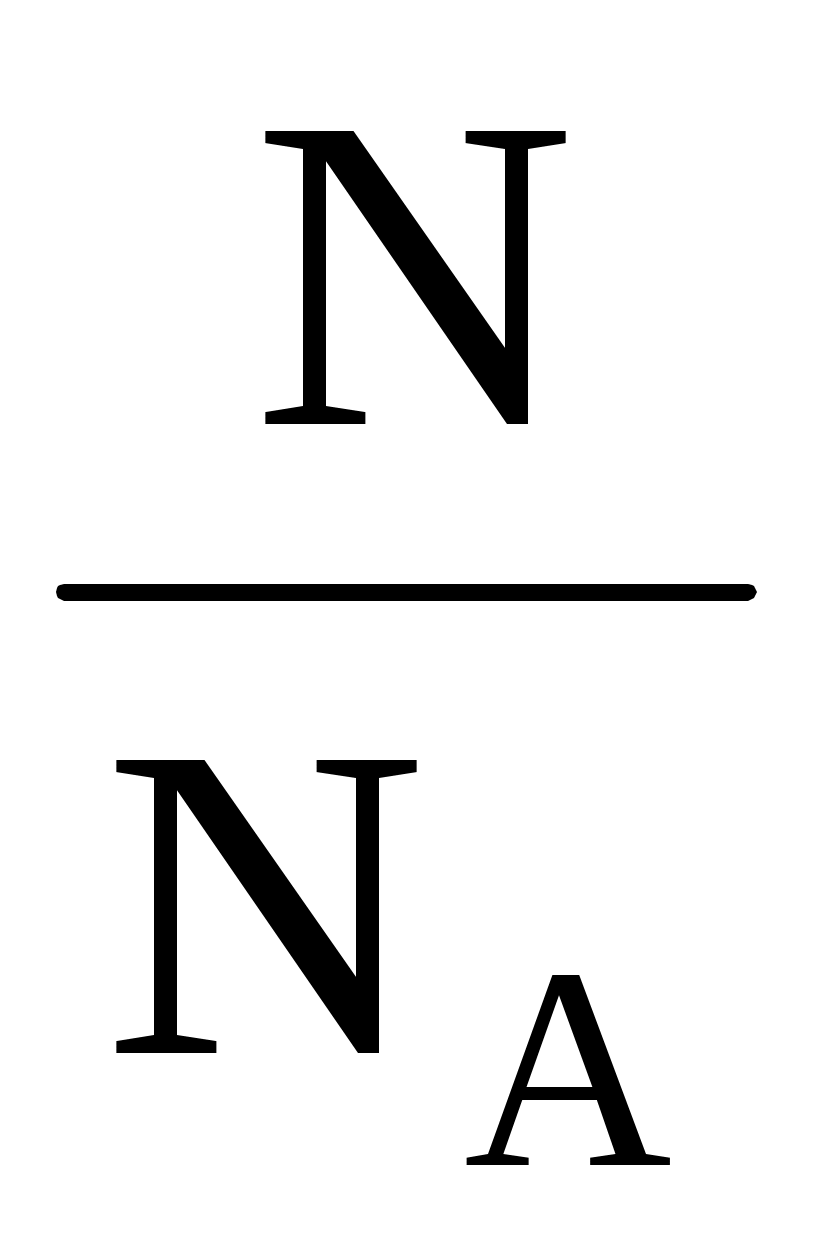 NAkT = RT, NAkT = RT,
где =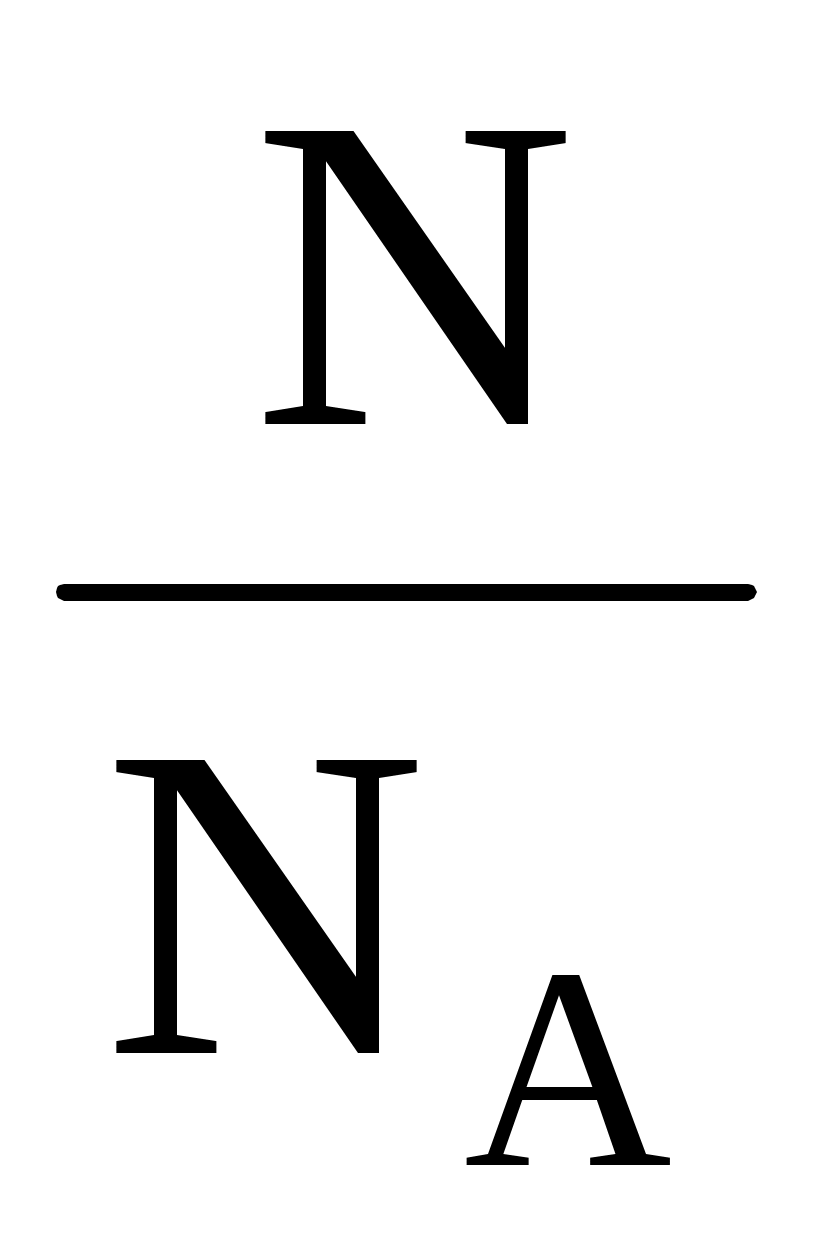 – количество вещества, R = NAk = 8,31 Дж/(мольК) – универсальная газовая постоянная. Используя выражение для количества вещества через массу и молярную массу газа можно получить известное уравнение Клапейрона – Менделеева – количество вещества, R = NAk = 8,31 Дж/(мольК) – универсальная газовая постоянная. Используя выражение для количества вещества через массу и молярную массу газа можно получить известное уравнение Клапейрона – Менделеева
PV =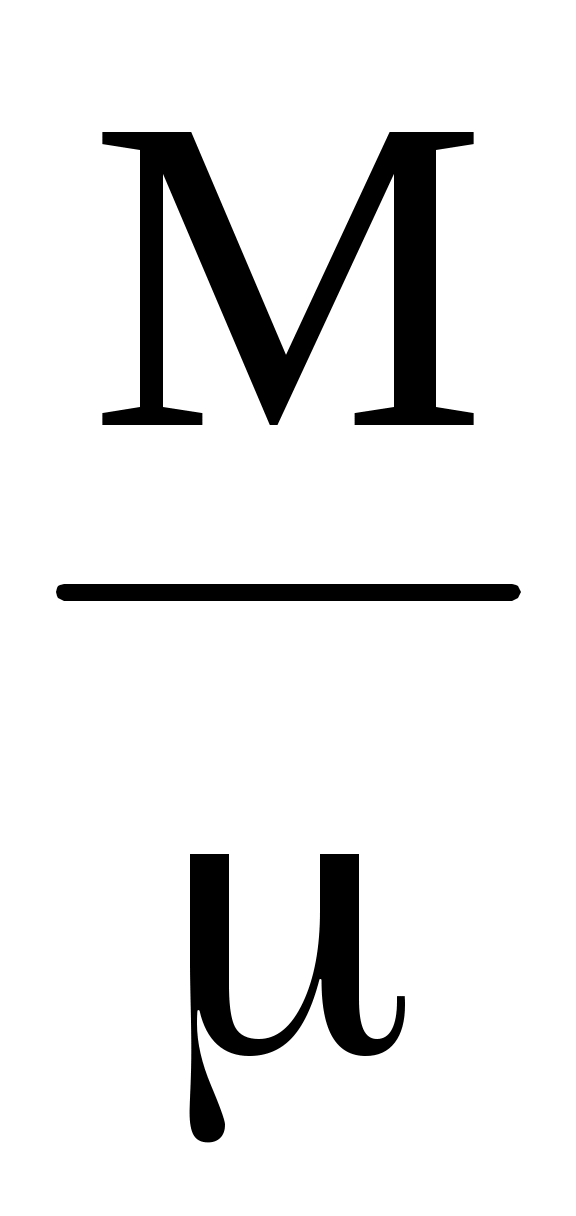 RT, RT,
где М – масса газа, – молярная масса газа.
Из последнего уравнения состояния можно получить известный закон Дальтона и уравнения изопроцессов:
а) давление механической смеси газов равно сумме парциальных давлений газов, входящих в смесь:
PV = (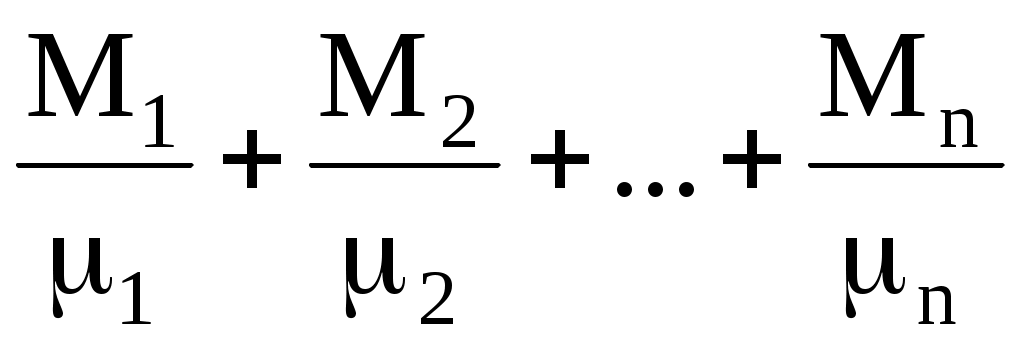 )RT; )RT;
б) изотермический процесс – Т=const, PV = const, P1V1 = P2V2;
изобарический процесс – P = const, 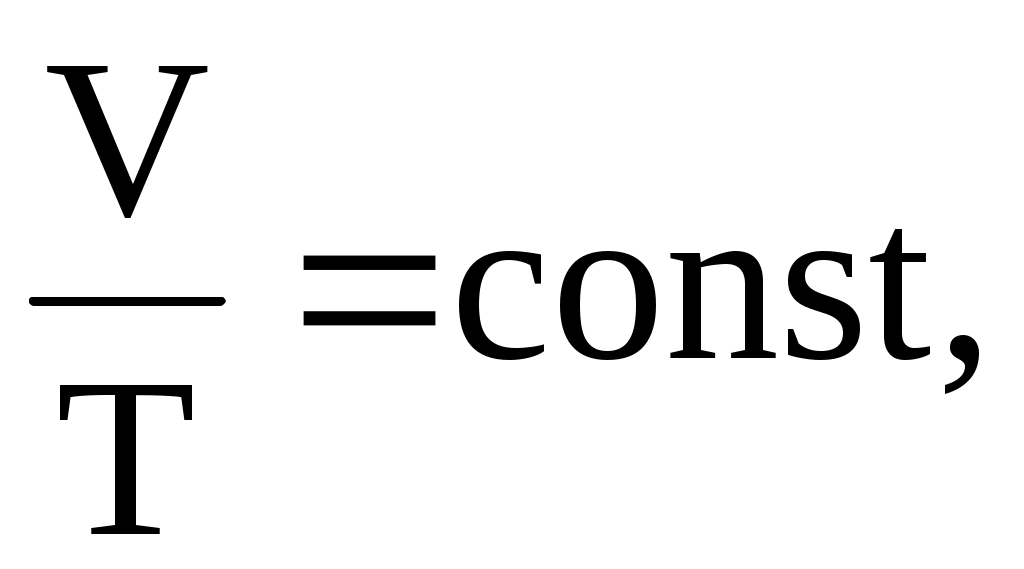 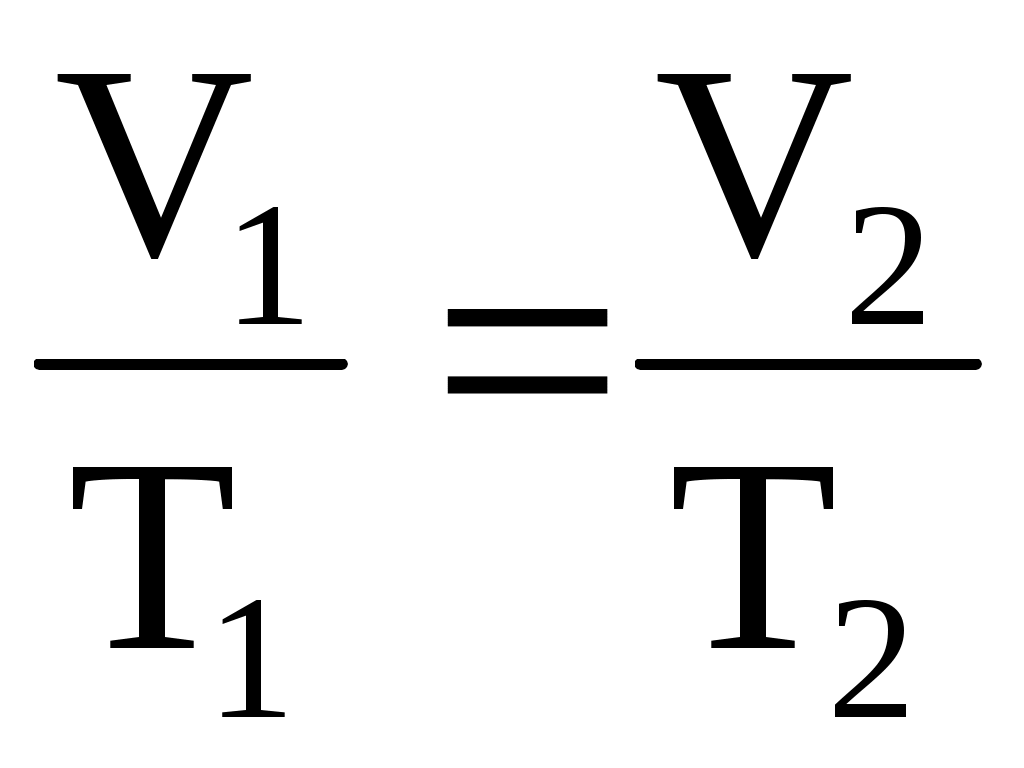 ; ;
изохорический процесс – V = const, 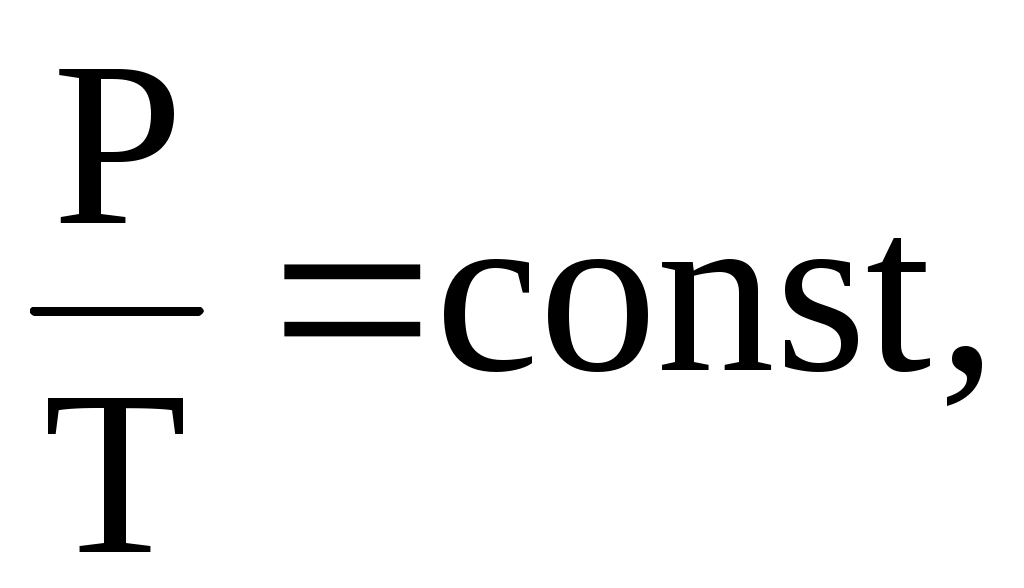 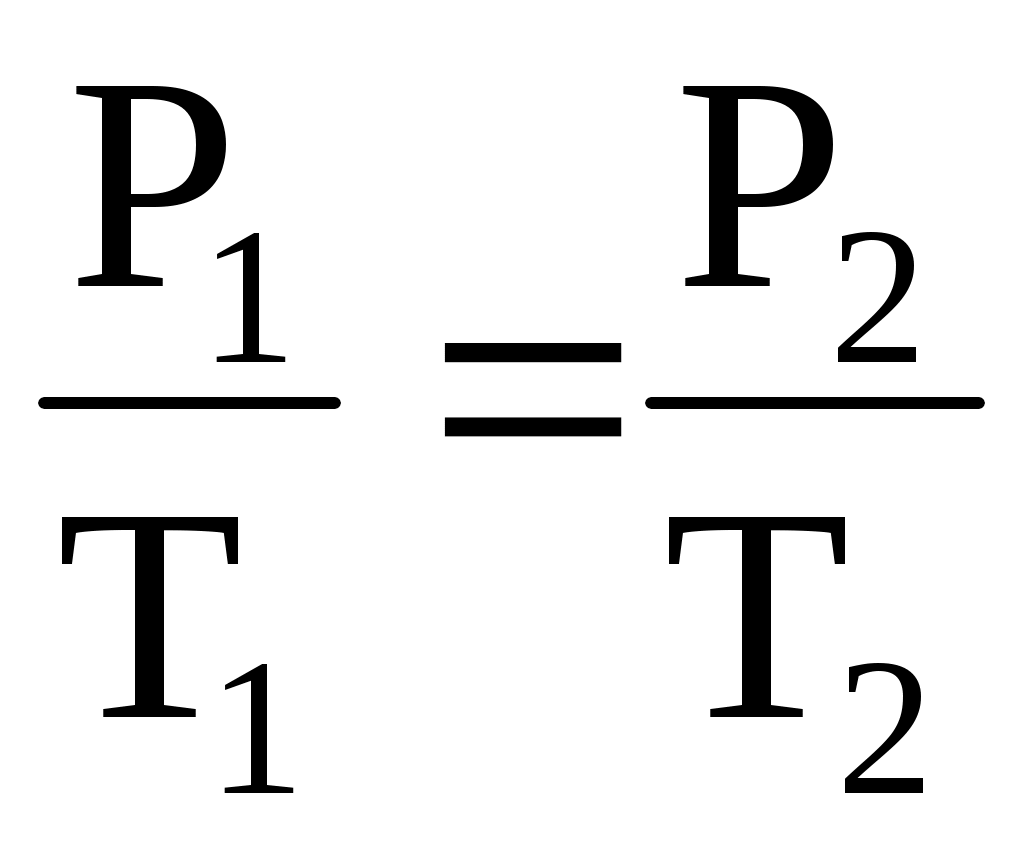 . .
1.2. Уравнение состояния Ван-дер-Ваальса
При увеличении плотности (давления) поведение газа все сильнее отличается от поведения идеального газа. Это объясняется тем, что при малых средних расстояниях между молекулами все большее значение приобретают силы межмолекулярного взаимодействия. На малых расстояниях эти силы являются силами отталкивания, а на больших – силами притяжения. Влияние этих сил на вид уравнения состояния можно приближенно учесть следующим образом. Для реальных газов давление должно резко возрастать при конечном объеме, равном по порядку величины объему всех частиц газа. Обозначим этот конечный объем для одного моля через b, тогда давление газа может быть записано в виде
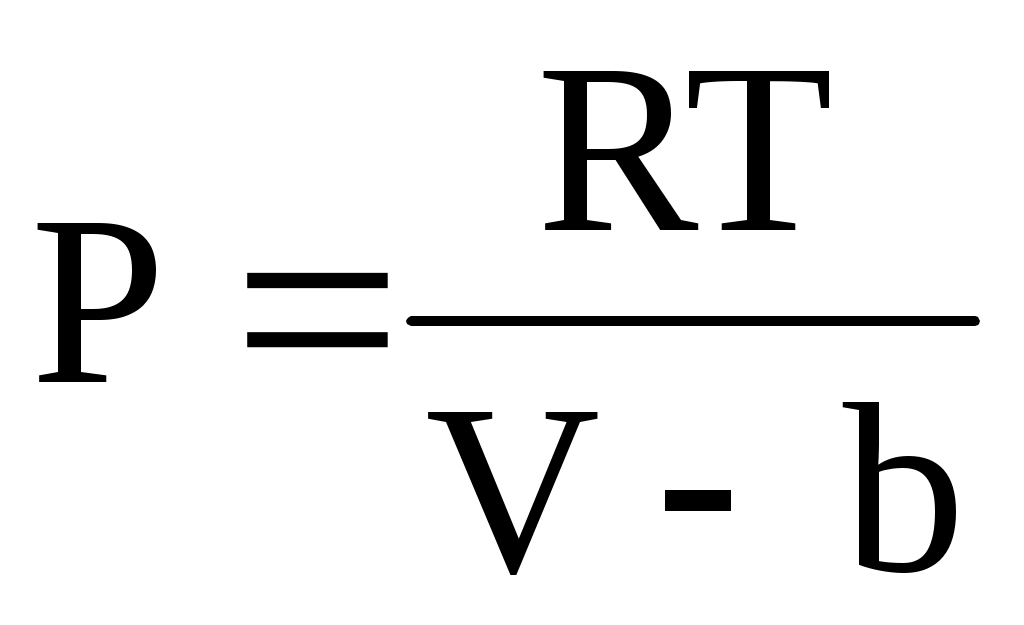 . .
Действие сил притяжения между молекулами проявляется в уменьшении давления газа по сравнению с приведенной величиной. Уменьшение давления связано с тем, что на молекулу, находящуюся у стенки сосуда, действует сила, направленная внутрь сосуда. Она обусловлена притяжением со стороны молекул газа, находящихся в его объеме. В первом приближении ее величина пропорциональна концентрации молекул n =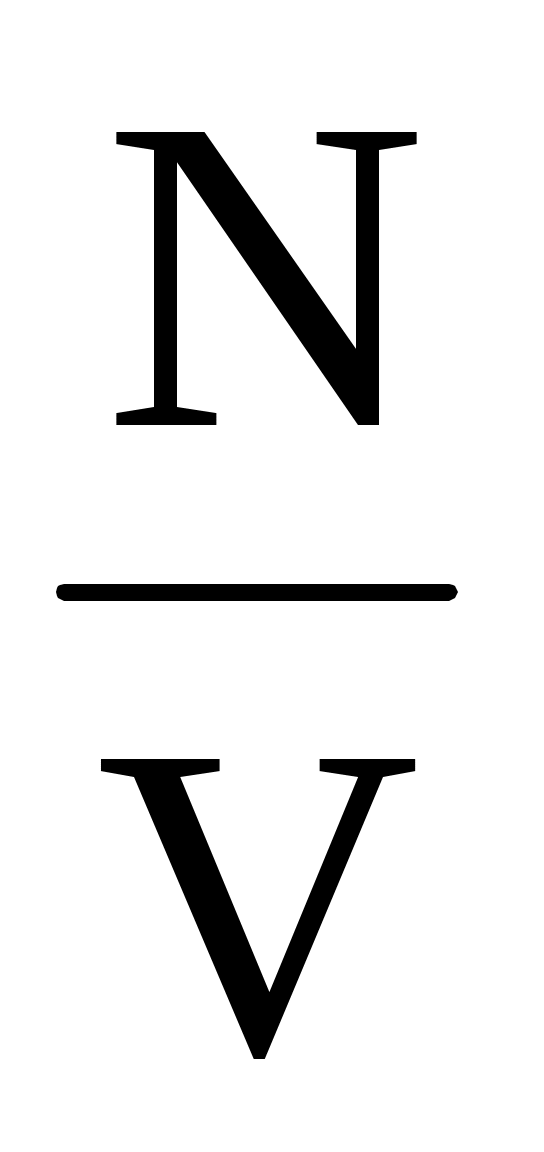 , а, учитывая, что давление само пропорционально концентрации, поправка на уменьшение давления будет пропорциональна n2 = , а, учитывая, что давление само пропорционально концентрации, поправка на уменьшение давления будет пропорциональна n2 = 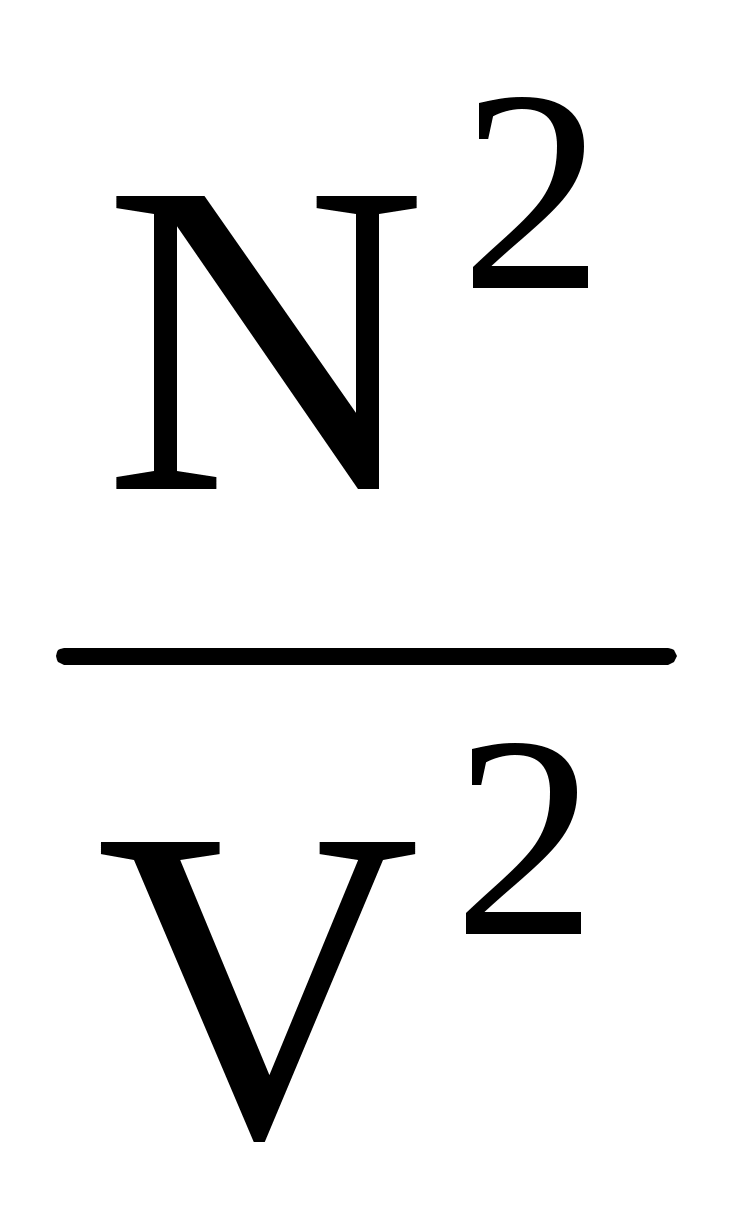 . Учитывая это, можно прийти к соотношению . Учитывая это, можно прийти к соотношению
P = 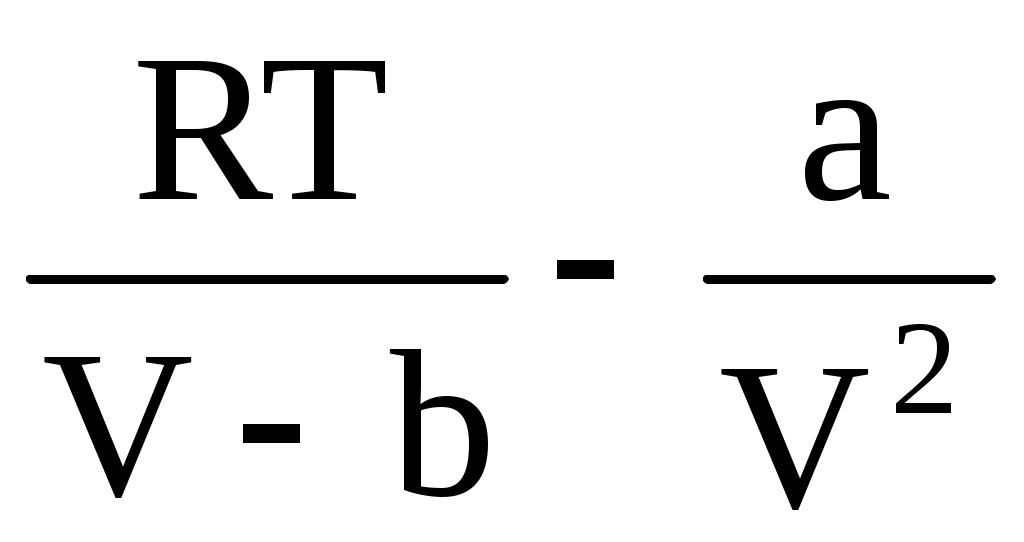 , ,
которое в форме 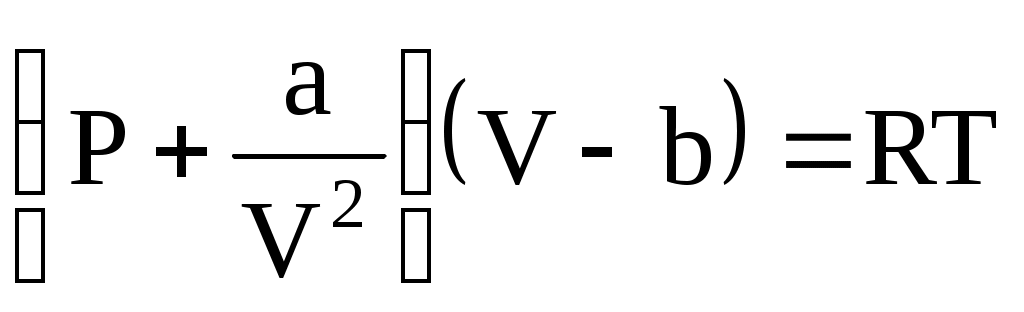 называется уравнением Ван-дер-Ваальса (для одного моля газа). Поправки a и b – постоянные Ван-дер-Ваальса, учитывающие соответственно действие сил притяжения и отталкивания между молекулами газа. называется уравнением Ван-дер-Ваальса (для одного моля газа). Поправки a и b – постоянные Ван-дер-Ваальса, учитывающие соответственно действие сил притяжения и отталкивания между молекулами газа.
1.3. Внутренняя энергия
Важной характеристикой состояния системы является ее внутренняя энергия. Она определяется как среднее значение полной энергии ее частиц. Во внутренней энергии можно выделить следующие составляющие:
- энергия поступательного, вращательного и колебательного движений атомов и молекул;
- энергия межмолекулярного взаимодействия;
- энергия связи атомов в молекулах (химическая энергия);
- энергия связи электронов в атомах;
- энергия связи атомных ядер и др.
При различных процессах в системе изменяется внутренняя энергия. Как правило, это происходит из-за изменения одной или нескольких составляющих внутренней энергии, поэтому и в самой внутренней энергии следует учитывать только те составляющие, которые изменяются в ходе процесса. Отметим общие свойства внутренней энергии:
- в состоянии теплового равновесия движение частиц системы таково, что в любой момент времени полная энергия частиц с высокой степенью точности равна внутренней энергии (статистические флуктуации очень малы);
- внутренняя энергия системы является функцией ее термодинамических параметров;
- внутренняя энергия обладает свойством аддитивности, т.е. внутренняя энергия системы равна сумме внутренних энергий частей (макроскопических), составляющих данную систему.
Определим внутреннюю энергию идеального газа в равновесном состоянии – это энергия поступательного, вращательного и колебательного движений атомов и молекул. Поступательное движение частиц газа носит классический характер, а вращательное и колебательное движение – квантовый, т.е. такие движения возникают только про сообщении молекулам конечной порции энергии Е. Для большинства газов Екол 10-20Дж, что соответствует температуре Ткол 103 К, Евр10-21 Дж, а температура Твр 10 К. Общая закономерность квантовых движений следующая: с ростом температуры квантовое движение быстро приобретает классический характер. Поэтому при обычных условиях можно движение молекул считать классическим и для вычисления внутренней энергии воспользоваться законом равнораспределения энергии по классическим степеням свободы: «В состоянии теплового равновесия на каждую поступательную и вращательную степень свободы приходится в среднем энергия, равная кТ/2, а на колебательную – кТ».
Числом степеней свободы называется минимальное количество координат, однозначно определяющих положение тела (системы) в пространстве, или количество независимых движений, благодаря которым тело обладает энергией. В атомарном газе каждый атом имеет три поступательных степени свободы, в газе с двухатомными молекулами каждая молекула имеет три поступательных и две вращательных степени свободы, в газе с многоатомными молекулами, в общем случае, три поступательных и три вращательных. Тогда внутренняя энергия газ имеет вид
U = N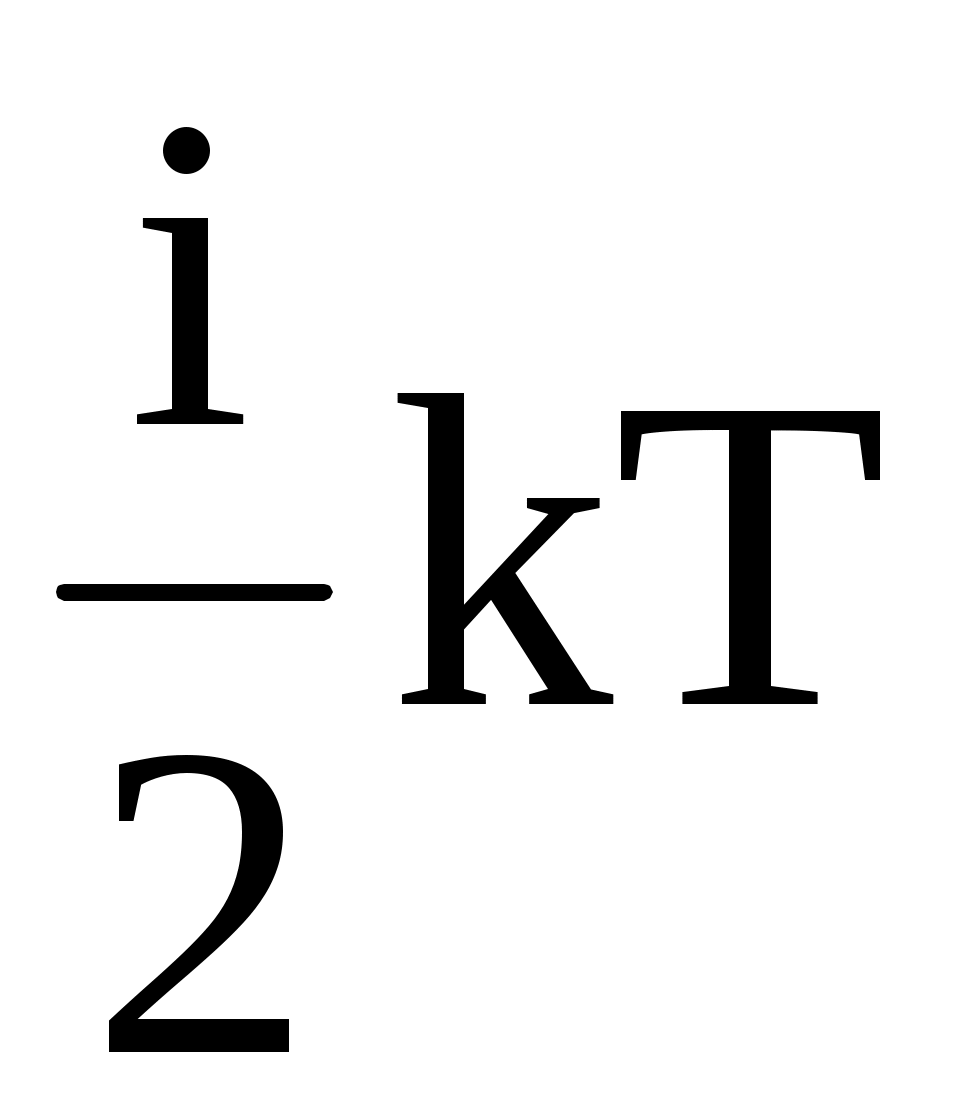 = = 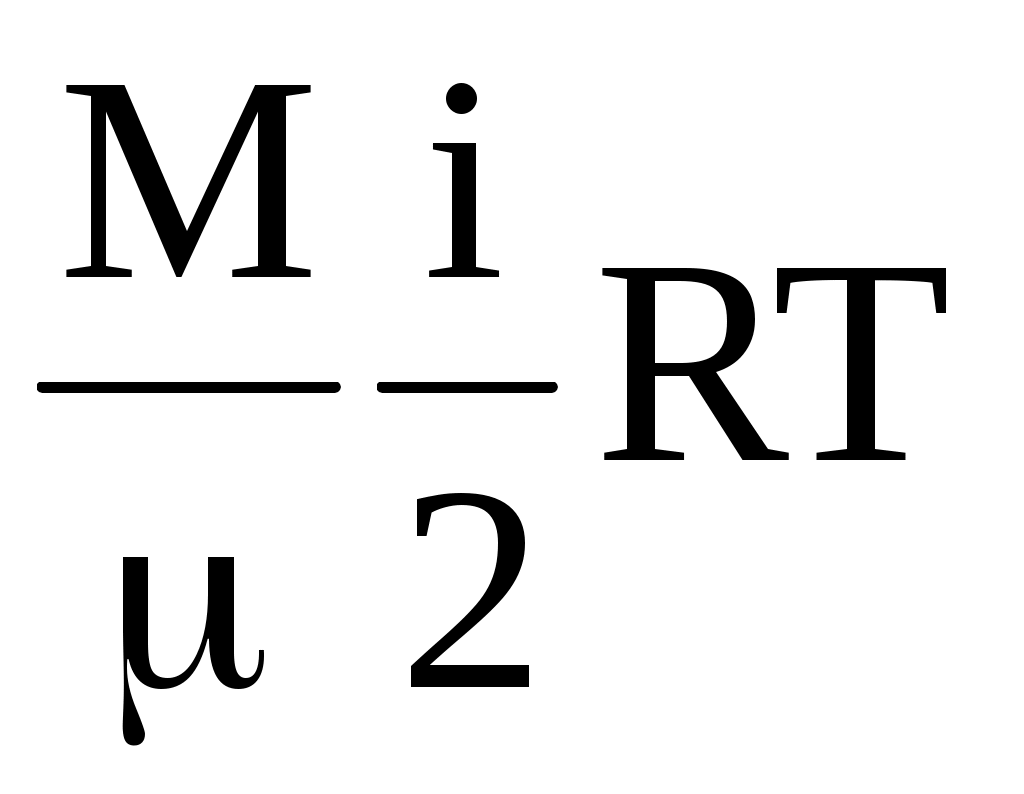 , ,
где i – число степеней свободы молекул газа.
1.4. Статистические распределения
При тепловом движении положения частиц, величина и направление их скоростей изменяются случайным образом. Вследствие гигантского числа частиц случайный характер их движения, проявляется в существовании определенных статистических закономерностей в распределении частиц системы по координатам, значениям скоростей и т.д. Подобные распределения характеризуются соответствующими функциями распределения. Функция распределения (плотность вероятности) характеризует распределения частиц по соответствующей переменной (координаты, величины скоростей и т.д). В основе классической статистики лежат следующие положения:
- все частицы классической системы различимы (т.е. их можно пронумеровать и следить за каждой частицей);
- все динамические переменные, характеризующие состояние частицы, изменяются непрерывно;
- в заданном состоянии может находиться неограниченное число частиц.
1.4.1. Распределение Максвелла
В состоянии теплового равновесия как бы не изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул в газе, при Т=cоnst, остается постоянной и равной 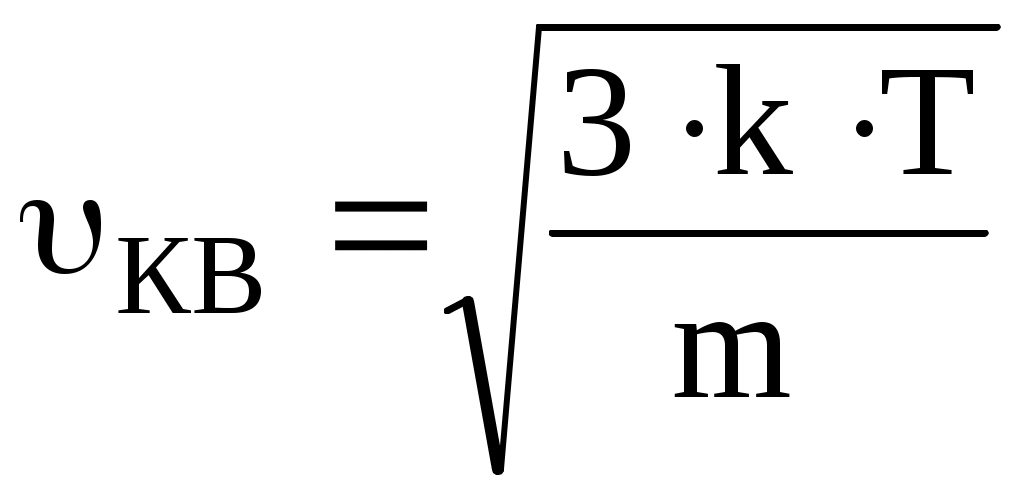 . Это объясняется тем, что в газе устанавливается некоторое стационарное статистическое распределение молекул по значениям скоростей, называемое распределением Максвелла. Распределение Максвелла описывается некоторой функцией f(), называемой функцией распределения молекул по скоростям. . Это объясняется тем, что в газе устанавливается некоторое стационарное статистическое распределение молекул по значениям скоростей, называемое распределением Максвелла. Распределение Максвелла описывается некоторой функцией f(), называемой функцией распределения молекул по скоростям.
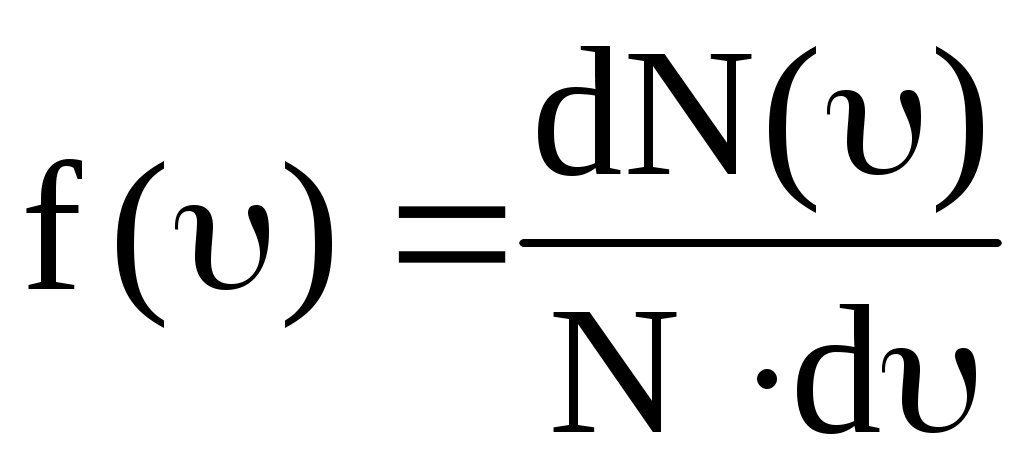 , ,
где N – общее число молекул, dN() – число молекул, скорости которых принадлежат интервалу скоростей от до + d.
Таким образом, функция Максвелла f() равна вероятности того, что величина скорости наугад выбранной молекулы принадлежит единичному интервалу скоростей вблизи значения . Или она равна доле молекул, скорости которых принадлежат единичному интервалу скоростей вблизи значения .
Явный вид функции f() был получен теоретически Максвеллом:
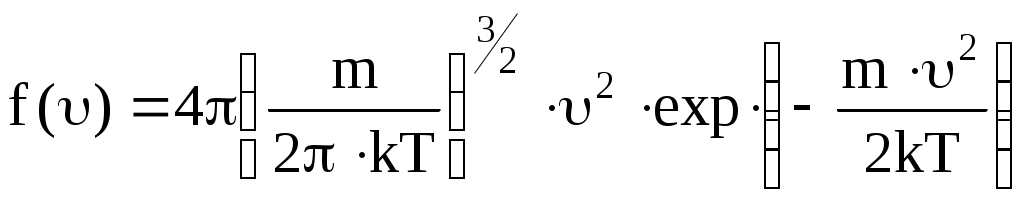 . .
График функции распределения приведен на рис. 12. Из графика следует, что функция распределения стремится к нулю при 0 и и проходит через максимум при некоторой скорости В, называемой наиболее вероятной скоростью. Этой скоростью и близкой к ней обладает наибольшее число молекул. Кривая несимметрична относительно В. Значение наиболее вероятной скорости можно найти, используя условие для максимума функции f().
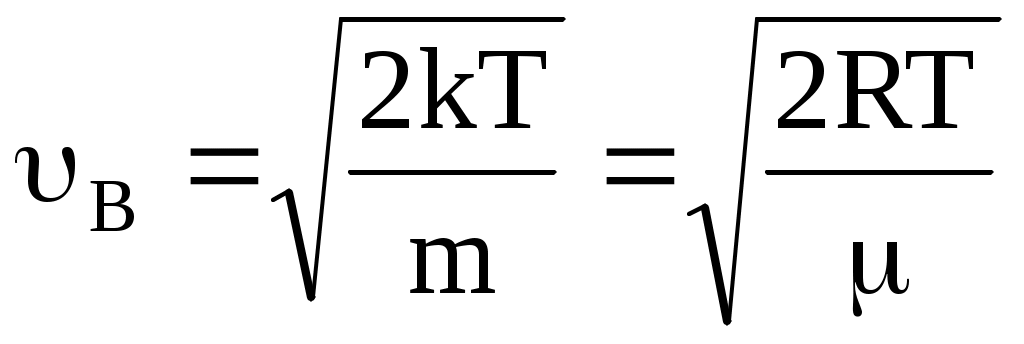 . .
На рис. 13 показано смещение В с изменением температуры, при этом площадь под графиком остается постоянной и равной 1, что следует из условия нормировки функции Максвелла
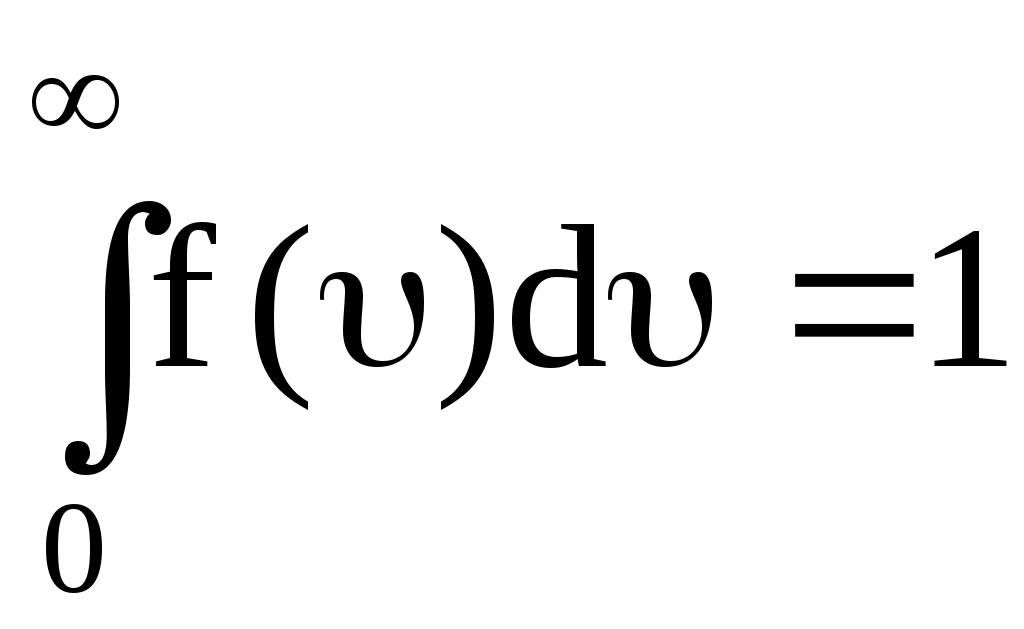 . .
Условие нормировки следует из смысла данного интеграла – он определяет вероятность того, что скорость молекулы попадает в интервал скоростей от 0 до . Это достоверное событие, его вероятность, по определению, принимается равной 1.
Знание функции распределения молекул газа по скоростям позволяет вычислять средние значения любых функций скорости, в частности средней арифметической скорости <>.
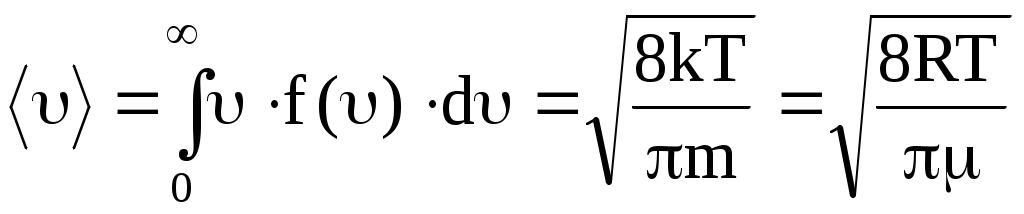 . .
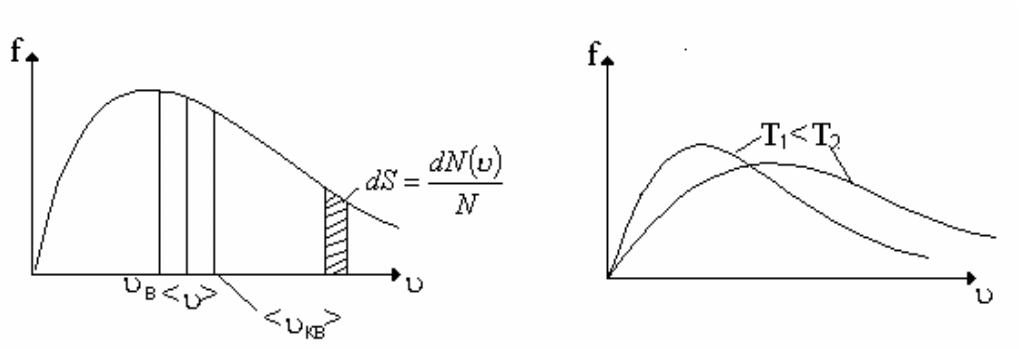
Рис.12 Рис. 13
По функции Максвелла можно определить долю молекул, скорости которых принадлежат заданному интервалу скоростей или превышают некоторое значение скорости, например вторую космическую, что определяет рассеяние атмосферы.
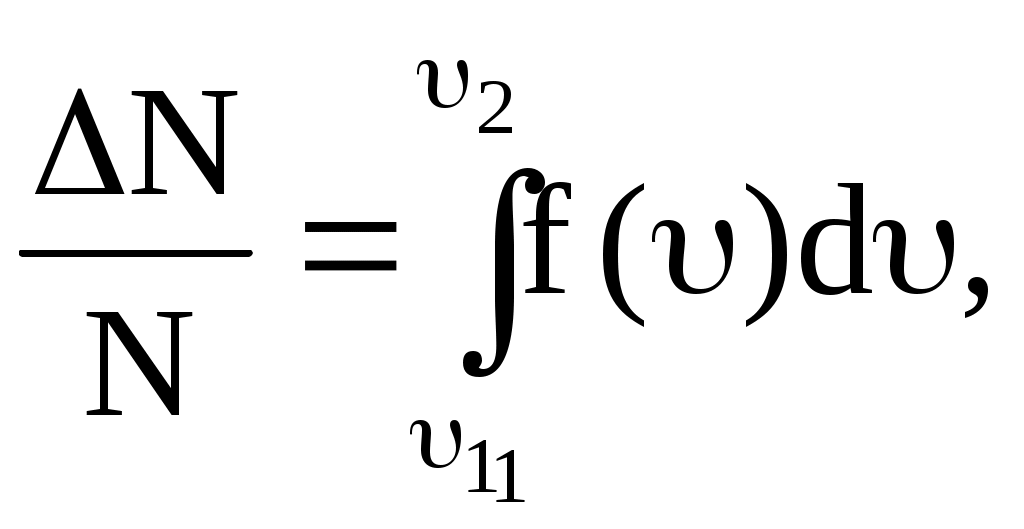 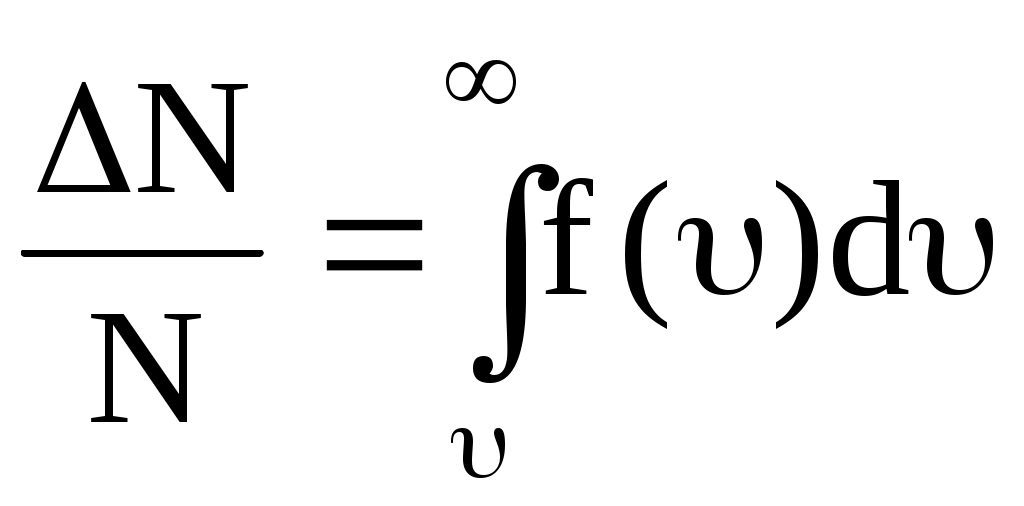 . .
1.4.2. Распределение Больцмана
Тепловое движение частиц тела приводит к тому, что положение их в пространстве изменяется случайным образом. Поэтому можно ввести функцию распределения частиц по координатам, определяющую вероятность обнаружения частицы в том или ином месте пространства.
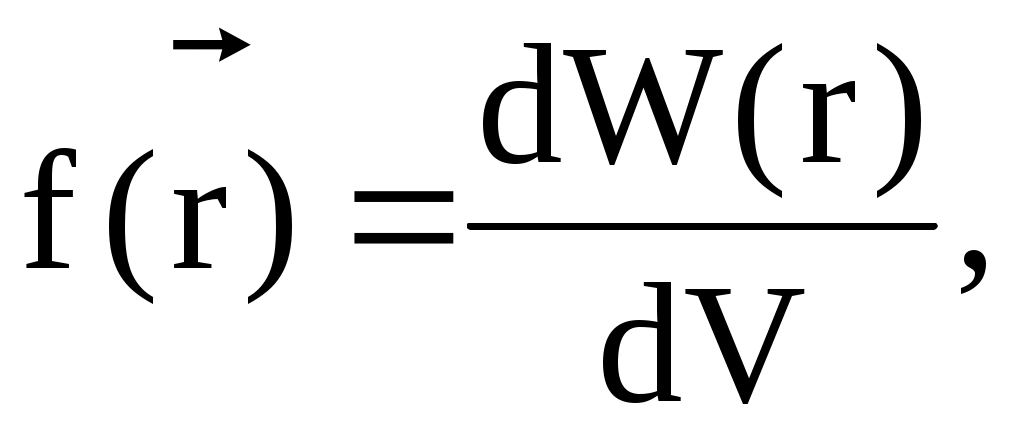
где 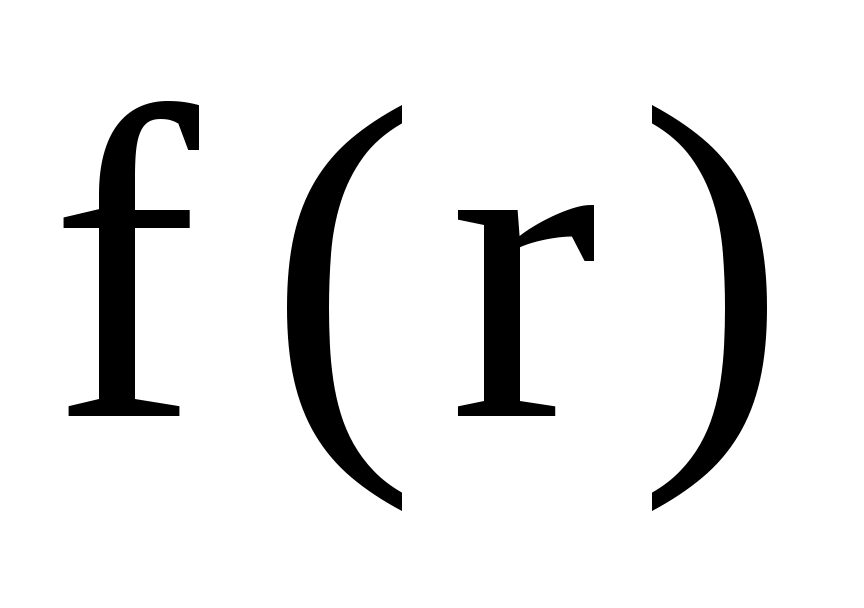 плотность вероятности, т.е. вероятность обнаружения частицы в единичном объеме вблизи точки с радиус-вектором плотность вероятности, т.е. вероятность обнаружения частицы в единичном объеме вблизи точки с радиус-вектором 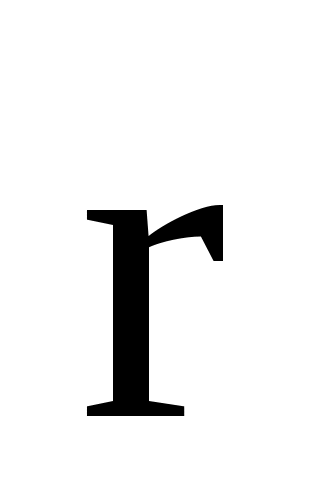 . .
При отсутствии внешних силовых полей существует равномерное распределение частиц идеального газа по координатам, при этом можно записать
 , ,
где n концентрация частиц, N полное число частиц газа.
Внешнее силовое поле изменяет пространственное распределение частиц, при этом концентрация частиц и функция распределения зависят от координат. Если внешнее силовое поле является потенциальным, то концентрация частиц вблизи точки пространства с радиусом-вектором 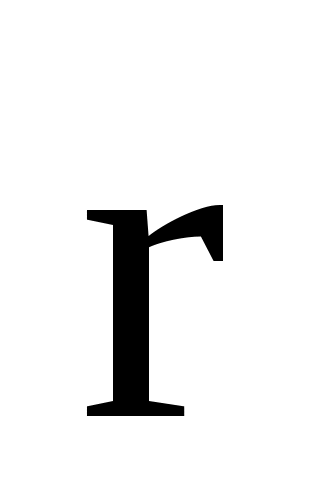 зависит от потенциальной энергии частиц в данном месте: зависит от потенциальной энергии частиц в данном месте:
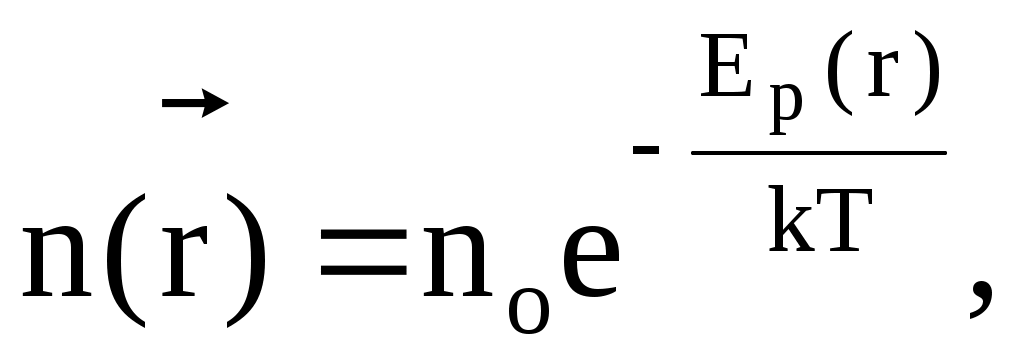
где no концентрация частиц в том месте, где Ep=0.
В этом случае вероятность обнаружить частицу в объеме dV вблизи точки с радиусом-вектором 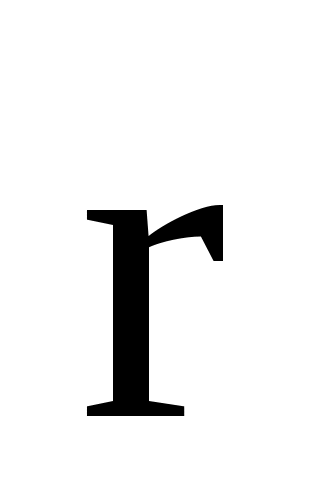 определяется выражением определяется выражением
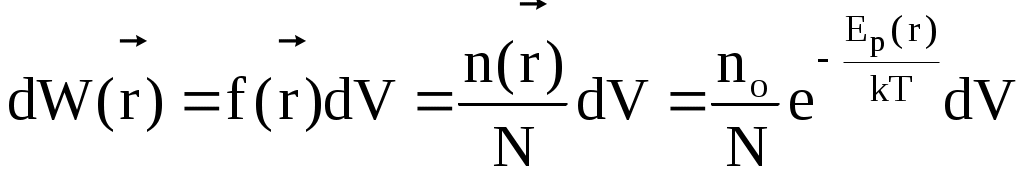 . .
Этот закон называется распределением Больцмана.
Для идеального газа давление связано с концентрацией соотношением Р=nkT. В поле земного тяготения концентрация изменяется с высотой над поверхностью Земли, и если газ находится в равновесном состоянии при температуре Т, то изменение давления с высотой происходит по закону
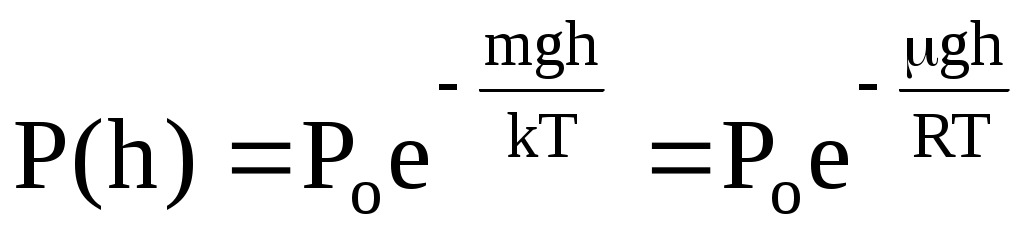 . .
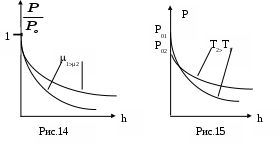
Последнее соотношение называется барометрической формулой. В действительности земная атмосфера не находится в равновесном состоянии, ее температура меняется с высотой, и барометрическую формулу следует применять к участкам атмосферы, в пределах которых изменением температуры можно пренебречь. Из барометрической формулы следует, что давление различных газов изменяется с высотой по-разному. На рис. 14 показано изменение давления газа с высотой для различных газов при T = const, а на рис. 15 – изменение давления газа ( = const) при разных температурах.
1.5. Среднее число столкновений и средняя длина свободного пробега молекул
Молекулы газа, находясь в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Расстояния, которые проходят молекулы между двумя последовательными столкновениями, изменяются случайным образом. Поэтому можно говорить о средней длине свободного пробега молекул <>.
Минимальное расстояние, на которое сближаются центры молекул, называется эффективным диаметром молекулы d. Он зависит от скорости сталкивающихся молекул, т.е. от температуры. За 1 с молекула проходит путь, равный <>, и если среднее число столкновений за единицу времени, то 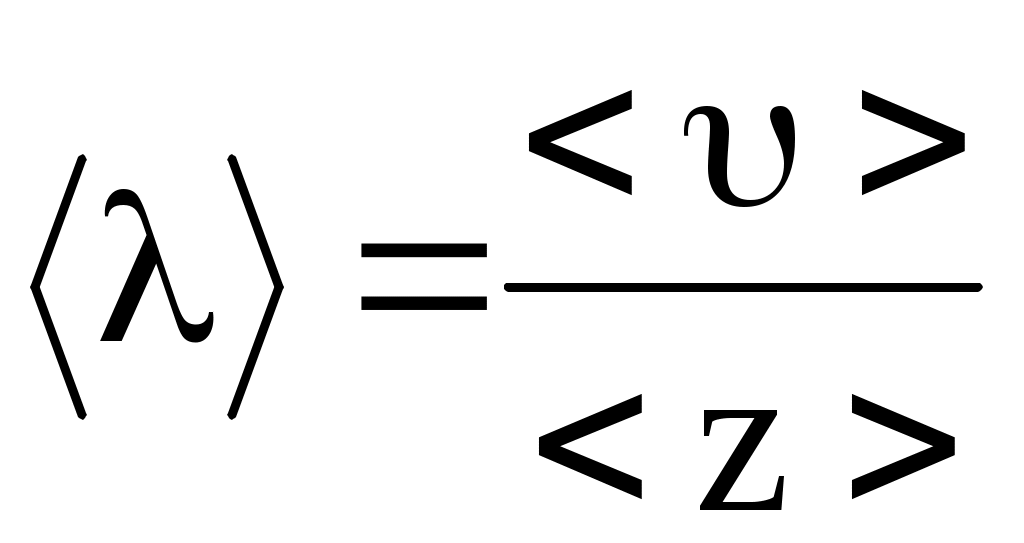 . .
Движущаяся молекула (рис. 16), сталкивается только с теми молекулами, центры которых находятся внутри цилиндра радиусом 2r=d.
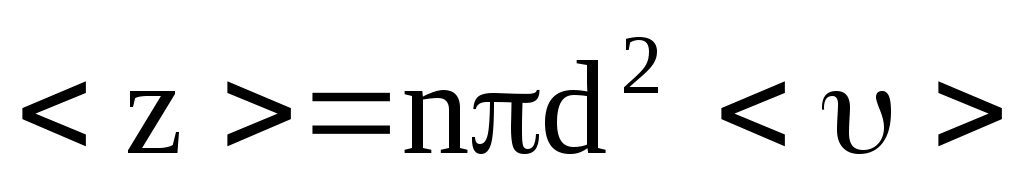 , ,
более точно 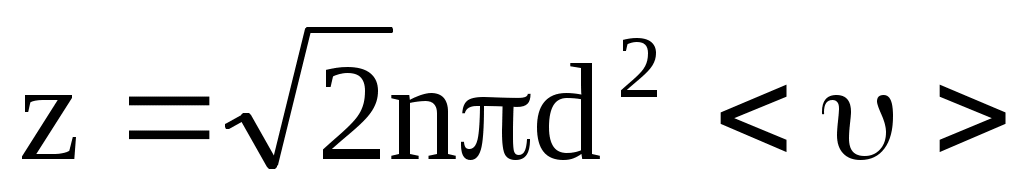 при учете движения других молекул. при учете движения других молекул.
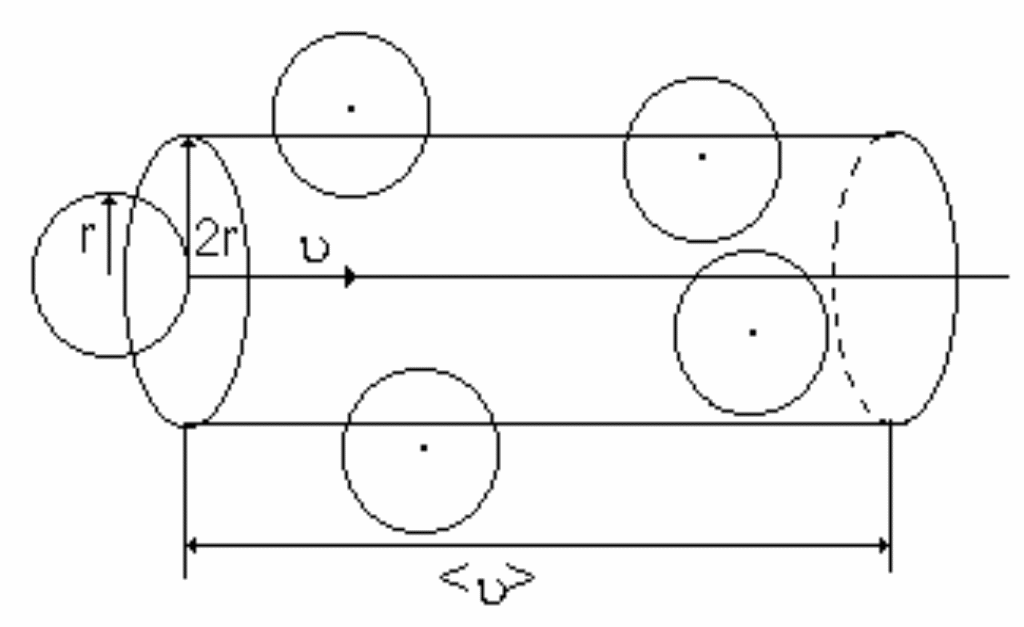 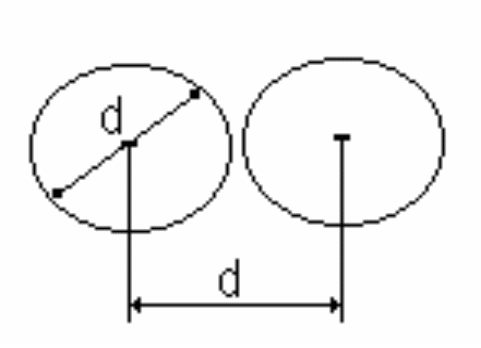
Рис. 16
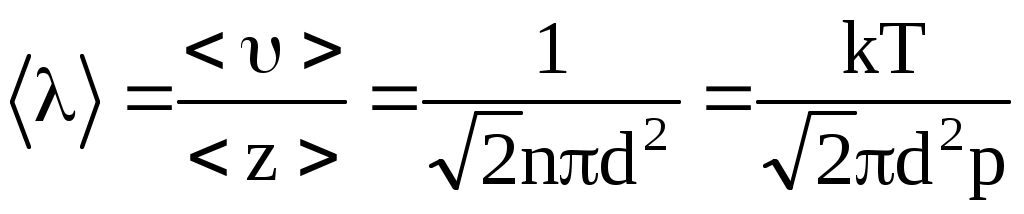 . .
1.6. Явления переноса в газах
В газе, находящемся в неравновесном состоянии, возникают необратимые процессы, называемые явлениями переноса. В ходе этих процессов происходит пространственный перенос вещества (диффузия), энергии (теплопроводность), импульса направленного движения (вязкое трение). Если течение процесса не изменяется со временем, то такой процесс называется стационарным. В противном случае это нестационарный процесс. Стационарные процессы возможны только в стационарных внешних условиях. В термодинамически изолированной системе могут возникать только нестационарные явления переноса, направленные на установление равновесного состояния.
Диффузия, теплопроводность, вязкость являются необратимыми процессами, возникающими самопроизвольно вследствие теплового движения при отклонении вещества (газа) от равновесного состояния. Это отклонение заключается в неоднородном распределении вещества, его температуры, в различии скоростей направленного движения макроскопических частей среды.
Диффузия
Под диффузией обычно понимается взаимопроникновение вещества в различных смесях, сопровождающееся направленным переносом массы вещества из мест с высокой плотностью в места с меньшей плотностью. Перенос массы вещества подчиняется закону Фика: «Плотность потока вещества (масса, переносимая за единицу времени через единичную площадку) прямо пропорциональна градиенту плотности»:
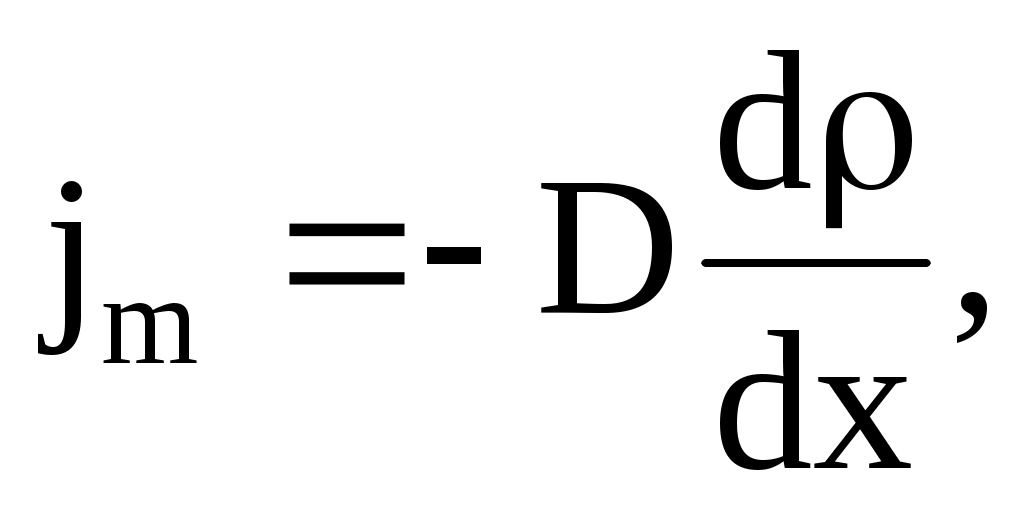
где D – коэффициент диффузии. Знак минус показывает, что перенос массы происходит в направлении убывания плотности.
Масса вещества, перенесенная в результате стационарной диффузии через площадь S за время t:
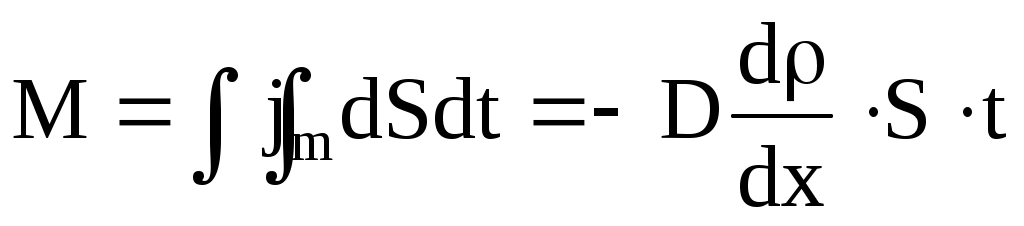 . .
Согласно кинетической теории газов,
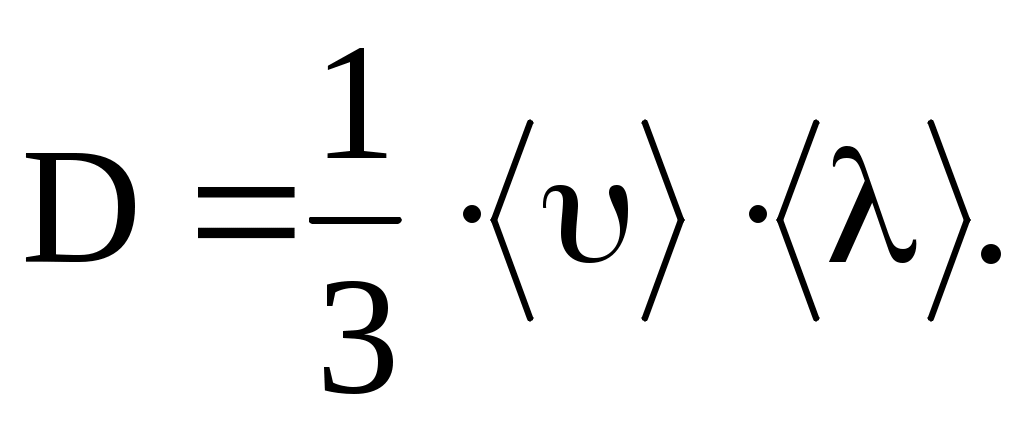
Теплопроводность
Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул температура выравнивается. Процесс передачи энергии в форме тепла подчиняется закону Фурье: «Плотность потока тепла (количество теплоты, переносимое за единицу времени через единичную площадку) прямо пропорционально градиенту температуры»:
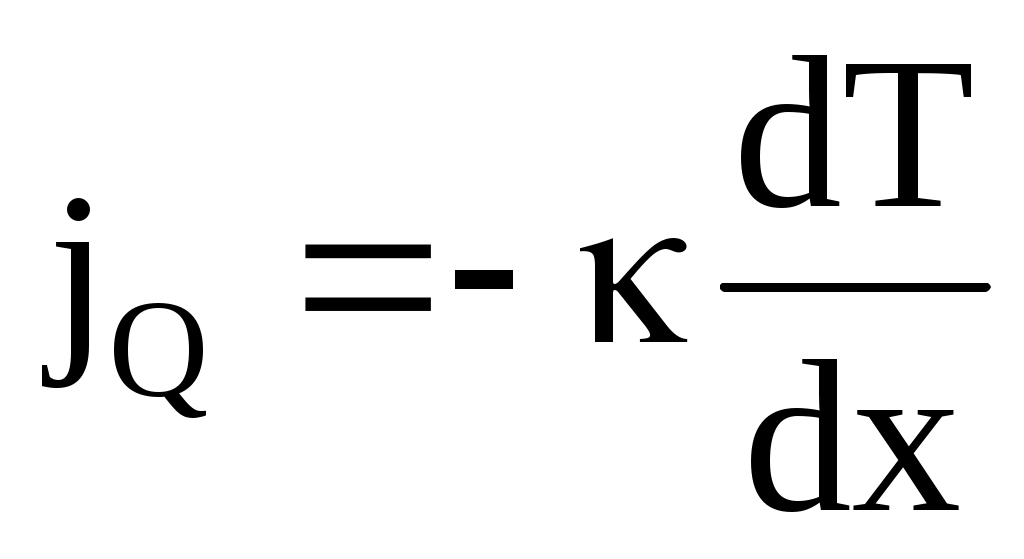 , ,
где коэффициент теплопроводности. Знак минус показывает, что при теплопроводности энергия переносится в сторону убывания температуры. Количество тепла, переносимое в стационарном процессе теплопроводности (стационарное пространственное распределение температуры) через площадь S за время t:
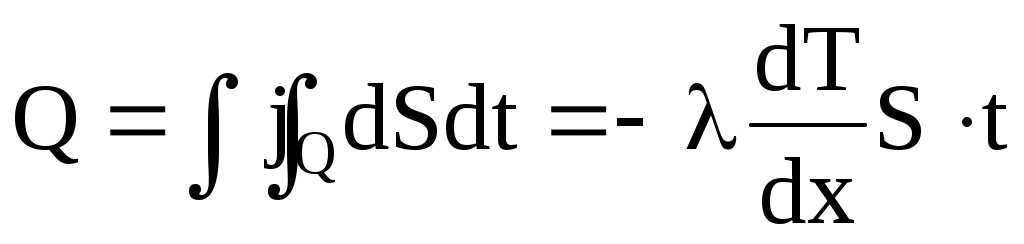 . .
Для идеального газа  , где cv – удельная теплоемкость газа при постоянном объеме, плотность газа. , где cv – удельная теплоемкость газа при постоянном объеме, плотность газа.
Вязкость
Вязкое трение в газе или жидкости это результат переноса импульса направленного движения. Механизм возникновения внутреннего трения между слоями газа (жидкости), движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, движущегося медленнее увеличивается, что приводит к появлению сил вязкого трения. Внутреннее трение подчиняется закону Ньютона: «Плотность потока импульса направленного движения (равная силе вязкого трения, действующей на единичную площадку, перпендикулярную направлению переноса) пропорциональна градиенту скорости направленного движения»:
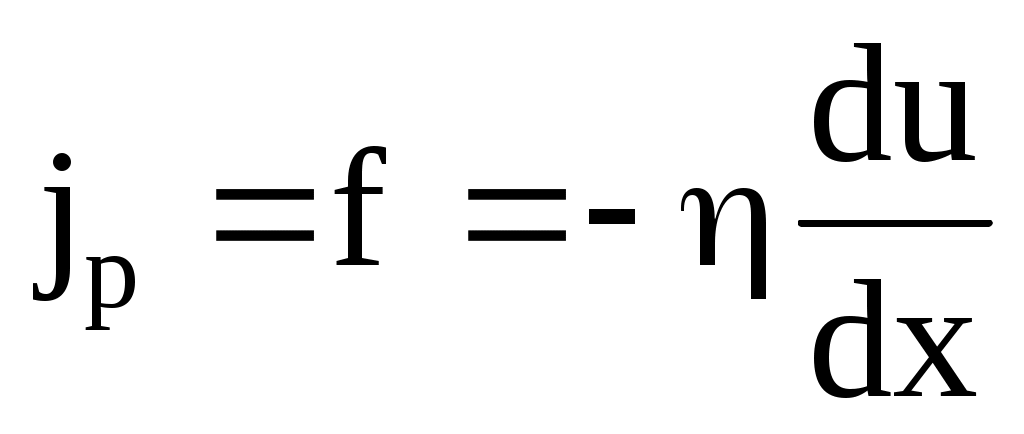 , ,
где динамическая вязкость (коэффициент вязкости), 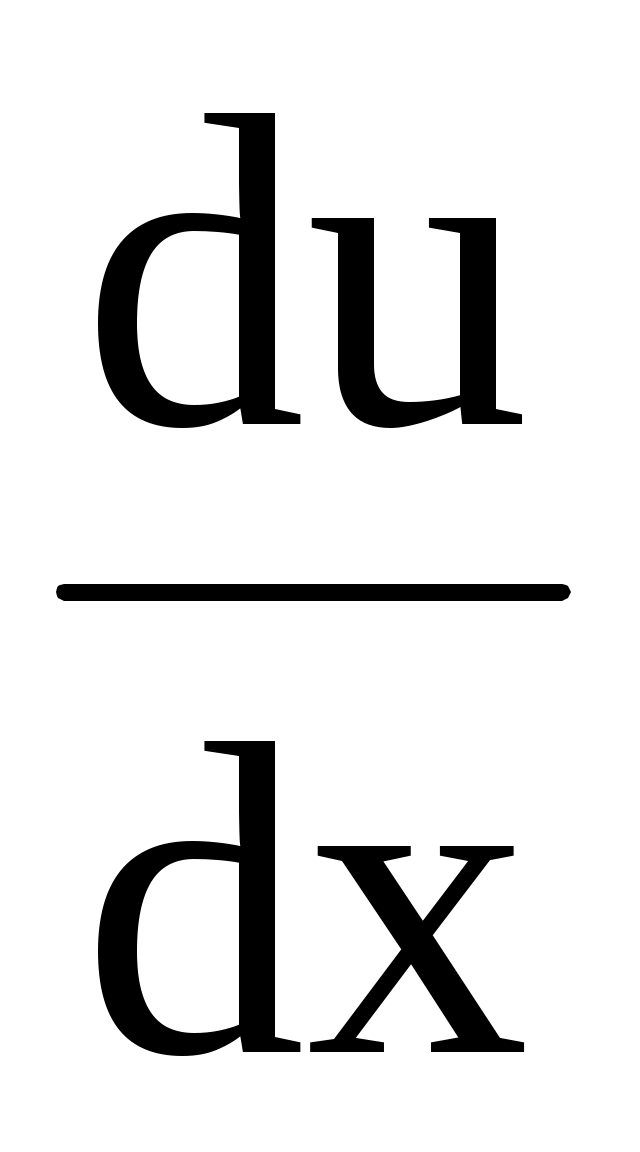 градиент скорости направленного движения. Знак минус указывает, что сила трения направлена против скорости u. Коэффициент вязкости для идеального газа градиент скорости направленного движения. Знак минус указывает, что сила трения направлена против скорости u. Коэффициент вязкости для идеального газа
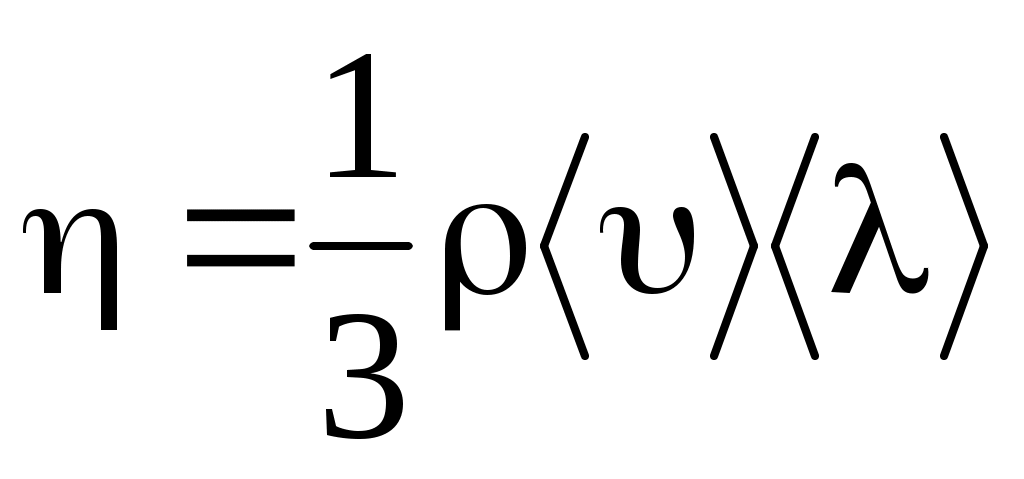 . .
Сила F, действующая на площадь S, пропорциональна этой площади и градиенту скорости 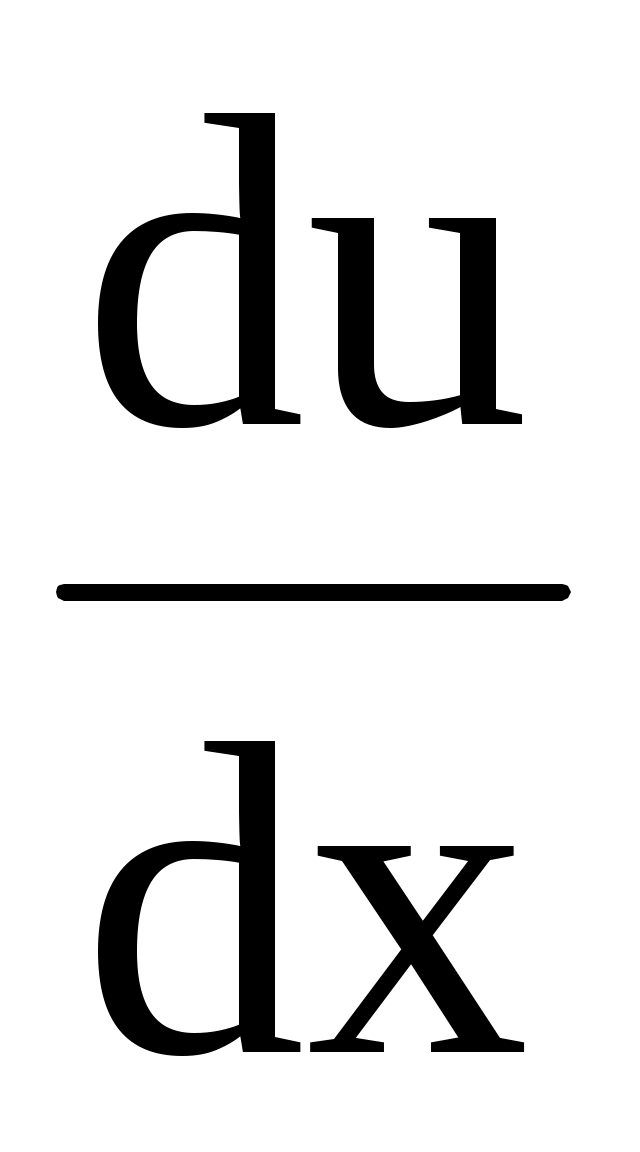 : :
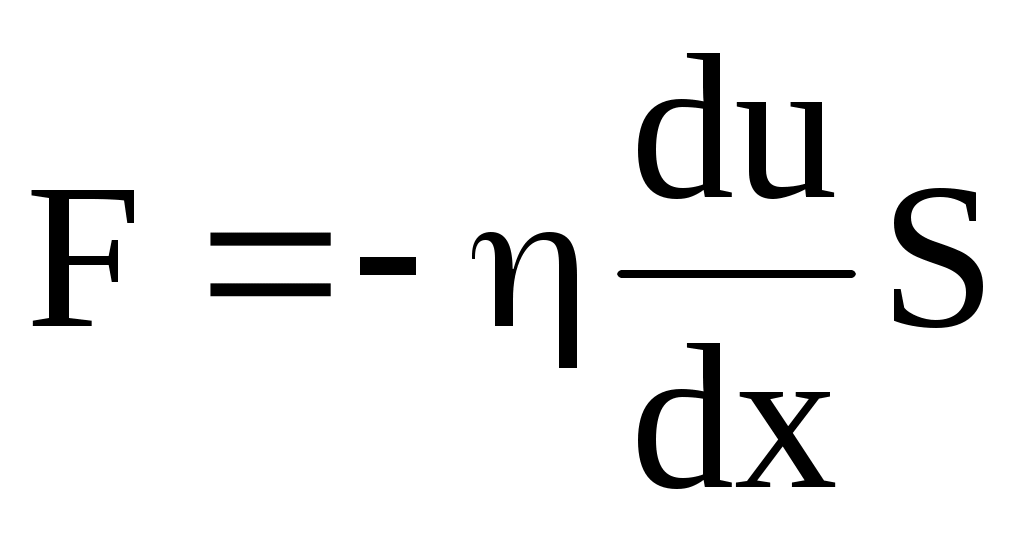 . .
Коэффициенты переноса связаны между собой простыми соотношениями
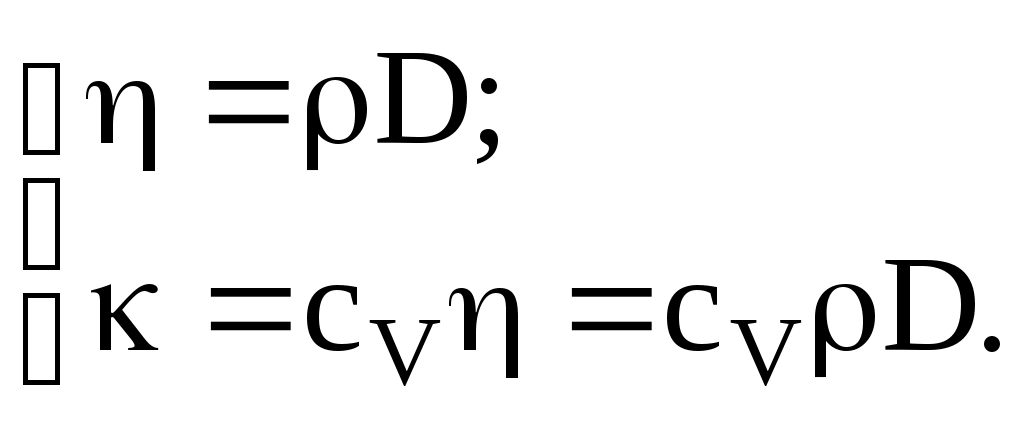
|
|
|
 Скачать 3.78 Mb.
Скачать 3.78 Mb. торой постулат Эйнштейна: скорость света в вакууме одинакова во всех инерциальных системах отсчета и не зависит от движения источников и приемников света.
торой постулат Эйнштейна: скорость света в вакууме одинакова во всех инерциальных системах отсчета и не зависит от движения источников и приемников света.
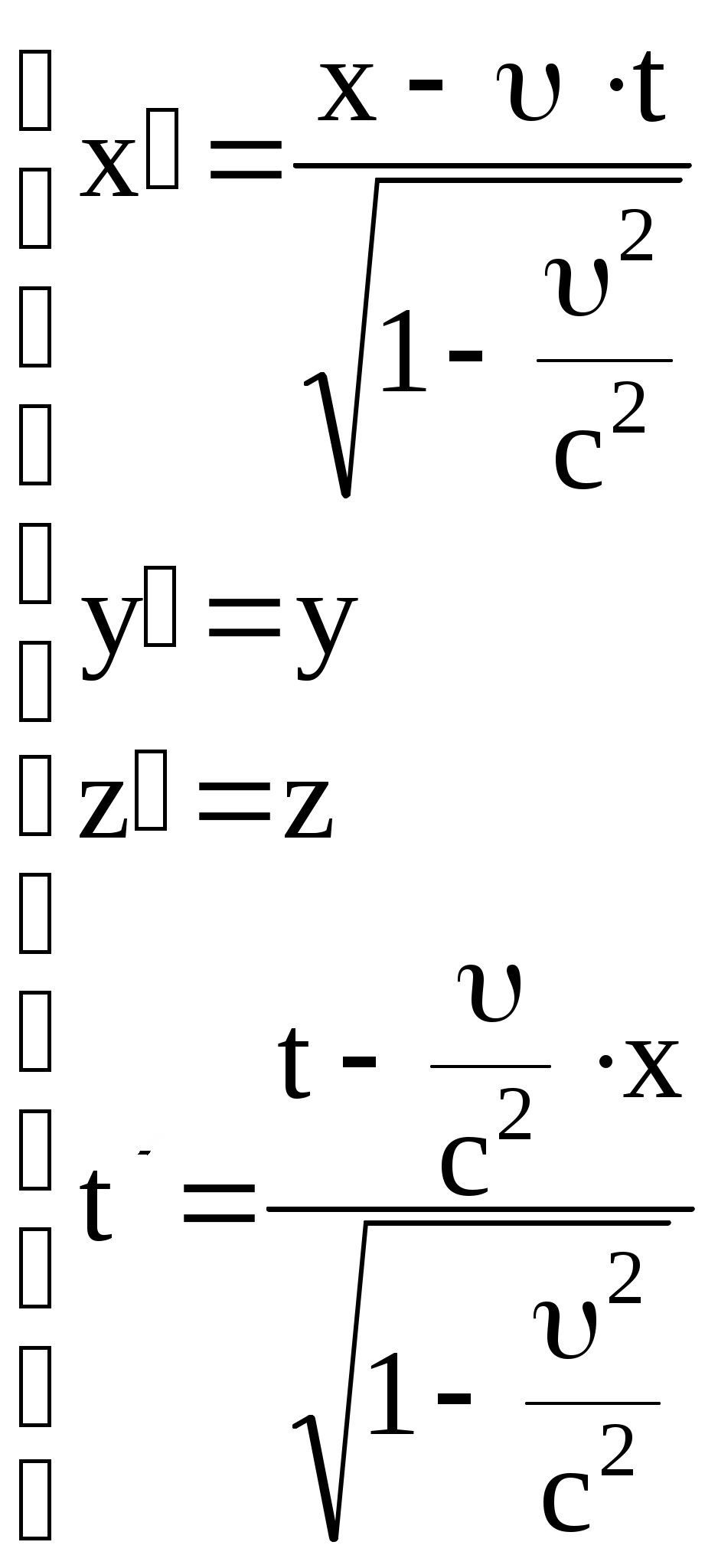
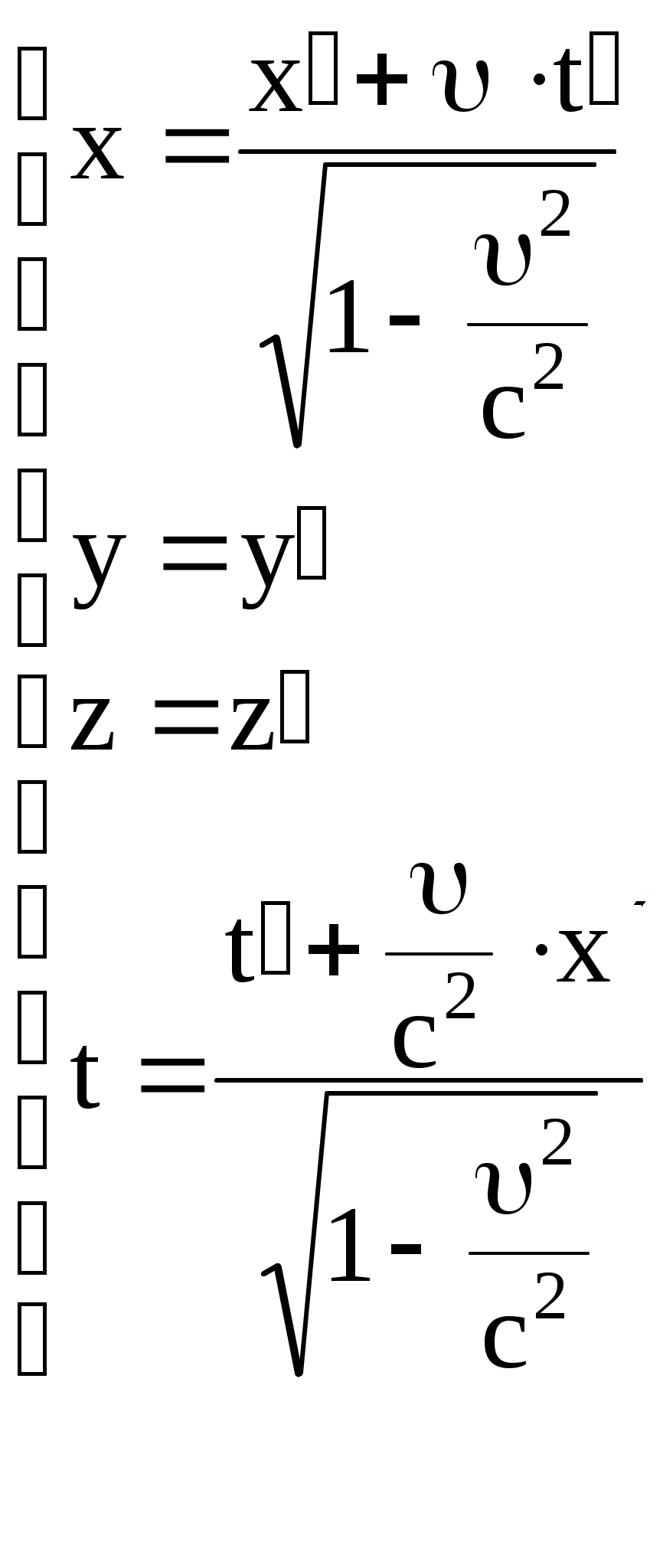
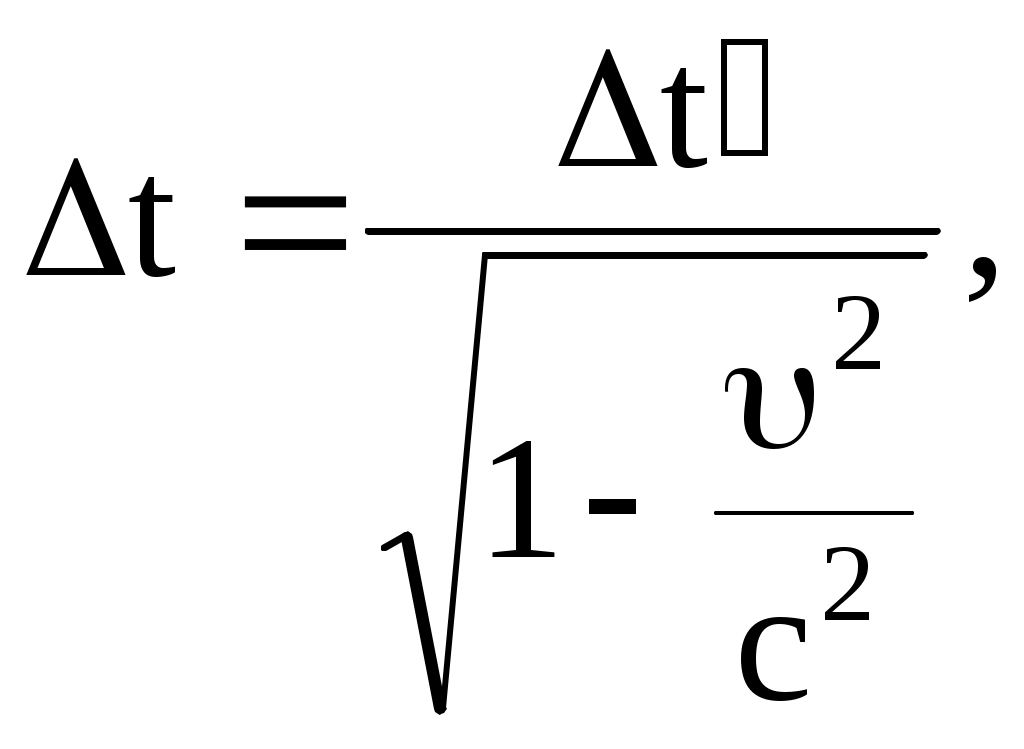
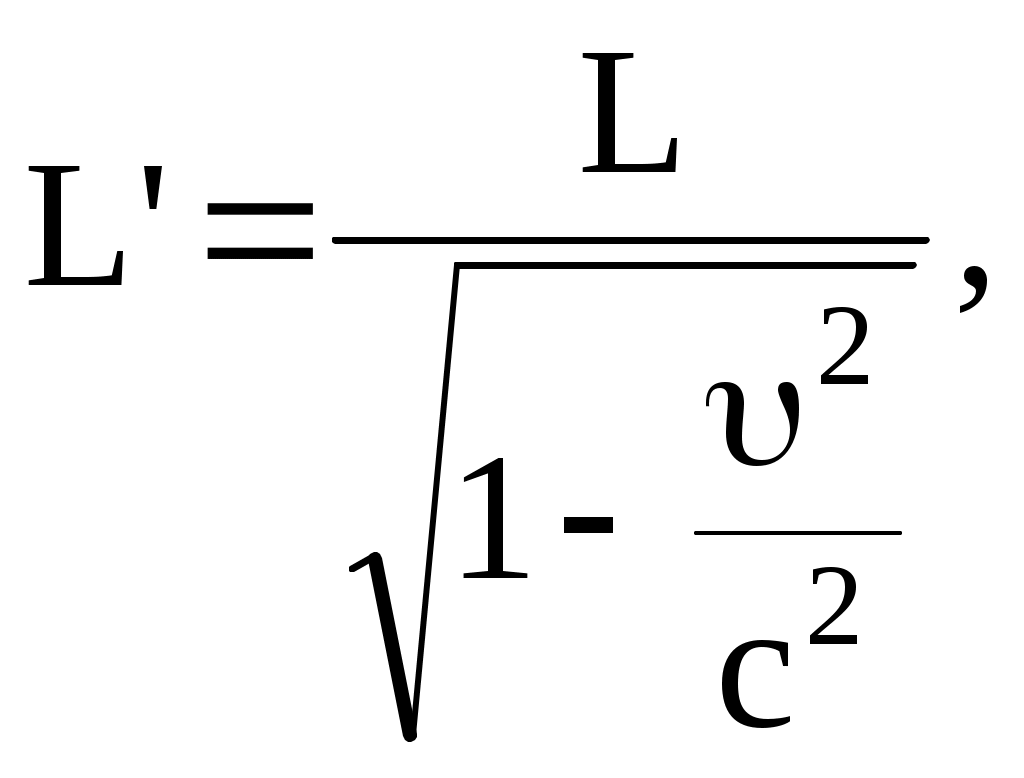
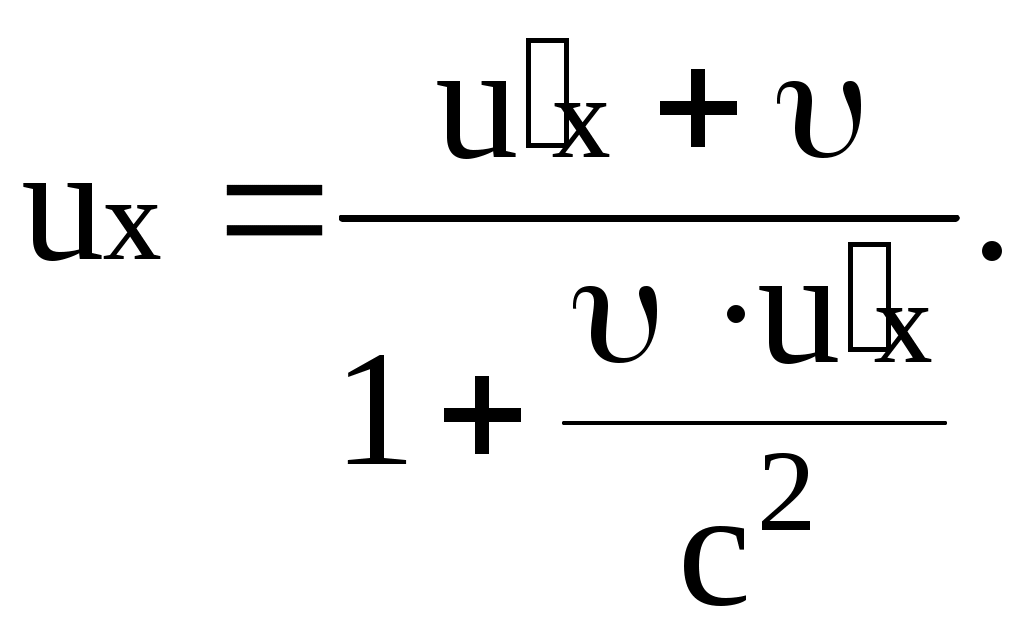
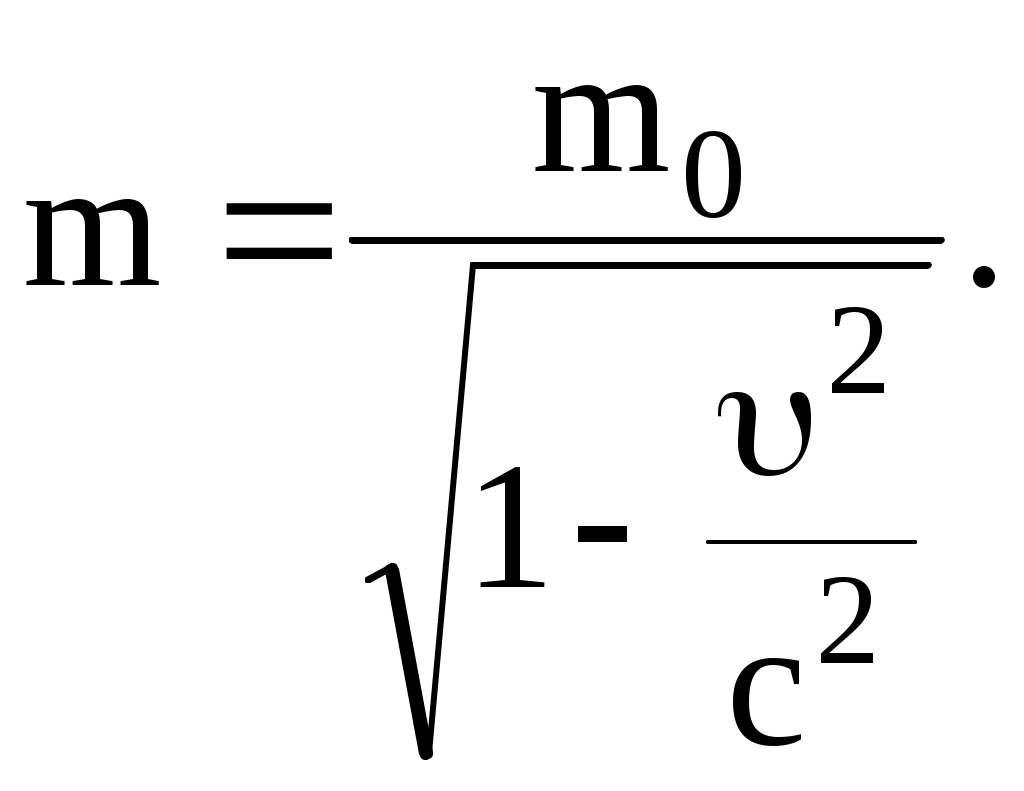

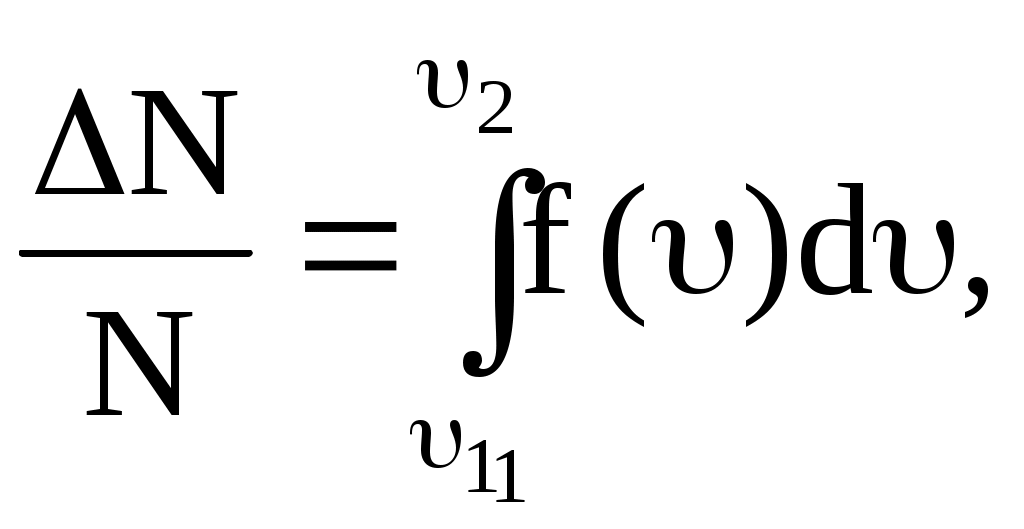

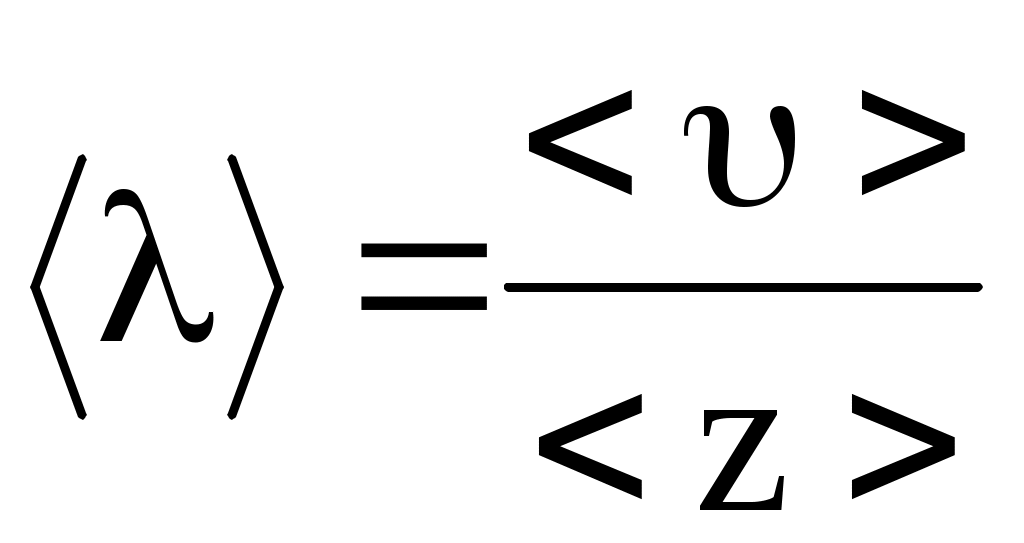 .
.

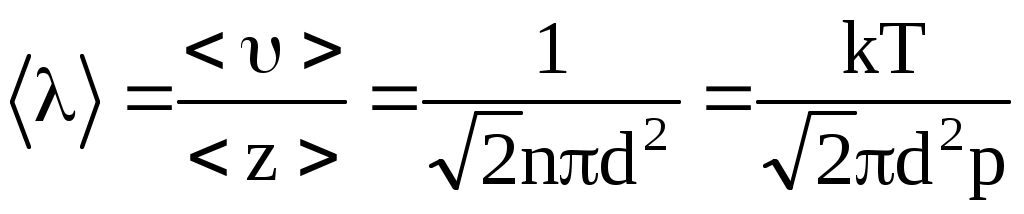 .
.