Тема 3. Химические реакции
Лекция 5
Вопросы
5.1 Понятие химической реакции. Признаки классификации химических реакций
5.2 Классификация химических реакций в зависимости от механизма
реакции
5.3 Классификация химических реакций по признаку изменения числа
исходных и конечных веществ
5.4 Классификация химических реакций по признаку изменения степеней окисления элементов
5.5 Классификация химических реакций по признаку выделения или
поглощения энергии
5.6 Классификация химических реакций по признаку обратимости
5.1 Понятие химической реакции. Признаки классификации
химических реакций
Каждое индивидуальное химическое вещество характеризуется составом и строением.
Различают качественный состав вещества (элементы, входящие в состав вещества) и количественный состав (в каких соотношениях находятся эти элементы).
Строение вещества отражает последовательность химических связей между образующими его атомами, характер этих связей и расположение атомов в пространстве относительно друг друга.
Физические свойства вещества – это его агрегатное состояние, цвет, вкус, запах, ряд констант (плотность, температуры плавления и кипения и т.д.).
Химические свойства вещества – это его способность вступать во взаимодействие с другими веществами или претерпевать те или иные изменения, в результате чего образуются новые вещества, с иным составом, строением и свойствами.
Изменения, происходящие с веществами, могут быть физическими явлениями, при которых не происходит изменения состава и строения вещества (образование смеси веществ).
Явления, при которых из одних веществ образуются другие, отличающиеся от исходных составом и строением, называются химическими явлениями или химическими реакциями.
О происходящих химических реакциях свидетельствуют изменение цвета, выделение или поглощение энергии, выделение газа или выпадение осадка.
Химическую реакцию изображают в виде уравнения реакции. В левой части уравнения пишут формулы веществ, претерпевающих химические превращения и расходующихся в ходе реакции. Они называются исходными веществами или реагентами. В правой части уравнения пишут формулы веществ, образующихся в ходе реакции. Они называются конечными веществами или продуктами реакции.
Химические реакции классифицируют по следующим признакам:
механизм реакции;
изменение числа исходных и конечных веществ;
изменение степеней окисления элементов;
выделение или поглощение энергии;
обратимость.
Одна и та же реакция в зависимости от признака классификации может относиться к разным типам реакций.
Рассмотрим некоторые из признаков классификации.
Классификация химических реакций в зависимости от механизма реакции
В зависимости от механизма реакции могут быть отнесены к простым и сложным.
Простые реакции – это реакции, включающие один химический этап. Это крайне редкий случай. В природе, как правило, химический процесс – это сложная реакция, включающая множество промежуточных стадий.
Сложные реакции – это реакции, включающие более одного химического этапа. Сложные реакции подразделяют на параллельные, последовательные, сопряженные.
Если исходное вещество одновременно участвует в нескольких реакциях, приводящих к образованию различных продуктов, то такие реакции называются параллельными.
Параллельные реакции протекают согласно схемам:
А → В → С
А + В + ….. → С + Д + ….
Так, реакция разложения бертолетовой соли (хлорат калия) при умеренно высоких температурах идет одновременно в двух направлениях, хотя условия преимущественного прохождения реакции в том или в другом направлении могут быть разные:
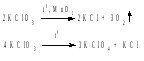
Общая скорость системы параллельных реакций (т.е. скорость превращения исходного вещества) равна сумме скоростей отдельных реакций. В случае же, когда скорости параллельных реакций сильно различаются между собой, суммарная скорость определяется в первую очередь скоростью наиболее быстрой из них.
Последовательными реакциями называются реакции, при которых продукт начальной реакции является исходным веществом для следующей реакции.
Последовательные реакции протекают согласно схемам:
А → В → С
или
А + В + … → С + Д + … → E + F + …
Таковы, например, реакции омыления эфиров двухосновных кислот щелочью. В последовательных реакциях скорость процесса в целом определяется скоростью самой медленной стадии.
Сопряженные реакции – это реакции, одна из которых идет самопроизвольно, а другая имеет место только в присутствии первой. В таком случае говорят, что одна реакция индуцирует протекание другой, т.е. имеет место химическая индукция. Идущая самопроизвольно первая реакция называется первичной, индуцируемая реакция – вторичной.
Сопряженные реакции протекают по схеме:
А + В → Д
А + С → Е
Чаще всего это цепные реакции, протекающие по свободно-радикальному механизму. При цепном процессе имеет место цепочка реакций, в каждой из которых образуется молекула продукта и одновременно – свободный радикал, т.е. свободный атом, имеющий неспаренный электрон. Свободные радикалы химически активны, и время их жизни в химической системе невелико – они быстро реагируют либо с молекулами, либо с другими свободными радикалами. Когда свободный радикал реагирует с другой молекулой исходного вещества, образуется еще одна молекула продукта и новый радикал и т. д. Длина такой цепи может быть очень большой (десятки тысяч элементарных актов взаимодействия). Одновременный обрыв двух цепей происходит тогда, когда два свободных радикала сталкиваются друг с другом и реагируют с образованием молекулы (реакция рекомбинации).
Так, примером сопряженных реакций является реакция между хлором и водородом. При температуре 150–250 °С в темноте реакция практически не идет. Однако она протекает с высокой скоростью в тех же условиях в присутствии паров натрия:
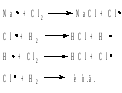
Для рассмотренной выше цепной реакции между водородом и хлором имеют место следующие элементарные акты обрыва кинетической цепи:
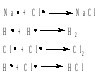
Для того чтобы свободные атомы соединились в молекулу, необходимо присутствие третьей частицы или твердой поверхности, в противном случае образовавшаяся молекула обладала бы запасом энергии, равным тому, который необходим для ее распада; не отдав эту энергию третьей частице или твердой поверхности, она снова распалась бы. Поэтому для цепных реакций характерно влияние на скорость реакции размеров, материала и формы сосуда, в котором протекает реакция.
Классификация химических реакций по признаку изменения числа исходных и конечных веществ
По признаку изменения числа исходных и конечных веществ реакции можно выделить следующие типы:
1) реакции соединения, при которых из двух или нескольких веществ получают одно вещество:

или в общем виде А + В+. . . = С;
2) реакции разложения, при которых из одного вещества образуется несколько веществ:

или в общем виде С = А + В + . . . ;
3) реакции замещения, при которых простое вещество замещает составную часть сложного вещества и в результате образуются новое простое и новое сложное вещества:

или в общем виде АВ + С = АС + В;
4) реакции обмена, при которых молекулы сложных веществ обмениваются своими составными частями:
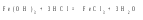
или в общем виде AB + CD = AD + CB,
Классификация химических реакций по признаку изменения
степеней окисления элементов
По признаку изменения степеней окисления элементов, которые входят в состав реагирующих веществ, выделяют реакции, идущие без изменения степеней окисления элементов, и на окислительно-восстановительные (идущие с изменением степеней, окисления элементов).
Очень важным является понятие степень окисления атома.
Cтепень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что данный атом связан с другими ионной связью.
Без изменения степеней окисления протекают реакции обмена и некоторые реакции соединения и разложения. Например:
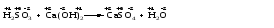

В этих случаях степень окисления каждого из атомов до и после реакции остается без изменения.
С изменением степеней окисления протекают реакции замещения, а также некоторые реакции соединения и разложения. Например:
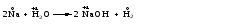

Классификация химических реакций по признаку выделения или поглощения энергии
По признаку выделения или поглощения энергии реакции делят на экзотермические и эндотермические.
В ходе всех химических реакций происходит выделение или поглощение энергии, т.е. имеет место обмен энергией между системой и внешней средой. Обмен энергией может происходить в разных формах: чаще всего в виде теплоты, а также в виде светового излучения, акустических волн и т.д. Так как существует эквивалентность между разными видами энергии, то количество энергии, которой химическая система обменивается с внешней средой, можно свести к количеству теплоты.
Реакции, протекающие с выделением теплоты, называют экзотермическими, с поглощением теплоты – эндотермическими. Количество выделенной или поглощенной теплоты при данных количествах реагирующих веществ называют тепловым эффектом реакции.
Тепловой эффект реакций определяется разностью энергий связи, которые образуются и разрываются.
Химические уравнения, в которых указан тепловой эффект реакций, называются термохимическими уравнениями. В термохимических уравнениях химических реакций тепловой эффект указывают при помощи величины ∆Н, которая называется изменением энтальпии (теплосодержания) реакции.
Если реакция протекает при стандартных условиях (температуре 289,15 К или 25 °С, давлении 101 325 Па, концентрации всех веществ в растворе или в газе 1 моль в литре), то изменение энтальпии обозначают символом ∆Н0.
Если ∆Н0<0, то теплота выделяется, т.е. реакция – экзотермическая. Для эндотермических реакций ∆Н0>0.
Существуют две формы записи термохимических уравнений.
1) При термохимической форме записи тепловой эффект записывается в самом уравнении, обычно в его правой части; при этом тепловой эффект экзотермической реакции входит в уравнение со знаком «+», а эндотермической – со знаком «–».Например:
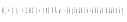

2) При термодинамической форме записи уравнения реакции ∆ Н0записывают отдельно. Например:
Н2 + Сl2 = 2 HCl ∆Н0 = –185 кДж
N2 + O2 = 2 NO ∆Н0 = +181 кДж
Знание теплового эффекта реакции имеет большое практическое значение. Многие химические реакции используются как источники энергии. Например, горение топлива – химический процесс, идущий с выделением энергии. Выделение или поглощение энергии при химических реакциях нельзя не учитывать при расчете теплового баланса технологических процессов и при конструировании аппаратов, в которых такие процессы проводятся. Процессы окисления жиров и углеводов служат источником энергии, обеспечивающей существование животного мира.
Наконец, термохимические данные в сочетании с данными, полученными другими методами, могут дать ценную информацию о составе и строении веществ. Тепловой эффект реакции образования какого-либо соединения – это не только важная характеристика данного соединения, но и величина, позволяющая оценить его устойчивость.
Вещества, образующиеся из простых веществ в результате экзотермической реакции, называются экзотермичными; процесс их разложения, наоборот, эндотермический. Так, экзотермичным веществом является вода. Вещества, образующиеся из простых веществ в результате эндотермических процессов, называются эндотермичными; процесс их разложения – экзотермический.
Все эндотермичные соединения неустойчивы и легко разлагаются. И наоборот, чем более экзотермичным является соединение, тем труднее его разложить.
Устойчивость экзотермичных соединений и неустойчивость эндотермичных – это проявление общей закономерности, которая получила название принципа Бертло-Томсена, согласю которому химические процессы идут преимущественно в экзотермическом направлении.
Так, ацетилен С2Н2, являясь эндотермичным соединением, при определенных условиях может разлагаться со взрывом, поэтому его хранят и транспортируют в газовых баллонах не в чистом виде, а растворенным в ацетоне, так как разбавление легко взрывающегося вещества другим, инертным по отношению к нему веществом, предотвращает возможность взрыва.
Классификация химических реакций по признаку обратимости
По признаку обратимости реакции подразделяются на две группы:
необратимые и обратимые.
Необратимые реакции могут идти только в одном направлении и протекают до полного завершения.
Эта означает, что реакция продолжается до тех пор, пока один из реагентов не израсходуется полностью. Необратимых реакций, вообще говоря, не бывает. Просто в определенных условиях некоторые реакции можно довести практически до конца, например, если удалять продукты из сферы реакции – выпадение осадка, выделение газа, образование малодиссоциированных продуктов и т.д.
К необратимым реакциям относятся реакции, при протекании которых:
а) образующиеся продукты уходят из сферы реакции – выпадают в виде осадка или выделяются в виде газа:
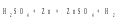
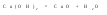
б) образуется малодиссоциирующее соединение, например, вода:
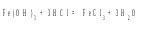
Обратимыми называются реакции, протекающие в двух противоположных направлениях: прямом и обратном.
Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью, так как реакция может протекать как в прямом направлении, так и в обратном.
Тема 4. Основные положения химической кинетики
Лекция 6
Вопросы
6.1 Понятие скорости химической реакции
6.2 Факторы, влияющие на скорость химической реакции
6.3 Химическое равновесие
6.4 Смещение химического равновесия. Принцип Ле-Шателье
Понятие скорости химической реакции
Сущность химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакций. При этом общее число атомов каждого элемента до и после реакции остается постоянным.
Учение о скоростях и механизмах химических реакций называется химической кинетикой.
Под скоростью химической реакции понимают изменение концентрации одного из реагирующих веществ в единицу времени. При этом безразлично, о каком из участвующих в реакции веществе идет речь: все они связаны между собой уравнением реакции.
Обычно концентрацию выражают в [моль/л], а время – в секундах [с], поэтому размерность скорости реакции равна [моль/л·с].
Рассмотрим реакцию взаимодействия водорода с парами йода:
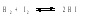
Обозначим концентрацию паров йода в начале некоторого отрезка времени t1 через C1, а при t2 через C2. Так как йод в процессе реакции расходуется, то C1>C2. Скорость реакции может быть найдена из равенства
 (1) (1)
По мере расходования исходных веществ скорость реакции уменьшается (рис. 6.1). Поэтому говорят о скорости реакции в данный момент времени (истинная скорость), которая выражается производной от концентрации во времени:
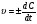 (2) (2)
Производная берется со знаком минус, если C ‒ концентрация исходного вещества (Cубывает), и со знаком плюс, если C‒концентрация продукта реакции (C возрастает).
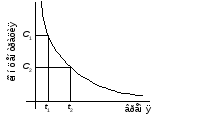
Рисунок 6.1 – Изменение концентрации реагирующего вещества
во времени
Факторы, влияющие на скорость химической реакции
Скорость реакции зависит от природы реагирующих веществ, их концентрации и внешних условий (температуры, давления, присутствия катализатора).
6.2.1 Зависимость скорости реакции от природы реагирующих веществ
В зависимости от природы реагирующих веществ реакции могут протекать как очень медленно (некоторые реакции между органическими веществами, многие реакции с участием твердых веществ, как, например, коррозия металлов), так и очень быстро (ионные реакции в растворах). В промежуточном случае скорость реакции может быть такой, что ее нетрудно измерять в ходе короткого опыта.
Зависимость скорости реакции от природы веществ очень сложна, она связана с их составом и строением. Химический процесс всегда представляет собой некоторую перегруппировку атомов, т. е. их обмен местами, разъединение или, наоборот, объединение отдельных атомов или молекул в более сложные. Совершенно естественно, что подобные процессы могут развертываться лишь при достаточно тесном сближении молекул реагентов. А на этот процесс в значительной степени влияет состав и строение реагирующих веществ.
6.2.2 Зависимость скорости реакции от концентрации реагирующих веществ
Необходимым условием того, чтобы между частицами исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом. Только при этом станут возможны те переходы электронов и перегруппировки атомов, в результате которых образуются молекулы новых веществ – продуктов реакции. Поэтому скорость реакции пропорциональна числу соударений, которые претерпевают молекулы реагирующих веществ.
Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ или, что то же самое, чем больше произведение концентрации реагирующих веществ.
Чтобы исследовать зависимость скорости реакции от концентрации реагирующих веществ, рассмотрим гомогенную реакцию (реагирующие вещества находятся в одном агрегатном состоянии), протекающую по уравнению
А + В → АВ
Для ее осуществления необходимо, чтобы молекулы А и В в некоторый момент времени оказались в каком-то элементе объема, имеющем «молекулярные размеры», т.е. столкнулись. Вероятность того, что молекула А окажется в этом элементе объема (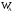 ), пропорциональна количеству молекул А в единице объема, т.е. их концентрации: ), пропорциональна количеству молекул А в единице объема, т.е. их концентрации:
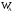 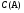 (3) (3)
Подобным же образом вероятность того, что молекула В окажется в том же элементе объема, пропорциональна концентрации молекул В:
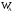
 (4) (4)
Вероятность одновременного осуществления двух независимых событий равна произведению вероятностей каждого из событий. Следовательно, вероятность того, что и молекула А, и молекула В окажутся в одном и том же элементе объема:
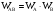
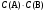 (5) (5)
Соответственно и скорость реакции будет пропорциональна произведению концентраций веществ А и В, т.е.
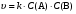 , (6) , (6)
где k–коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости реакции постоянная для данной химической реакции величина, которая зависит от химической природы реагирующих веществ, температуры и катализатора, но не зависит от концентраций реагирующих веществ. Она равна той скорости, с которой должна совершаться реакция, если концентрация каждого из реагирующих веществ равна 1 моль/л.
Если химический процесс осуществляется в ходе одновременного столкновения двух частиц А и одной частицы В, то легко показать с помощью рассуждений, аналогичных приведенным выше, что
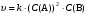 (7) (7)
Уравнение, описывающее зависимость скорости реакции от концентрации реагирующих веществ, называется кинетическим уравнением реакции. Для гомогенной реакции с участием а молекул вещества А и bмолекул вещества В:
аА + bВ → cАВ оно имеет вид
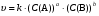 (8) (8)
Таким образом, скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях с показателями, численно равными коэффициентам в уравнении реакции.
Сумма показателей степени в кинетическом уравнении реакции называется порядком реакции (п). Различают суммарный порядок реакции (т. е. сумма показателей степени в кинетическом уравнении) и частные порядки по какому-либо из реагентов, т. е. показатели степени при концентрации данного вещества в кинетическом уравнении.
Если сумма показателей степени в кинетическом уравнении составляет единицу, то реакцию называют реакцией первого порядка, если она равна двум ‒ реакцией второго порядка и т.д. Порядок реакции может быть нулевым и дробным.
Если реакция имеет нулевой порядок, то скорость реакции не зависит от концентрации реагента:
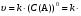 (9) (9)
Для гетерогенных реакций (реагирующие вещества находятся в разных агрегатных состояниях, например, т–ж, т–г), протекающих на границе раздела фаз, концентрация твердого вещества, реагирующего с газом или раствором, остается постоянной, поэтому в кинетическое уравнение концентрация твердых веществ не включается. Так, для реакции
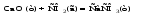
кинетическое уравнение имеет вид
 (10) (10)
6.2.3 Зависимость скорости реакции от температуры
При повышении температуры скорость реакций, как правило, резко возрастает. Например, при комнатной температуре скорость взаимодействия водорода с кислородом практически нулевая, при температуре 400 °С она делается заметной, хотя и остается небольшой, а при температуре 600 °С реакция протекает со взрывом.
Число, показывающее, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °С, называется температурным коэффициентом скорости (γ) этой реакции.
Для большинства реакций γ равно 2-3 (правило Вант-Гоффа).
Зная величину γ, а также скорость реакции при одной температуре Т1, можно вычислить ее скорость при другой температуре Т2, воспользовавшись уравнением:
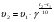 (11) (11)
При расчетах по этому уравнению нетрудно заметить, что при повышении температуры скорость реакции возрастает очень резко. Так, если γ = 2, то повышение температуры, например, от 0 °С до 100 °С приводит к повышению скорости реакции в 2100/10=210=103 раз.
Объяснить столь резкое увеличение скорости реакции одним только увеличением числа соударений между частицами реагентов за счет возрастания скорости их движения (вычисляемой на основании кинетической теории газов) нельзя.
Если с помощью молекулярно-кинетической теории газов и жидкостей подсчитать число соударений между молекулами тех или иных веществ при определенных условиях, то окажется, что число соударений столь велико, что все реакции должны протекать мгновенно. Однако в действительности далеко не все реакции заканчиваются быстро. Это противоречие можно объяснить, если предположить, что не всякое столкновение молекул реагирующих веществ приводит к образованию продуктов реакции. Для того чтобы это произошло, необходимо сначала разорвать или ослабить связи между атомами в молекулах исходных веществ. На это надо затратить определенную энергию. Если сталкивающиеся молекулы не обладают такой энергией, то столкновение не приведет к образованию новой молекулы. Если же кинетической энергии сталкивающихся молекул достаточно для ослабления или разрыва связей, то столкновение может привести к перестройке атомов с образованием переходного состояния (активированного комплекса) и затем к образованию молекулы нового вещества:
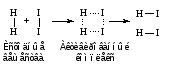
В состоянии активированного комплекса связи в исходных частицах ослаблены, как бы надорваны, и уже образуются новые связи, которые, однако, еще не стали такими же прочными, как в конечных веществах.
Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активацииданной реакции. Ее определяют опытным путем, обозначают Еа и обычно выражают в [кДж/моль]. Молекулы, обладающие такой энергией, называются активными молекулами.
Если большое число молекул заключено при постоянной температуре в некотором объеме, то за счет хаотических соударений в результате теплового движения запас энергии у разных молекул будет различным. Какая-то доля молекул будет обладать наиболее вероятным запасом энергии Еа. Количество молекул N, обладающих иным запасом энергии, будет меньшим, чем больше их энергия отличается от ЕW.
На рисунке 6.2 (кривая 1) показанотипичное распределение молекул по энергии при постоянной температуре t1. При повышении температуры до t2 ЕWвозрастает (ЕW2 > ЕW1), и кривая распределения молекул по энергии сдвигается в сторону больших энергий (кривая 2), что приводит к возрастанию во много раз доли молекул, обладающих энергией, равной или большей Еа(заштрихованная область на рисунке). Это и является причиной резкого увеличения скорости химических реакций при повышении температуры.
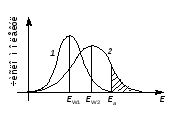
1 – при температуре t1, 2 – при температуре t2 > t1
Рисунок 6.2 – Распределение молекул по энергии
Зависимость скорости реакции от температуры выражается уравнением Аррениуса:
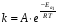 (12) (12)
где k–константа скорости реакции; А –коэффициент, отражающий природу реагирующих веществ; Еа–энергия активации для данного процесса; R–универсальная газовая постоянная; Т –абсолютная температура.
Зависимость скорости реакции от присутствия катализатора
Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость, называются катализаторами. Явление изменения скорости реакции под действием таких веществ называется катализом. Реакции под действием катализаторов называются каталитическими.
В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации (рисунок 6.3). В присутствии катализатора возникают другие активированные комплексы, для образования которых требуется меньше энергии, чем для образования комплексов, возникающих без катализатора. Таким образом, энергия активации понижается; некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Под влиянием катализаторов реакции могут ускоряться в миллионы раз и более. В некоторых случаях под действием катализаторов могут возбуждаться такие реакции, которые без них в данных условиях практически не протекают.
В зависимости от того, однородна или неоднородна среда, в которой протекает каталитическая реакция, различают два вида катализа: гомогенный и гетерогенный.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе, газовой или растворе.
При гетерогенном катализе катализатор и реагенты находятся в разных фазах, например газообразная реакционная смесь и твердый катализатор.
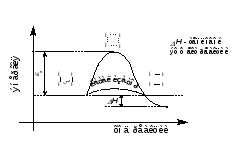
Рисунок 6.3 – Изменение энергии реагирующей системы
Гомогенный катализ, как правило, связан с образованием ре-акционноспособных промежуточных соединений. Примером гомогенного катализа может служить окисление сернистого ангидрида до серного в присутствии оксидов азота. Механизм реакции следующий. Молекула NO легко присоединяет кислород:

Образовавшаяся молекула отдает кислород на окисление сернистого газа:

Регенерированная молекула NO снова присоединяет кислород и окисляет и т.д.
При гетерогенном катализе реакция протекает на поверхности катализатора, поэтому особую роль играют площадь поверхности, состав и структура поверхностного слоя катализатора. В свою очередь, структура катализатора зависит от способа его приготовления, в частности, от термической обработки. Наилучшими каталитическими свойствами обычно обладают катализаторы, приготовленные при возможно более низкой температуре и потому имеющие несовершенную кристаллическую структуру и большую удельную поверхность. Так, часто применяемый в качестве катализатора оксид алюминия получают обезвоживанием гидроксида при температуре не выше 400 °С. Никелевые катализаторы, которые используются в реакциях гидрирования, получают восстановлением гидроксида никеля водородом при температуре 300 °С; если температура более высокая, то активность катализатора понижается.
Катализаторы отличаются друг от друга по специфичности действия. Так, существуют универсальные катализаторы, применимые к самым разнообразным реакциям. Например, платина может катализировать как реакции окисления, так и реакции гидрирования, хотя по возможности ее стараются заменять более дешевыми веществами.
Некоторые катализаторы способны катализировать целую группу однотипных реакций, т.е. обладают групповой специфичностью. Например, оксид ванадия может служить катализатором для реакций окисления оксида серы, аммиака и других веществ. Никель является хорошим катализатором для реакций гидрирования (присоединения водорода).
Абсолютной специфичностью отличаются многие ферменты – белковые вещества, являющиеся катализаторами биохимических процессов в живых организмах. Так, в организме человека действует несколько десятков тысяч ферментов, большинство из которых катализируют только одну специфическую реакцию.
В качестве катализатора могут выступать продукты самой реакции – такое явление носит название автокатализа. Например, реакция окисления щавелевой кислоты перманганатом калия ускоряется по мере того, как в системе накапливается продукт реакции – ионы Мn2+, играющие роль катализатора.
Обычно каталитическим действием обладает не вся поверхность катализатора, а лишь незначительная часть ее – так называемые активные центры. Есть вещества – «каталитические яды» (ингибиторы), которые, попадая на катализатор, выводят его из строя, «отравляют» его. Например, платиновые катализаторы отравляются соединениями мышьяка, селена и теллура. Отравление катализатора происходит под действием очень небольших количеств каталитических ядов, достаточных для блокирования лишь активных центров. Действие ингибиторов может быть также связано с дезактивацией активных частиц реагентов и промежуточных продуктов.
В качестве ингибиторов могут выступать не только посторонние для данной реакции вещества. Ими могут быть и продукты самой катализируемой реакции в том случае, если они прочно адсорбируются на поверхности катализатора и закрывают доступ к ней молекулам реагирующих веществ.
Ингибиторы используются на практике для защиты металлов от коррозии, а также для стабилизации малоустойчивых веществ. Так, катализаторами разложения пероксида водорода являются соединения меди, железа, марганца, которые легко могут попасть в нее в производственных условиях. Для связывания этих металлов в нерастворимые соединения к пероксиду добавляют в качестве стабилизатора небольшое количество фосфатов, которые играют роль ингибиторов.
6.3 Химическое равновесие
Рассмотрим обратимую реакцию:
A + В = D + F
Скорости прямой и обратной реакции выражаются уравнениями:
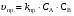 (13) (13)
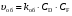 (14) (14)
В начальный момент времени, когда концентрации исходных веществ СА и СВ максимальны, скорость прямой реакции тоже максимальна. С течением времени скорость прямой реакции уменьшается. Реакция приводит к образованию D и F, молекулы которых, сталкиваясь, могут вновь реагировать, давая A и B. Чем выше концентрация D и F (СD и СF), тем вероятнее обратный процесс и тем выше скорость обратной реакции.
На рисунке 6.4 изображен график зависимостей скоростей прямой и обратной реакций от времени. По мере прохождения реакции наступает такой момент, когда скорости прямой и обратной реакций становятся равными, кривые 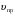 и и 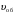 сливаются в одну прямую линию, параллельную оси времени. Такое состояние системы называется состоянием химического равновесия. сливаются в одну прямую линию, параллельную оси времени. Такое состояние системы называется состоянием химического равновесия.
Итак, будем называть химическим равновесием состояние химической системы, не изменяющееся во времени и достижимое с двух противоположных сторон.Иначе говоря, химическое равновесие – это общий предел прямой и обратной реакции.
В состоянии равновесия скорости прямой и обратной реакций равны. Таким образом, химическое равновесие является равновесием динамическим, т.е. в состоянии равновесия химическое взаимодействие не прекращается, одновременно протекают прямая и обратная реакции, причем за единицу времени образуется такое же количество продуктов реакции, сколько их превращается в исходные вещества, в результате чего концентрации веществ, участвующих в равновесии, остаются постоянными.
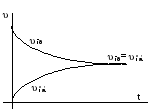
Рисунок 6.4 – Зависимости скоростей прямой и обратной реакций от времени
Состав реакционной смеси, соответствующий состоянию равновесия, называется равновесным составом, а концентрации веществ, находящихся в равновесии, называются равновесными концентрациями.
Итак, при равновесии скорости прямой и обратной реакций равны, значит:
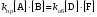 , (15) , (15)
где [A], [B] и [D], [F] – равновесные концентрации исходных веществ и продуктов реакции соответственно.
Тогда константа химического равновесия:
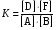 (16) (16)
Равновесный состав зависит от природы веществ, участвующих в равновесии, от соотношения количеств исходных веществ, а также от внешних условий (температуры, давления). При изменении любого из этих факторов равновесный состав изменяется − равновесие смещается.
Если реакции характеризуются наличием отличных от единицы коэффициентов: аА + bВ 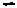 dD + fF, в таком случае: dD + fF, в таком случае:
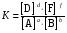 (17) (17)
Получившееся уравнение – математическая запись закона действующих масс: для одной и той же температуры отношение произведений равновесных концентраций веществ (в степенях их стехиометрических коэффициентов) в правой и левой частях уравнения химической реакции представляет постоянную величину.
В уравнение входят только те концентрации веществ, которые могут изменяться в ходе реакции. Концентрации твердых веществ, а также концентрация растворителя (если реакция протекает в растворе) в уравнение не входят.
Численная величина константы равновесия зависит от температуры, но не зависит от концентрации веществ в равновесной системе. Это значит, что при изменении концентрации одного из веществ концентрации других веществ изменяются за счет протекания реакции в ту или иную сторону таким образом, что константа равновесия остается постоянной. Это правило действует достаточно точно при небольших концентрациях веществ. В некоторых случаях при высоких концентрациях величина константы равновесия может несколько меняться в зависимости от концентрации веществ.
Константа равновесия − одна из важнейших характеристик химической системы, позволяющая судить о возможности протекания того или иного химического процесса и глубины его протекания.
Если К>>1, процесс сильно сдвинут в сторону получения продуктов реакции. Реакция пройдет достаточно глубоко, почти до конца, т. е. исходные вещества, взятые в стехиометрическом соотношении, вступят в реакцию практически полностью.
Если К<<1, наоборот, процесс сдвинут влево и практически не идет. Это означает, что, взяв чистые исходные вещества, удастся провести реакцию при этих условиях (при данной температуре) лишь в незначительной степени.
При К=1 в равновесной смеси концентрации исходных веществ и продуктов реакций одинаковы.
6.4 Смещение химического равновесия. Принцип Ле-Шателье
Если система находится в состоянии равновесия, то она будет пребывать в нем до тех пор, пока внешние условия сохраняются постоянными. Если же условия изменяются, то система выйдет из равновесия − скорости прямого и обратного процессов изменятся неодинаково.
Характер смещения химического равновесия в системе при изменении условий, в которых она находится, описывается так называемым принципом Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию веществ), то равновесие сместится в сторону протекания той реакции, которая ослабляет это воздействие.
Рассмотрим 3 случая нарушения равновесия.
1. Изменение концентрации какого-либо из веществ, участвующих в реакции (температура и давление постоянны).
Рассмотрим реакцию взаимодействия водорода с парами йода:
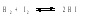
Константа равновесия данной реакции вычисляется по формуле
 (18) (18)
Введем в систему дополнительно, например, водород. Согласно закону действия масс это повлечет за собой увеличение прямой реакции – реакции синтеза НI и концентрация Н2 и I2 будет уменьшаться, что приведет к уменьшению скорости прямой реакции, концентрация НI возрастет, это приведет к возрастанию обратной реакции, затем наступит равновесие, но при этом концентрация НI будет теперь выше, а концентрация I2 ниже, т.е. равновесие сместится вправо.
Если увеличим концентрацию НI, то равновесие сместится в обратном направлении.
Увеличение концентрации одного из реагирующих веществ путем ввода в систему дополнительного количества этого вещества смещает равновесие в сторону прямой реакции (т. е. расходования части дополнительно введенного вещества), а повышение концентрации одного из продуктов − в сторону обратной реакции (по той же причине). Напротив, уменьшение концентрации одного из исходных веществ ведет к смещению равновесия в сторону обратной реакции, а уменьшение концентрации одного из продуктов − к смещению равновесия в сторону прямой реакции. Как мы видим, во всех случаях система как бы стремится восполнить убыль вещества за счет расходования других веществ системы либо превратить в другие вещества его избыток.
Отсюда следует, что, вводя в систему избыток того или иного вещества-участника равновесия или, наоборот, выводя его из системы, можно управлять выходом продуктов реакции, направляя его в необходимую сторону. Этим широко пользуются на практике. Если, например, вещество А, участвующее в процессе
А + В 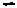 С + D С + D
представляет значительную ценность и потому желательно использовать его максимально полно, то для реакции берут большой избыток вещества В, представляющего меньшую ценность.
2. Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема, температура постоянна).
Если в реакции участвуют газообразные вещества, то при увеличении давления равновесие смещается в сторону образования меньшего количества газообразных веществ. Например:
А (г) + В (г)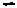 С (г) С (г)
В левой части – 1 моль газа А и 1 моль газа В, в правой – 1моль газа С. При увеличении давления равновесие смещается в сторону образования вещества С, при уменьшении давления – в сторону образования веществ А и В.
Отсюда вывод: при увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газа, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул, т.е. в сторону увеличения давления.
3. Нарушение равновесия вследствие изменения температуры
Например, в системе
А + В 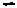 С, ∆H<0 С, ∆H<0
прямая реакция является экзотермической, обратная – эндотермической. С ростом температуры равновесие смещается в сторону веществ A и B (так как эндотермическая реакция ослабляет воздействие), с уменьшением температуры – в сторону образования вещества C.
Как установлено экспериментально, смещение равновесия при изменении температуры можно определить так: «Повышение температуры вызывает смещение равновесия в сторону реакции, идущей с поглощением теплоты, а понижение температуры смещает равновесие в сторону реакции, идущей с выделением теплоты».
Температура оказывает заметное влияние на биохимические процессы, протекающие в пище при ее хранении или в ходе ее приготовления. Скорость порчи пищевых продуктов может быть понижена разными способами, включая замораживание. Например, свежесть и аромат чая зависят от содержания в нем ряда химических веществ, принадлежащих к группе флавинов. При хранении чая содержание в нем флавинов постепенно уменьшается. Скорость разрушения флавинов в чае приблизительно в равной мере зависит от влажности и температуры.
Закономерности, которые проявляются в рассматриваемых примерах нарушения химического равновесия, представляют собой частные случаи принципа Ле-Шателье.
|
 Скачать 1.17 Mb.
Скачать 1.17 Mb.