КОНСПЕКТ ЛЕКЦИЙ ОБЩАЯ ХИМИЯ печать. Конспект лекций Могилев 2012 удк 54 ббк 24
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Тема 6. Окислительно-восстановительные реакции Лекция 10 Вопросы 10.1 Понятие окислительно-восстановительной реакции 10.2 Типы окислительно-восстановительных реакций 10.3 Составление уравнений окислительно-восстановительных реакций методом электронного баланса 10.4 Составление уравнений окислительно-восстановительных реакций методом полуреакций
Окислительно-восстановительная реакция (ОВР) – это единый процесс, состоящий из двух разных полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно. Окисление –это процесс потери электронов атомом, молекулой или ионом. Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Окислителем называется вещество, атомы, молекулы или ионы которого присоединяют электроны: Окислитель восстанавливается в процессе восстановления. Восстановителем называется вещество, атомы, молекулы или ионы которого отдают электроны: Восстановитель окисляется в процессе окисления. Например: 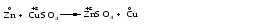 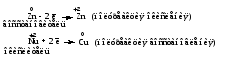 Так как электрон заряжен отрицательно, то при окислении степень окисления (окислительное число) атома изменяется в положительную сторону, а при восстановлении – в отрицательную. При рассмотрении ОВР необходимо определять степени окисления атомов, руководствуясь следующими правилами: – степень окисления атомов в простых веществах равна нулю (Н20, О20, Сl20, S0, P0, Na0, Cu0, Fe0 и др.); – атомы водорода в большинстве соединений имеют степень окисления +1 (Н+1Сl-1). В гидридах металлов атомы водорода имеют степень окисления –1 (Na+1Н-1, Са+2Н2-1); – атомы кислорода в большинстве соединений имеют степень окисления –2 (Са+2О-2, Н2+1О-2). В пероксидах атомы кислорода имеют степень окисления –1 (Н2+1О2-1, Na2+1О2-1), а во фториде кислорода – степень окисления кислорода +2 (О+2F2-1); – атомы фтора во всех соединениях имеют степень окисления –1 (О+2F2-1); – атомы металлов IА, IIА и IIIА подгрупп Периодической системы проявляют в соединениях постоянные степени окисления соответственно +1, +2 и +3 (Na2+1О-2, Са+2О-2, Al2+3O3-2); – алгебраическая сумма всех степеней окисления на отдельных атомах, входящих в состав соединений, равна 0. Степень окисления одного из элементов, входящих в состав соединения, вычисляется через известные степени окисления других элементов.
Различают четыре типа ОВР: межмолекулярные, внутримолекулярные, реакции диспропорционирования и конпропорционирования. 1. Межмолекулярные ОВР –это реакции, которые идут с изменением степени окисления атомов в молекулах разных веществ:  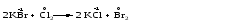 ОВР такого типа встречаются чаще всего. 2. Внутримолекулярные ОВР –это реакции, которые идут с изменением степени окисления разных атомов в одной молекуле. При этом атом элемента с более высокой степенью окисления является окислителем и окисляет атом элемента с меньшей степенью окисления. Например:   3. Реакции диспропорционирования (дисмутации) – это реакции, в которых атомы одного и того же элемента выступают как в роли окислителя, так и восстановителя: 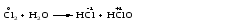 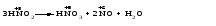 Такие реакции возможны для веществ, в которых данный элемент имеет промежуточную среди возможных для него степень окисления, и потому его атомы могут выступать как в роли окислителя, так и восстановителя. 4. Реакции конпропорционирования (конмутации) –это реакции, обратные реакциям диспропорционирования. В результате этих реакций атомы одного элемента, находящиеся в разных степенях окисления, переходят к общей, промежуточной между исходными, степени окисления. При этом атом, находящийся в более высокой степени окисления, выступает в роли окислителя, а находящийся в более низкой степени окис ления ‒ в роли восстановителя. Реакции конпропорционирования могут быть межмолекулярными 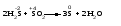 и внутримолекулярными 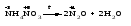 Реакции диспропорционирования и конпропорционирования иногда объединяют общим названием реакции самоокисления-самовосстановления. 10.3 Составление уравнений ОВР методом электронного баланса При написании уравнений ОВР используют два метода расстановки коэффициентов: метод электронного баланса (окислительных чисел) и метод полуреакций (ионно-молекулярный метод). В методе электронного баланса сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуются правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Метод электронного баланса рассмотрим на примере реакции 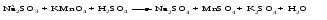 Для расстановки коэффициентов выполняем следующие действия. 1. Определяем элементы, атомы которых изменяют степень окисления: 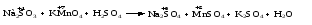 2. Находим окислитель и восстановитель в данной ОВР и пишем отдельно электронные уравнения процессов окисления и восстановления: 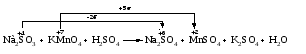  3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс): 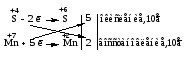 4. Коэффициенты 5 и 2 из электронных уравнений перено сим в молекулярное уравнение ОВР: 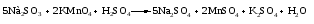 5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения: 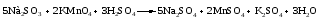
Mетод полуреакций основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Этот метод используется для записи ОВР, протекающих в водных растворах. Следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение его восстановителем происходит по-разному в кислой, нейтральной и щелочной средах в соответствии со следующими правилами: 1) если исходные вещества полуреакции содержат больше атомов кислорода, чем продукты реакции, то в кислых растворах кислород связывается протонами водорода в воду, а в нейтральных и в щелочных средах молекулами воды в гидроксид-ионы: O2-+2H+ = H 2O O2-+HOH = 2OH- 2) если исходные вещества полуреакции содержат меньше атомов кислорода, чем образующие, то недостаток их восполняется в кислых и нейтральных растворах за счет молекул воды, а в щелочных за счет гидроксид-ионов: H2O = O2-+2H+ 2OH- = O2-+ H2O Используем метод полуреакций для записи реакции взаимодействия сульфита натрия с перманганатом калия в кислой среде. Для расстановки коэффициентов выполняем следующие действия. 1. Записываем полное ионно-молекулярное уравнение реакции. При этом, сильные электролиты записываем в виде ионов, а слабые электролиты, газы и малорастворимые вещества – в виде молекул: 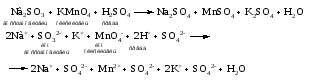 2. Записываем полуреакции окисления и восстановления, уравниваем число атомов кислорода и водорода, алгебраическую сумму зарядов слева и справа в полуреакциях. 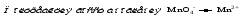 Чтобы связать 4 моль атомов кислорода, требуется 8 моль атомов водорода (процесс идет в кислой среде): 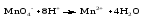 Уравниваем алгебраическую сумму зарядов слева и справа с помощью определенного числа электронов, которые участвуют в процессе:  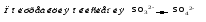 Чтобы получить 1 моль атомов кислорода для окисления SO32-до SO42-, требуется 1 моль молекул H2O (процесс идет в кислой среде): 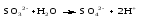 Уравниваем алгебраическую сумму зарядов слева и справа: 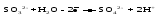 3. Уравниваем число электронов в полуреакциях окисления и восстановления с помощью дополнительных коэффициентов (как в методе электронного баланса). С учетом этих коэффициентов записывают сокращенное ионно-молекулярное уравнение ОВР: 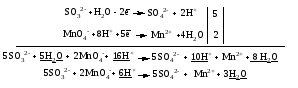 4. Записываем молекулярное уравнение ОВР:  Метод полуреакций позволяет определить все продукты окислительно-восстановительной реакции. Составим уравнения реакций взаимодействия сульфита натрия Nа2SO4 с перманганатом калия КМпО4 в нейтральной и щелочной среде. В нейтральной среде:  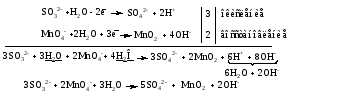 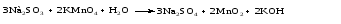 В щелочной среде: 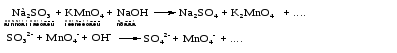  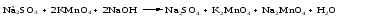 Лекция 11 Вопросы 11.1 Типичные окислители и восстановители 11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей 11.1 Типичные окислители и восстановители Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей из возможных для них степеней окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые или сложные вещества, содержащие атомы, которые находятся не в высшей из возможных для них степени окисления и потому могут повышать свою степень окисления. В качестве типичных окислителей могут выступать: 1) простые вещества, образуемые атомами с большой электроотрицательностью, т.е. типичные неметаллы, расположенные, прежде всего, в главных подгруппах шестой и седьмой групп периодической системы; 2) катионы металлов в высших положительных степенях окисления (Fе3+); 3) кислородсодержащие анионы, соответствующие высшим положительным степеням окисления элемента (нитрат, сульфат); 4) перекисные соединения (пероксиды, супероксиды и т.д.). Конкретными веществами, применяемыми на практике в качестве окислителей, являются, например, кислород и озон, хлор, бром, пероксид водорода и пероксиды металлов, хроматы, дихроматы и перманганаты, кислородные кислоты хлора и их соли, азотная кислота, концентрированная серная кислота. В качестве типичных восстановителей могут выступать: 1) простые вещества, особенно те, атомы которых имеют низкую электроотрицательность («активные» металлы); 2) катионы металлов в низших положительных степенях окисления (Fе2+); 3) простые, элементарные анионы, например сульфид-ион; 4) кислородсодержащие анионы, соответствующие низшим положительным степеням окисления элемента (нитрит, сульфит). Конкретными веществами, применяемыми на практике в качестве восстановителей, являются, например, щелочные и щелочноземельные металлы, сульфиды, сульфиты, галогеноводороды (кроме НF), соли двухвалентного железа, органические вещества – формальдегид, глюкоза, щавелевая кислота, а также водород, углерод, монооксид углерода и алюминий при высоких температурах. Если какое-то вещество содержит некоторый элемент в промежуточной (не высшей и не низшей из возможных для него) степени окисления, то будет ли это вещество вести себя как окислитель или как восстановитель зависит от его «партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, нитрит-ион NО2- в кислой среде выступает в роли окислителя по отношению к иону I-: 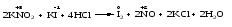 и в роли восстановителя по отношению к перманганат-иону МnО4-:  Характер продуктов окисления восстановителя и восстановления окислителя зависит от «партнера» по реакции, концентрации реагентов, характера среды (кислая, нейтральная, щелочная) и температуры. 11.2 Поведение в окислительно-восстановительных реакциях некоторых типичных окислителей и восстановителей Рассмотрим поведение в ОВР некоторых типичных окислителей и восстановителей. Перманганат калия КМnО4 В зависимости от характера среды КМnО4 восстанавливается до разных продуктов. Из приведенной ниже схемы видно, что его окислительные свойства проявляются в наибольшей степени в кислой среде, при этом он восстанавливается до иона Мn2+, в щелочной же среде его окислительные свойства выражены в наименьшей степени, и он восстанавливается до Мn(+6): 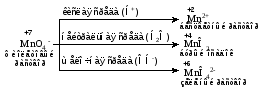 Например: 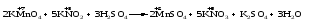 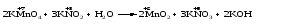  Хроматы и дихроматы В зависимости от характера среды хром (VI) может находиться в водных растворах в виде хроматов (анион СrO42-) или дихроматов (анион Сr2O72-):  Окислительные свойства хрома (VI) сильнее всего проявляются в кислой среде, где он находится в виде дихромат-иона. В водном растворе дихромат восстанавливается до иона Сr3+, например: 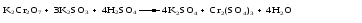 Восстановительные же свойства хрома сильнее всего проявляются в щелочной среде, при этом он окисляется до хроматов, например: 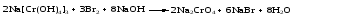 Kислоты Kислоты Всякая кислота диссоциирует с образованием ионов водорода. Эти ионы, взаимодействуя с металлами, стоящими в ряду напряжений левее водорода, восстанавливаются до свободного водорода, например:  Поэтому всякая кислота, взаимодействуя с металлом с выделением водорода, выступает в роли окислителя за счет восстановления ионов водорода. Кроме того, у кислородных кислот центральный атом может понижать свою степень окисления, в результате чего анион этой кислоты также может выступать в роли окислителя. Так, в молекуле серной кислоты имеется атом серы в степени окисления +6, который может восстанавливаться до более низкой степени окисления: до +4 (SO2), 0 (S), ‒2 (H2S). Следовательно, молекула серной кислоты может выступать в роли окислителя еще и за счет восстановления серы в степени окисления +6. Чтобы особо выделить такие кислоты, называем их кислотами-окислителями. Это, например, концентрированная серная кислота, а также азотная кислота как концентрированная, так и разбавленная. Окислительные свойства таких кислот приводят к тому, что при их действии на металлы водород вообще не выделяется. Это связано с тем, что окислителем в данном случае является не Н+, а более сильный окислитель ‒ анион кислоты. Поэтому кислоты-окислители могут окислять даже металлы, стоящие справа от водорода в ряду напряжений, неметаллы (например, серу, фосфор, углерод), а также некоторые сложные вещества, в частности, сульфиды металлов. Если в такой кислоте растворяется оксид металла, в котором последний находится в низкой степени окисления, то происходит окисление металла до более высокой степени окисления. При реакции с неметаллами последние окисляются либо до кислоты (если последняя устойчива), либо до ангидрида такой кислоты (если кислота неустойчива). Что касается самой кислоты, то, в зависимости от активности восстановителя (например, металла), концентрации кислоты и температуры, кислота может восстанавливаться до разных продуктов, соответствующих разным степеням окисления центрального атома кислоты, причем чаще всего протекают параллельные реакции и получается смесь продуктов восстановления. Концентрированная серная кислота при нагревании реагирует даже с теми металлами, которые стоят в ряду напряжений после водорода, например, с медью. При реакции концентрированной серной кислоты с металлами водород не выделяется. При этом в зависимости от активности металла образуется оксид серы(IV), элементарная сера или сероводород. Чем выше активность металла, тем более глубоко идет процесс восстановления серной кислоты. Продукты восстановления кислоты можно представить следующей схемой: 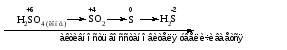 Например: 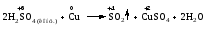 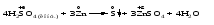 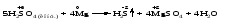 При контакте холодной концентрированной серной кислоты со многими металлами (прежде всего Аl, Сr, Fе) наблюдается пассивирование металла, т.е. образование на его поверхности защитной оксидной пленки, препятствующей дальнейшему протеканию реакции. Однако при нагревании взаимодействие металла с кислотой делается возможным. Так, железо растворяется в горячей концентрированной кислоте, при этом оно окисляется до степени окисления +3: 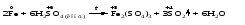 Концентрированная серная кислота при нагревании реагирует со многими неметаллами, при этом она восстанавливается до сернистого ангидрида, а неметалл окисляется до соответствующей кислоты (или ее ангидрида, если кислота неустойчива): 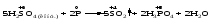 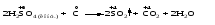 Азотная кислота обладает окислительной способностью при любой концентрации. Она реагирует почти со всеми металлами, кроме Аu, Pt и некоторых других. Следует помнить, что водород не выделяется практически при любой концентрации азотной кислоты.Характер продуктов восстановления кислоты зависит от активности восстановителя, например, металла, и концентрации кислоты. С возрастанием активности восстановителя и уменьшением концентрации кислоты степень окисления азота в продукте восстановления уменьшается: 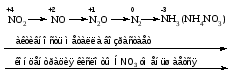 Азотная кислота реагирует также с неметаллами. При этом концентрированная кислота восстанавливается до NО2, а разбавленная ‒ до NО. Например: 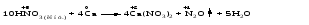  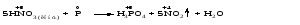  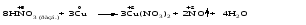 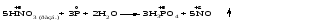  Продукты восстановления азотной кислоты можно условно представить следующей схемой: 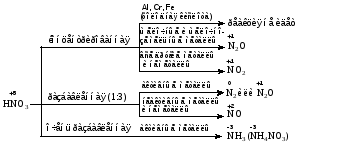 Очень сильным окислителем является «царская водка»: смесь одного объема концентрированной азотной кислоты с тремя объемами концентрированной соляной кислоты. Царская водка способна окислять даже металлы, стоящие в крайней правой части ряда напряжений, например, золото и платину. Окислительные свойства царской водки связаны с наличием в ней промежуточного соединения ‒ нитрозилхлорида NОCl, образующегося при окислении НС1 азотной кислотой: 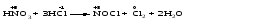 Нитрозилхлорид легко распадается с образованием атомарного хлора, который является очень сильным окислителем: 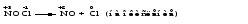 Протеканию реакции между царской водкой и такими металлами, как золото или платина, способствует также связывание образующихся ионов металла в прочный комплекс, например: 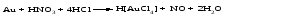 Для простоты эту реакцию обычно записывают следующим образом:  |
