КОНСПЕКТ ЛЕКЦИЙ ОБЩАЯ ХИМИЯ печать. Конспект лекций Могилев 2012 удк 54 ббк 24
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Лекция 14 Вопросы
Солями называются соединения, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп) и одного (нескольких) кислотных остатков. Соли можно рассматривать как продукты реакции нейтрализации, в которой атомы водорода кислоты и гидроксогруппы основания соединяются, образуя воду, а атомы металла и кислотный остаток дают соль: 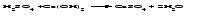 По составу соли подразделяют на средние (нормальные), кислые (гидросоли), основные (гидроксосоли), двойные, смешанные и комплексные. Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла или как продукты полной нейтрализации основания кислотой:  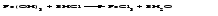 Кислые соли можно рассматривать как продукты неполного замещения атомов водорода в многоосновной кислоте атомами металла. Кислые соли состоят из атомов металла и кислых кислотных остатков, т. е. кислотных остатков, содержащих атомы водорода: 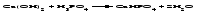 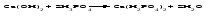 Основные соли можно рассматривать как результат неполного обмена гидроксогрупп многокислотного основания на кислотные остатки. Основные соли состоят из атомов металла, гидроксогрупп и кислотных остатков:  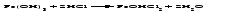 Взаимные превращения кислых, средних и основных солей можно представить следующей схемой:  Рассмотрим на примерах все возможные взаимные превращения кислых, средних и основных солей: 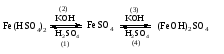   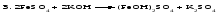  Соли, содержащие атомы двух разных металлов при общем кислотном остатке, называются двойными солями. Одним из наиболее типичных примеров двойных солей, часто встречающихся в химической практике, являются квасцы ‒ двойные сульфаты состава МеI МеII(SO4)2·12Н2О, где МеI ‒ чаще всего Nа+, К+, NН4+, а МеII ‒ А1+3, Fе+3 и Сr+3. Смешанными называют соли, содержащие атомы одного металла, но разные кислотные остатки. Примерами смешанных солей могут служить белильная известь СаОСl2, в которой содержатся два разных кислотных остатка ‒ гипохлорит (СlO-) и хлорид (Cl-). В водных растворах двойные и смешанные соли, если они растворимы, ведут себя как смесь двух соответствующих средних солей. Так, алюмокалиевые квасцы ведут себя как смесь сульфатов калия и алюминия, образуя в растворах ионы К+, А1 3+ и SO42- а белильная известь ведет себя как смесь гипохлорита и хлорида кальция, образуя в растворе ионы Са2+, СlO- и С1-. Комплексными называют соли, содержащие комплексный катион или комплексный анион, например, K4[Fe(CN)6], [Ag(NH3)2]Cl. Название средней соли по международной номенклатуре состоит из латинского названия кислотного остатка и названия металла в родительном падеже, причем для металлов, проявляющих разные степени окисления, указывают степень окисления. При этом следует помнить, что кислотные остатки кислородсодержащих кислот имеют суффикс «-ат», если образующий кислоту элемент находится в высшей степени окисления, и «-ит» ‒ если в более низкой степени окисления. Например:
Кислотные остатки бескислородных кислот имеют суффикс «-ид»:
Для солей бескислородных кислот часто употребляют названия, в которых с помощью греческого числительного указано число атомов неметалла:
В технической литературе встречаются и старые русские названия солей. Для солей кислородсодержащих кислот они состоят из прилагательного, составленного из названия кислоты (без окончания) и слова кислый, и далее названия металла в именительном падеже. Например, СаSО4 ‒ сернокислый кальций, К2SО3 ‒ сернистокислый калий. Старые русские названия солей бескислородных кислот состоят из прилагательного, образованного от названия неметалла, и названия металла в именительном падеже. При этом, если металл, проявляющий разные степени окисления, находится в высшей степени окисления, то прилагательное содержит суффикс «-н», а если металл имеет только одну степень окисления или находится в низшей степени окисления, то прилагательное содержит суффикс «-ист». Например: FeC13 ‒ хлорное железо, FеС12 ‒ хлористое железо, КС1 ‒ хлористый калий. Старую русскую номенклатуру можно встретить в названиях удобрений, химических реактивов и медикаментов. На практике часто используются исторически сложившиеся эмпирические названия солей, например: NaС1 ‒ поваренная соль или каменная соль, KNО3, NаNО3, Са(NО3)2 ‒ соответственно калиевая (калийная), натриевая (чилийская) и кальциевая селитры, CaСО3 ‒ кальцинированная сода, СuSО4·5H2O ‒ медный купорос. Названия кислых и основных солей составляются следующим образом. Для кислых солей перед названием кислотного остатка добавляется приставка «гидро-», если кислотный остаток содержит один атом водорода, «дигидро-», если два атома водорода, и т.д. Например: СаНРO4 ‒ гидрофосфат кальция, Са(Н2PO4)2 ‒ дигидрофосфат кальция. Для основных солей перед названием металла добавляется слово гидроксо-, если на один атом металла приходится одна гидроксогруппа, дигидроксо-, если две гидроксогруппы, и т.д. Например: АlOHSO4 ‒ сульфат гидроксоалюминия, [А1(ОН)2]2SO4 ‒ сульфат дигидроксоалюминия. 14.2 Физические и химические свойства средних солей При обычных условиях соли представляют собой твердые вещества, обладающие различной растворимостью в воде, которая зависит от сочетания металла и кислотного остатка. Физические свойства солей обусловлены тем, что они имеют ионную кристаллическую решетку. Химические свойства средних солей 1 Диссоциация солей Средние соли диссоциируют в одну ступень с образованием катионов металлов (катиона аммония) и анионов кислотных остатков. 2 Взаимодействие солей с металлами: 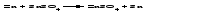 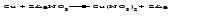 Металлы, расположенные в ряду напряжений левее, могут вытеснять металлы, расположенные в этом ряду правее, из растворов их солей, в результате чего образуется соль более активного металла. Реакции обмена (3 – 5) идут лишь при условиях, определяющих возможность протекания реакций этого типа 3 Действие кислот на соли: 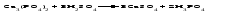  4 Действие оснований (щелочей) на соли:   5 Взаимодействие двух солей: 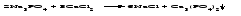 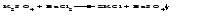 6 Разложение солей Некоторые соли сравнительно легко разлагаются при нагревании. Так, карбонаты (за исключением карбонатов щелочных металлов) при нагревании разлагаются на оксид металла и углекислый газ: 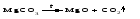 Если же оксид неустойчив, то образуется металл: 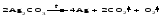 Карбонаты щелочных металлов более устойчивы; например, карбонаты натрия и калия плавятся без разложения при температурах выше 850 °С. Разложение при нагревании характерно также для нитратов. В случае нитратов щелочных металлов продуктами разложения являются соответствующие нитриты: 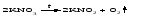 Нитраты других металлов разлагаются до оксидов (если последние устойчивы при нагревании) или до металла (если оксиды неустойчивы). Например:  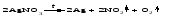 14.3 Способы получения средних солей 1 Синтез из простых веществ (реакция соединения металла и неметалла):  2 Действие кислоты на металл:  3 Действие металла, стоящего левее в ряду напряжений, на соль металла, находящегося в этом ряду правее: 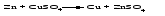 4 Реакция соединения основного и кислотного оксидов: 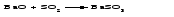 5 Действие кислоты на основный оксид: 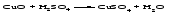 6 Действие кислотного оксида на основание:  7 Реакция нейтрализации между кислотой и основанием: 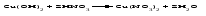 8 Реакция обмена соли с растворимым основанием: 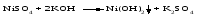 9 Обменная реакция кислоты с солью: 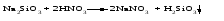 10 Реакция обмена между двумя солями: 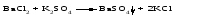 Следует отметить, что реакция 1 применима для получения солей только бескислородных кислот, а реакции 4 и 6 – солей только кислородсодержащих кислот. При проведении реакций 8, 9 и 10 необходимо помнить об условиях, при которых реакции обмена идут до конца (практически необратимы). 14.4 Физические и химические свойства кислых и основных солей Кислые и основные соли – твердые кристаллические вещества, обладающие различной растворимостью в воде. Растворимость в воде кислых солей является промежуточной между растворимостями соответствующих кислоты и средней соли, а растворимость основных солей – промежуточной между растворимостями соответствующих основания и средней соли. Так, в ряду 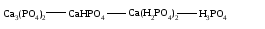 наблюдается резкое увеличение растворимости: ортофосфат кальция в нейтральной среде практически нерастворим, гидрофосфат кальция малорастворим, дигидрофосфат растворим значительно лучше и, наконец, фосфорная кислота смешивается с водой в любых соотношениях. Аналогичным образом растворимость быстро увеличивается в ряду 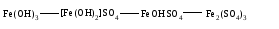 Химические свойства кислых солей 1 Диссоциация солей Кислые соли диссоциируют ступенчато. При диссоциации кислых солей в растворе вначале образуются катионы металла и сложные анионы кислотного остатка, которые в свою очередь подвергаются вторичной диссоциации с образованием протонов водорода. 2 Действие оснований на соли Так как кислые соли содержат атомы водорода, способные замещаться металлом, то они могут взаимодействовать с основаниями, превращаясь в средние или другие кислые соли с меньшим числом атомов водорода. Например:   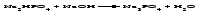 3 Разложение солей Кислые соли обычно бывают термически неустойчивыми. При нагревании они отщепляют воду и превращаются либо в средние соли той же кислоты, либо в средние соли кислоты с большим содержанием ангидрида: 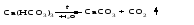 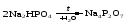 Химические свойства основных солей 1 Диссоциация солей Основные соли диссоциируют ступенчато. При диссоциации основных солей вначале образуются анионы кислотного остатка и сложные катионы, состоящие из металла и гидроксильной группы. Эти сложные катионы подвергаются вторичной диссоциации с образованием гидроксид-ионов. 2 Действие кислот на соли Основные соли содержат гидроксогруппы, которые могут участвовать в реакции нейтрализации, поэтому они могут реагировать с кислотами, превращаясь в средние или в другие основные соли с меньшим числом гидроксогрупп. Например: 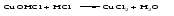 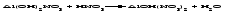 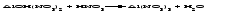 3 Разложение солей Основные соли при нагревании могут терять воду, образуя оксосоли:  Если основные соли – вещества промежуточные по составу между средними солями и основаниями, то оксосоли – вещества промежуточные по составу между средними солями и оксидами. Как и основные соли, оксосоли при действии кислот можно перевести в средние соли: 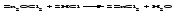 14.5 Способы получения кислых и основных солей Кислые соли можно получить при реакциях: 1) Взаимодействия кислоты с основанием (недостаток основания): 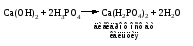 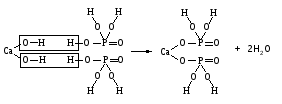 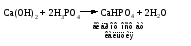 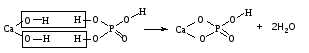 2) Взаимодействия средней соли с кислотой: а) для реакции можно взять ту же кислоту, которая образует соль:  б) может участвовать другая кислота (отличная от кислоты, образо вавшей среднюю соль): 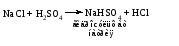
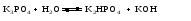 Основные соли можно получить при реакциях: 1) Взаимодействия кислоты с основанием (недостаток кислоты): 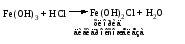 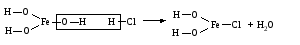 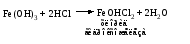 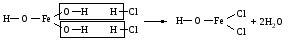 2) Взаимодействия средней соли со щелочью: 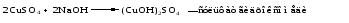 3) Гидролиз средних солей, образованных слабым многокислотным основанием и сильной кислотой:  Список использованных источников 1 Глинка, Н.Л.Общая химия. – М. : Интеграл-Прес, 2003. – 728 с. 2 Семенов, И.Н. Химия: учебник для вузов. – СПб.: Химиздат, 2000. – 656 с. 3 Ахметов, Н.С. Общая и неорганическая химия. – М. : Высшая школа, 2006. – 743 с. Учебное издание ХИМИЯ ОБЩАЯ ХИМИЯ Конспект лекций Составители: Картель Наталья Владимировна Степурко Елена Николаевна Редактор А.А. Щербакова Технический редактор Т.В. Багуцкая Подписано в печать 27.11.2012. Формат 60×84 1/16. Бумага офсетная. Гарнитура Таймс. Ризография. Усл. печ. 5,6 л. Уч.-изд. 6,0 л. Тираж 113 экз. Заказ 150. Учреждение образования «Могилевский государственный университет продовольствия». ЛИ № 02330/630 от 31.01.2012 г. Пр-т Шмидта, 3, 212027, Могилев. Отпечатано в учреждении образования «Могилевский государственный университет продовольствия». Пр-т Шмидта, 3, 212027, Могилев. |
