КОНСПЕКТ ЛЕКЦИЙ ОБЩАЯ ХИМИЯ печать. Конспект лекций Могилев 2012 удк 54 ббк 24
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Физические и химические свойства кислот Кислоты при обычных условиях могут быть твердыми (Н3РО4), жидкими (HNO3, H2SO4) или растворами газов в воде (НСl, H2S). Некоторые кислоты, например азотистая HNO2, сернистая H2SO3, угольная H2CO3, существуют только в разбавленных растворах; при попытке концентрирования таких растворов они распадаются на оксид и воду или продукты разложения оксида и воду и, таким образом, не могут быть выделены в чистом виде: 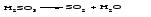 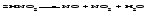 Таблица 13.1 – Названия наиболее часто встречающихся на практике кислот и соответствующих им кислотных остатков
Химические свойства кислот 1 Диссоциация кислот В растворах кислоты диссоциируют с образованием протонов водорода и анионов кислотного остатка. Одноосновные кислоты диссоциируют в одну ступень, многоосновные кислоты подвергаются ступенчатой диссоциации Под воздействием протонов водорода индикаторы лакмус и метилоранж окрашиваются в красный цвет; фенолфталеин в кислой среде бесцветен. 2 Взаимодействие кислот с основаниями (реакция нейтрализации): 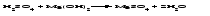 3 Взаимодействие кислот с основными оксидами: 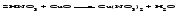 4 Взаимодействие кислот с металлами: 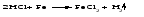 Металлы, стоящие в ряду напряжений (электрохимический ряд металлов) до водорода, могут замещать атомы водорода в кислотах, при этом образуется соль и выделяется водород, причем металл окисляется до низшей устойчивой в водной среде степени окисления (например, железо – до Fe2+). При действии азотной (в любой концентрации) или концентрированной серной кислоты на металлы также образуются соли, но водород не выделяется. 5 Взаимодействие кислот с солями Кислоты взаимодействуют с солями, образуя новые кислоты (иногда их оксиды) и новые соли. Реакции кислот с солями могут происходить при определенных условиях. Например, так называемые сильные кислоты (H2SO4, HC1, HNO3 и др.) вытесняют в процессе взаимодействия с солями более слабые кислоты (Н3РО4, HNO2, H2CO3, H2 S и др.):  Кроме того, реакция возможна, если в результате нее образуется нерастворимое, разлагающееся или летучее вещество (кислота или оксид):   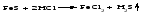 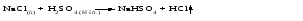
1 Взаимодействие простого вещества с водородом Только бескислородные кислотыможно получить взаимодействием простого вещества с водородом и растворением полученного газа в воде: 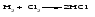 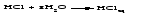 (символ «aq» означает, что вещество растворилось или образовалось соединение с неопределенным количеством воды). 2 Взаимодействие оксида с водой Только кислородсодержащие кислотыможно получить взаимодействием оксида с водой (если образующаяся кислота растворима в воде): 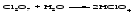 3Взаимодействие кислоты с солью Как кислородсодержащие, так и бескислородные кислоты можно получить действием сильной кислоты на соль, если образуется летучая, малорастворимая или слабая кислота: 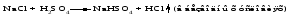 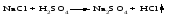  
Амфотерными называют оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства, т. е. реагирующие, соответственно, как с кислотами, так и со щелочами. Амфотерному оксиду соответствует амфотерный гидроксид. Например, амфотерному оксиду ZnO соответствует амфотерный гидроксид Zn(ОH)2, a амфотерному оксиду Al2O3 ‒ амфотерный гидроксид Аl(ОН)3. Проявляя основные свойства, амфотерные оксиды и гидроксиды реагируют с кислотами, образуя соль и воду, например:  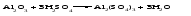 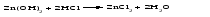  Проявляя кислотные свойства, они реагируют со щелочами, также образуя соль и воду, например: 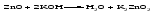  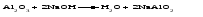  Чтобы правильно составить формулу образующейся соли, следует написать формулу амфотерного гидроксида так, как обычно записывается формула кислоты, и отсюда найти формулу соответствующего кислотного остатка. Например, в случае соединений цинка и алюминия надо мысленно проделать следующие логические переходы: 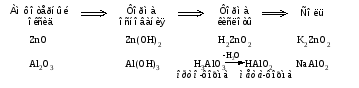 Следует обратить внимание, что в случае алюминия кислота теряет одну молекулу воды, т.е. образовавшаяся соль соответствует не ортоалюминиевой кислоте Н3AlO3, а метаалюминиевой кислоте НАlO2. Амфотерными свойствами обладает большое число оксидов и гидроксидов, например оксиды и гидроксиды бериллия, хрома (III), олова(II), свинца(II), олова(IV), свинца(IV). Амфотерные гидроксиды практически нерастворимы в воде, поэтому соответствующие им амфотерные оксиды с водой не взаимодействуют. Как основные, так и кислотные свойства этих гидроксидов выражены слабо, т. е. они являются и слабыми основаниями, и слабыми кислотами одновременно. Поскольку амфотерные гидроксиды растворимы в растворах щелочей, то для получения таких гидроксидов нельзя брать избыток щелочи в обменной реакции между солью и щелочью, так как это приведет к растворению в ней амфотерного гидроксида. Чтобы этого не произошло, иногда бывает достаточно вместо гидроксида натрия взять гидроксид аммония, в котором амфотерные гидроксиды с очень слабыми кислотными свойствами не растворяются. При растворении гидроксида алюминия в щелочи могут образовываться разные соединения. Это связано с разной степенью гидратации этих соединений и разным количеством щелочи, участвующей в реакции: Так, если в растворах алюминатов щелочных металлов присутствует ион [А1(ОН)4]-, то в безводном состоянии алюминаты содержат ион АlO2-, т.е. при растворении гидроксида алюминия в растворе NaOH образуется тетрагидроксоалюминат натрия Na[Al(OH)4], а при обезвоживании последнего – метаалюминат натрия NaAlO2: 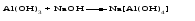 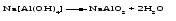 Аналогичным образом реакцию гидроксида цинка со щелочью можно записать двумя способами: 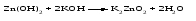 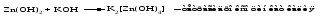 Рассмотренные примеры могут служить моделью для предсказания возможных форм соединений, которые образуются при действии щелочи на амфотерный оксид или гидроксид, Аl(ОН)3 ‒ модель для металлов в степени окисления (+3), Zn(ОН)2 ‒ для металлов в степени окисления (+2). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
