КОНСПЕКТ ЛЕКЦИЙ ОБЩАЯ ХИМИЯ печать. Конспект лекций Могилев 2012 удк 54 ббк 24
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Тема 7. Основные классы неорганических соединений Лекция 12 Вопросы 12.1 Основные классы неорганических соединений 12.2 Оксиды. Общая характеристика, номенклатура и классификация оксидов 12.3 Физические и химические свойства оксидов 12.4 Способы получения оксидов 12.5 Основания. Общая характеристика, номенклатура и классификация оснований 12.6 Физические и химические свойства оснований
12.1 Основные классы неорганических соединений Основными классами неорганических соединений являются оксиды, основания, кислоты и соли (таблица 12.1). Таблица 12.1 – Основные классы неорганических соединений
Примечание – Э – элемент, Ме – металл, В – кислотный остаток Основания и кислородсодержащие кислоты часто рассматриваются как гидраты оксидов и объединяются в единый класс гидроксидов, имеющих основный или кислотный характер.
Оксидами называют бинарные (состоящие из двух элементов) соединения, в которых один из элементов - кислород, причем атомы кислорода не связаны между собой и находятся в степени окисления -2. Этим оксиды отличаются от пероксидов и других кислородных соединений, содержащих группировки из связанных между собой атомов кислорода, вследствие чего степень окисления кислорода в этих соединениях иная. Например, в пероксиде натрия Na2О2 она равна -1. По международной номенклатуре название соединения любого элемента с кислородом (кроме фтора) состоит из слова оксиди названия этого элемента в родительном падеже; если элемент имеет переменную степень окисления, то она указывается после названия элемента римской цифрой в скобках. Употребляются также названия оксидов, в которых вместо указания степени окисления элемента к слову оксиддобавляют приставку, соответствующую греческому числительному, обозначающему число атомов кислорода в формуле оксида (моно-, ди-, три-, тетра-). Для оксидов, как и для других неорганических соединений, часто употребляют исторически сложившиеся эмпирические названия, такие как СО - угарный газ, СаО - негашеная известь, SO2 - сернистый газ. В итоге, например, СО2 имеет следующие названия (в порядке, перечисленном выше): оксид углерода (IV), диоксид углерода, углекислый газ. Оксиды делят на солеобразующие и несолеобразующие. Солеобразующим оксидам, как видно из названия, соответствуют соли, которые образуются при взаимодействии этих оксидов с кислотами или щелочами. Несолеобразующим оксидам (их называют также безразличными или индифферентными) соли не соответствуют: N2O, NO, CO, SiO. В свою очередь солеобразующие оксиды по составу и химическим свойствам делятся на основные, кислотные и амфотерные. Основными называют оксиды, которые реагируют с кислотами, образуя соли. Основным оксидам соответствуют основания (гидроксиды), например:
Основными являются оксиды металлов в невысоких степенях окисления (+1 и +2). Кислотными называют оксиды, которые реагируют со щелочами, образуя соли. Кислотным оксидам соответствуют кислоты, например:
Кислотными являются все солеобразующие оксиды неметаллов, а также оксиды металлов в высоких степенях окисления (+5, +6, +7, +8). Амфотерные оксиды обладают свойствами как основных, так и кислотных оксидов: они реагируют и с кислотами, и с основаниями, образуя соли. Амфотерным оксидам соответствуют амфотерные основания. Амфотерными являются оксиды металлов в средних степенях окисления, чаще всего +3 и +4. Следует отметить, что приведенные выше границы между основными, амфотерными и кислотными оксидами металлов приблизительны. Например: оксид цинка (II) ZnO - амфотерный оксид, оксид скандия (III) Sc2О3 - основный оксид. Если металл проявляет разные степени окисления и образует несколько оксидов, то чем выше степень окисления металла, тем более кислотный характер будет носить этот оксид. Так, МnО - основный оксид, МnO2 - амфотерный, а Mn2O7 - кислотный оксид.
Основные оксиды - твердые тугоплавкие вещества. Химическая связь в таких оксидах близка к ионной. Кислотные оксиды могут быть при обычных условиях газообразными веществами (СО2, SO2), жидкостями (С12O7, Mn2O7) и твердыми веществами (N2O5, Р2O5). Твердые кислотные оксиды являются относительно легкоплавкими и летучими веществами. Это связано с тем, что типичные кислотные оксиды в твердом состоянии имеют молекулярную структуру. Кислотные оксиды, имеющие атомную кристаллическую решетку (SiО2, B2O3), относительно тугоплавки и нелетучи. Химические свойства оксидов 1 Взаимодействие оксидов с водой Основные оксиды с водой образуют основания, если последние растворимы: 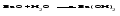 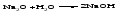 Оксиды, которым соответствуют нерастворимые основания, с водой непосредственно не взаимодействуют. Кислотные оксиды (ангидриды) с водой образуют кислоты:   Большинство кислотных оксидов реагирует с водой; оксиды, которым соответствуют нерастворимые кислоты, например, оксид кремния (IV), с водой непосредственно не взаимодействуют. 2 Взаимодействие оксидов с кислотами Все основные оксиды реагируют с кислотами, образуя соль и воду: 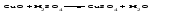  3 Взаимодействие оксидов со щелочами Кислотные оксиды реагируют со щелочами, образуя соль и воду: 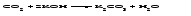 Иногда такие реакции протекают при комнатной температуре очень медленно, например, в случае оксида кремния (IV). Очень медленно идут реакции кислотных оксидов с малорастворимыми основаниями. 4 Взаимодействие основных оксидов с кислотными Основные оксиды взаимодействуют с кислотными оксидами, образуя соли:  12.4 Способы получения оксидов 1 Взаимодействие простого вещества с кислородом Во многих случаях оксиды можно получить реакцией соединения простого вещества с кислородом, протекающей, как правило, при нагревании: 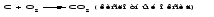 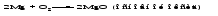 Оксиды некоторых элементов, например, хлора, нельзя получить непосредственно соединением с кислородом; такие оксиды получают косвенным путем через другие соединения этих элементов. 2 Термическое разложение кислот, оснований, солей Многие оксиды можно получить термическим разложением соответствующих кислот, оснований, а также неустойчивых при нагревании солей, например: 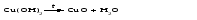   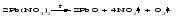 3 Взаимодействие кислоты (щелочи) с солью Когда ангидриду соответствует неустойчивая кислота или основному оксиду - неустойчивое основание, оказывается возможным получить оксид действием кислоты или щелочи на соответствующую соль. При этом оксид является продуктом разложения соответствующего неустойчивого соединения - кислоты или основания: 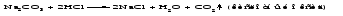 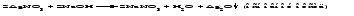 4 Окисление сложных веществ В некоторых случаях оксиды образуются при окислении кислородом сложных веществ: 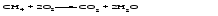  12.5 Основания. Общая характеристика, номенклатура и классификация оснований Основаниями называются соединения, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами - ОН, например NaOH, Ba(OH)2, Fe(OH)3. Особым является неорганическое соединение NH4OH (более точно его состав передается формулой NH3·хН2O). В составе этого соединения группа атомов NH4+ (катион аммония) играет такую же роль, как однозарядный катион металла. Основания классифицируют по числу гидроксогрупп в молекуле основания, по растворимости в воде и по степени диссоциации в водных растворах. Число гидроксогрупп в молекуле основания, способных заместиться на анионы кислотных остатков, называют кислотностью основания. Например, NaOH – однокислотное основание, Ва(ОН)2 – двухкислотное, Fe(OH)3 – трёхкислотное. По растворимости основания делятся на две группы: хорошо растворимые в воде и мало растворимые в воде (их условно называют нерастворимыми). По степени диссоциации в водных растворах различают сильные и слабые основания. Растворимые в воде сильные основания называются щелочами. Это гидроксиды щелочных и щелочноземельных металлов. Растворы щелочей мыльные на ощупь, разъедают кожу и ткани, поэтому их называют едкими щелочами. Растворимым, но слабым основанием является гидроксид аммония. Название основания образуется из слова гидроксид и названия металла в родительном падеже, причем для металла с переменной степенью окисления указывается степень окисления. Например, NaOH - гидроксид натрия, Fe(OH)3 - гидроксид железа(III). Для некоторых щелочей до сих пор употребляются старинные названия, такие как NaOH ‒ едкий натр, КОН ‒ едкое кали, Са(ОН)2 ‒ гашеная известь, Ва(ОН)2 ‒ едкий барит. 12.6 Физические и химические свойства оснований При комнатной температуре все основания - твердые вещества, исключение составляет только одно основание - гидроксид аммония NH4OH, который представляет собой водный раствор аммиака и в свободном виде не существует. Химические свойства оснований 1 Диссоциация оснований При диссоциации растворимых оснований образуются катионы металла (катион аммония) и гидроксид-ионы. Однокислотные растворимые основания диссоциируют в одну ступень, многокислотные основания подвергаются ступенчатой диссоциации. Под воздействием образовавшихся в ходе диссоциации гидроксид-ионов изменяется цвет индикаторов (таблица 12.2). Таблица 12.2 – Цвет индикаторов в различных средах
2 Взаимодействие оснований с кислотами Все основания взаимодействуют с кислотами, образуя соль и воду. Эта реакция является реакцией нейтрализации:  3 Взаимодействие оснований с кислотными оксидами Основания взаимодействуют с кислотными оксидами с образованием соли и воды: 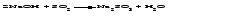 4 Взаимодействие оснований с солями Растворимые основания реагируют с растворимыми солями, образуя новое основание и новую соль, при этом один из продуктов реакции обязательно должен выделяться в виде осадка: 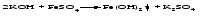  5 Разложение оснований при нагревании Нерастворимые основания при нагревании разлагаются на оксид (основной) и воду: 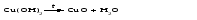 Щелочи разлагаются лишь при очень высоких температурах.
1 Взаимодействие металлов с водой Взаимодействие наиболее активных (щелочных и щелочноземельных) металлов с водой с образованием щелочи и выделением водорода:   2 Взаимодействие оксидов металлов с водой Взаимодействие оксидов щелочных и щелочноземельных металлов с водой; в результате взаимодействия образуется щелочь: 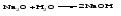 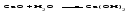 3 Взаимодействие оснований с солями Действие растворимого основания на соль с образованием нерастворимого основания: 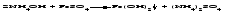 4 Электролиз водных растворов солей щелочных металлов (чаще всего хлоридов) с образованием соответствующих щелочей. Лекция 13 Вопросы
Кислотами называются соединения, которые состоят из атомов водорода, способных замещаться атомами металла, а также атомов или групп атомов, называемых кислотными остатками. Кислоты классифицируют по составу, по числу атомов водорода, способных замещаться металлом, и по степени диссоциации в водных растворах. По составу кислоты делятся на кислородные (кислородсодержащие, оксокислоты) (HNO3, Н2СО3, Н3РО4), и бескислородные (HF, HC1, H2S). Число атомов водорода, содержащихся в молекуле кислоты и способных замещаться металлом, определяет основность кислоты. В зависимости от основности кислоты могут быть одноосновные (НСl, HNO3), двухосновные (H2S, H2CO3), трехосновные (Н3РО4). Основность кислоты может не совпадать с числом атомов водорода в ее молекуле, так как не все атомы водорода способны замещаться металлом. Так, в молекуле уксусной кислоты СН3СООН только один атом водорода может замещаться металлом, поэтому уксусная кислота одноосновная, фосфористая кислота Н3РО3 двухосновная (только два атома водорода замещаются металлом), а фосфорноватистая Н3РO2 одноосновная (замещается металлом только один атом водорода, соединенный с фосфором через кислород). Это становится понятным из структурных формул соответствующих кислот:  По степени диссоциации в водных растворах различают сильные (серная, хлороводородная, бромоводородная, йодоводородная, азотная, хлорная) и слабые кислоты (фосфорная, уксусная, угольная,сероводородная, сернистая, синильная и др.). Названия бескислородных кислот составляют из названия элемента, образовавшего кислоту, с добавлением слов – водородная кислота, например: НСl – хлороводородная кислота, H2S ‒ сероводородная кислота. Название кислородсодержащей кислоты производят от названия образующего ее элемента, причем, если данный элемент образует несколько кислот, в которых проявляет разные степени окисления, то в названиях этих кислот используют разные суффиксы. В том случае, если элемент может иметь в кислоте только две степени окисления, то в названии кислоты, соответствующей высшей степени окисления элемента, используется суффикс «-н» (или «-ов», «-ев»): H2SO4 – серная, H3AsO4 – мышьяковая, H2SiO3 – кремниевая. В названии кислоты, в которой элемент имеет низшую степень окисления, используется суффикс «-ист»: H2SO3 – сернистая, H3AsO3 – мышьяковистая. В том случае, если элемент в кислородсодержащих кислотах может иметь более двух степеней окисления, в названиях кислот используются суффиксы «-н», «-ов», «-оват», «-ист», «-оватист» по мере понижения степени окисления элемента: HClO4 – хлорная, HClO3 – хлорноватая, HClO2 – хлористая, HClO – хлорноватистая. Для некоторых кислот употребляют также исторически сложившиеся названия, не связанные с какой-либо строгой системой, например: HCN – синильная кислота, НСl – соляная кислота, HF – плавиковая кислота. Если одному оксиду соответствует несколько кислородсодержащих кислот (степень окисления элемента в оксиде и соответствующей ему кислоте одна и та же), содержащих разное количество воды, то перед названием кислоты, в которой количество воды наибольшее, ставится приставка орто-, а перед названием кислоты с наименьшим количеством воды – приставка мета-. Перед названиями кислот, полученных путем частичного обезвоживания ортокислот, ставят приставку пиро-. Например, Н3РО4 – ортофосфорная (или просто фосфорная) кислота, НРО3 – метафосфорная, Н4Р2О7 – пирофосфорная. Последнюю кислоту получают путем частичного обезвоживания ортофосфорной кислоты: 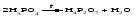 Названия наиболее часто встречающихся на практике кислот и соответствующих кислотных остатков приведены в таблице 13.1. | |||||||||||||||||||||||||||||||||||||||||||||||||||
