КОНСПЕКТ ЛЕКЦИЙ ОБЩАЯ ХИМИЯ печать. Конспект лекций Могилев 2012 удк 54 ббк 24
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Тема 5. Ионно-молекулярные реакции Лекция 7 Вопросы 7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты 7.2 Равновесие в растворах электролитов. Степень диссоциации. Константа диссоциации
7.1 Понятие электролитической диссоциации. Истинные и потенциальные электролиты Известно, что водные растворы солей, кислот и щелочей, например поваренной соли, соляной кислоты, едкого натра, хорошо проводят электрический ток, в то время как водные растворы некоторых веществ, например, глюкозы, практически не проводят электрического тока. Вещества, расплавы или растворы которых проводят электрический ток, называют электролитами. Особенности поведения подобных растворов объяснила теория электролитической диссоциации С. Аррениуса. Согласно этой теории электролиты в расплаве или в водном растворе подвергаются ионизации (электролитической диссоциации), т. е. распадаются на положительно и отрицательно заряженные частицы – ионы. Положительно заряженные ионы называются катионами, так как под действием электрического поля они движутся к катоду, а отрицательно заряженные ионы – анионами, так как под действием электрического поля они движутся к аноду. Электролиты можно разделить на две группы: истинные и потенциальные. Истинные электролиты – это вещества, имеющие ионную кристаллическую решетку. К истинным электролитам относятся соли, а также гидроксиды щелочных металлов. Роль воды при растворении истинного электролита, например, хлорида калия, заключается в следующем. Поскольку в кристаллической решетке уже имеются заряженные частицы, то на поверхности кристалла будет иметь место взаимодействие между этими заряженными частицами и полярными молекулами воды (рисунок 7.1). Это взаимодействие ослабит связь между ионами в решетке и будет способствовать их переходу в раствор в виде гидратированных ионов. При растворении хлорида калия в раствор будут переходить катионы К+ и анионы Сl-, причем молекулы воды будут притягиваться к ионам К+ отрицательными концами, а к ионам Сl- – положительными. Таким образом, вокруг каждого из ионов возникает гидратная оболочка из молекул воды. С энергетической точки зрения процесс растворения кристалла хлорида калия с образованием гидратированных ионов К+ и Сl- можно представить состоящим из двух процессов: 1) превращение кристалла в свободные ионы К+ и Сl-; 2) гидратация этих ионов. Первый процесс требует затраты энергии на разрушение кристаллической решетки. Второй процесс сопровождается выделением энергии. Большинство солей имеет прочные кристаллические решетки, поэтому затрата энергии на разрушение кристаллической решетки соли с образованием ионов обычно превышает энергетический выигрыш, получаемый за счет их гидратации. Вследствие этого многие соли растворяются в воде эндотермически. 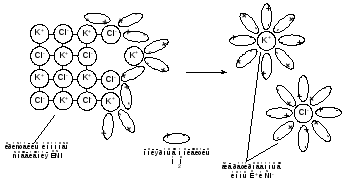 Рисунок 7.1 – Растворение истинного электролита Потенциальные электролиты – это вещества, имеющие молекулярную структуру, однако их молекулы содержат сильнополярные ковалентные связи. К потенциальным электролитам относятся, например, многие кислоты (НСl, H2SO4). Так, электропроводимость безводной серной кислоты мала, что указывает на незна чительную диссоциацию. Напротив, водные растворы серной кислоты хорошо проводят электрический ток, что свидетельствует о значительной диссоциации серной кислоты на ионы. Под действием электрического поля, создаваемого прибли зившимися к ним молекулами воды, молекулы этих веществ поляризуются еще сильнее, и в итоге распадаются на ионы, которые при этом гидратируются (рисунок 7.2). Таким образом, потенциальные электролиты образуют ионы лишь под действием полярных молекул воды.  Рисунок 7.2 – Растворение потенциального электролита Диссоциация растворяющегося вещества будет протекать тем легче, чем более полярны молекулы как самого растворяемого вещества, так и растворителя. Так, НСl (более полярная молекула) диссоциирует в водном растворе в гораздо большей степени, нежели Н2S (менее полярная молекула). Этиловый спирт – менее полярный растворитель, чем вода, поэтому ионизация растворенных веществ в нем происходит в более слабой степени, чем в водных растворах. Таким образом, электролитическая диссоциация – это процесс распада (диссоциации) электролита на ионы под действием полярных молекул воды за счет ион-дипольного и диполь-дипольного взаимодействия с растворяемым веществом. В результате образуются гидратированные ионы, хаотически движущиеся в растворе электролита. Под действием внешнего постоянного электрического поля, приложенного к раствору электролита, на хаотическое движение ионов накладывается постоянная составляющая, направление которой определяется направлением электрического поля. За счет этого происходит направленный перенос зарядов через раствор – это и есть протекание через раствор электрического тока.
Электролитическая диссоциация – равновесный процесс: одновременно с ионизацией в растворе и расплаве электролита имеет место и обратный процесс – моляризация, т. е. соединение ионов в молекулы. В результате в растворе или в расплаве практически любого электролита находятся в равновесии его диссоциированная и недиссоциированная формы. Состояние равновесия при диссоциации зависит от природы растворенного вещества и растворителя, концентрации растворенного вещества и от температуры. Для количественной характеристики равновесия процесса ионизации было введено понятие степени диссоциации. Степень диссоциации (α) –это отношение числа диссоциированных молекул к общему числу молекул электролита в растворе, выражаемое либо в долях единицы, либо в процентах. Значения степени диссоциации некоторых электролитов в 0,1 М растворе при температуре 25 °С представлены в таблице 7.1. Таблица 7.1 – Степень диссоциации некоторых электролитов
* Относительно малая величина α связана с тем, что по второй ступени в 0,1 М растворе Н2SO4 диссоциирована не полностью. ** Приведенные значения α относятся к первой ступени диссоциации. По степени диссоциации электролиты условно делят на сильные и слабые, иногда дополнительно выделяя электролиты средней силы, а также очень слабые. В связи с условностью такого деления в разных пособиях можно встретить разные границы для отнесения электролитов к числу сильных и слабых. Условимся считать сильными электролиты, которые в разбавленных растворах находятся преимущественно в виде ионов, а слабыми – такие, которые в разбавленных растворах находятся преимущественно в виде молекул. Тогда электролитами средней силы можно считать такие, у которых в этих условиях ионизация происходит в значительной степени, но концентрация неионизованной формы все же выше, а очень слабыми – те, у которых концентрация ионов ничтожно мала по сравнению с концентрацией молекул. Например, в растворе концентрацией 0,1 моль/л для перечисленных ниже электролитов составляет: НС1 и HNO3 – 93 %, это дает основание считать их сильными электролитами, Н3РО4 (24%) – электролитом средней силы, СН3СООН и NН4ОН (1,3 %) – слабыми электролитами, а НСN – очень слабым электролитом. В водных растворах сильными электролитами являются почти все соли (истинные электролиты), а также кислоты: серная, соляная, бромо- и иодоводородная, азотная, хлорная, марганцовая (потенциальные электролиты). Гидроксиды щелочных и щелочноземельных металлов также относятся к сильным электролитам. Вода, такие кислоты, как угольная, сероводородная, уксусная, кремниевая, борная, циановодородная, а также гидроксид аммония, малорастворимые основания и амфотерные гидроксиды относятся к слабым электролитам. Степень электролитической диссоциации зависит от природы электролита и растворителя и от концентрации раствора. Более универсальной характеристикой электролита является его константа диссоциации. Константа диссоциации (К)– это константа равновесия процесса диссоциации, которая зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации. Для процесса диссоциации некоторого электролита 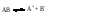 константа диссоциации будет иметь следующий вид: 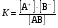 (1) (1)Вместо константы диссоциации часто используют рК – показатель константы диссоциации. 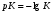 (2) (2)Так, для уксусной кислоты К = 1,8·10-5, рК = – lg(1,8·10-5) = 4,74.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Каждой ступени диссоциации соответствует своя константа диссоциации. Например, для диссоциации фосфорной кислоты: 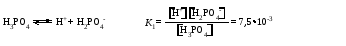 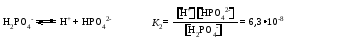  Уменьшение константы от первой ступени к третьей связано с тем, что оторвать протон становится все труднее по мере того, как растет отрицательный заряд у образующейся частицы. Константа полной диссоциации равна произведению констант, соответствующих отдельным стадиям диссоциации. Например, в случае фосфорной кислоты для процесса: 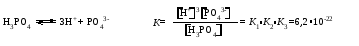 Для оценки степени диссоциации слабых электролитов достаточно учитывать лишь первую ступень диссоциации – ею, в первую очередь, определяется концентрация ионов в растворе. Кислые и основные соли также диссоциируют ступенчато, например: 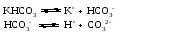 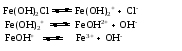  Нетрудно заметить, что диссоциация гидроаниона или гидроксокатиона идентична второй или третьей ступени диссоциации соответствующих кислоты или основания и потому подчиняется тем же закономерностям, которые были сформулированы для ступенчатой диссоциации кислот и оснований. В частности, если основная соль соответствует слабому основанию, а кислая соль – слабой кислоте, то диссоциация гидроаниона или гидроксокатиона (т.е. вторая или третья ступень диссоциации соли) протекает в незначительной степени. Во всякой кислородсодержащей кислоте и во всяком основании (имеются в виду кислоты и основания в традиционном понимании) имеются гидроксогруппы. Разница между кислотой и основанием заключается в том, что в первом случае диссоциация происходит по связи ЭО—Н, а во втором – по связи Э—ОН. Амфотерные гидроксиды диссоциируют и как основания, и как кислоты (и те и другие очень слабые). Так, ионизацию гидроксида цинка можно представить следующей схемой (без учета гидратации образующихся ионов): 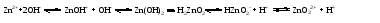 Прибавление кислоты смещает эти равновесия влево, а прибавление щелочи – вправо. Поэтому в кислой среде преобладает диссоциация по типу основания, а в щелочной – по типу кислоты. В обоих случаях связывание в молекулы воды ионов, образующихся при диссоциации малорастворимого амфотерного электролита, вызывает переход в раствор новых порций таких ионов, их связывание, переход в раствор новых ионов и т. д. Следовательно, растворение такого электролита происходит как в растворе кислоты, так и в растворе щелочи. Лекция 8 Вопросы 8.1 Ионные реакции 8.2 Ионное произведение воды. Водородный показатель
8.1 Ионные реакции Реакции между электролитами в растворе – это реакции между ионами, или ионные реакции. Пусть смешаны разбавленные растворы электролитов АВ и СD(для простоты примем, что оба электролита диссоциируют с образованием однозарядных ионов). В результате диссоциации электролитов в растворе будут находиться 4 вида ионов: А+, В-, С+ и D-, которые могут соединиться в другой комбинации, если между ними возможна реакция обмена: 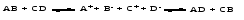 Будет ли это равновесие смещено вправо, т. е. пойдет ли реально реакция обмена, зависит от характера потенциальных продуктов реакции. Реакция обмена между электролитами в растворе возможна, т. е. практически необратима, если один из продуктов уходит из сферы реакции: выпадает в осадок, выделяется в виде газа или является малодиссоциированным соединением. Ионные реакции записываются с помощью ионно-молекулярных уравнений (полных и сокращенных). При этом слабые электролиты, практически нерастворимые вещества, неэлектролиты (простые вещества, оксиды, газообразные вещества) необходимо записывать в молекулярной, а сильные электролиты – в ионной форме. При составлении ионно-молекулярных уравнений следует помнить, что алгебраическая сумма зарядов ионов, на которые диссоциируют электролиты, равна нулю, что следует из электронейтральности как отдельных веществ, участвующих в ионной реакции, так и системы в целом. Рассмотрим примеры ионных реакций в растворах электролитов. 1. Реакцию между водными растворами нитрата серебра и хлорида калия можно записать следующим образом:  Представив сильные электролиты в ионной форме, а нерастворимое вещество – в молекулярной форме, получим: 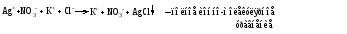 Поскольку состояние ионов К+ и NО32- после реакции мало отличается от их состояния до реакции, можно приближенно считать, что эти ионы не принимают участия в реакции. Сократив их в приведенном выше уравнении, рассматриваемую реакцию можно записать следующим образом: 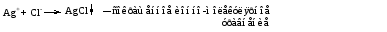 Последнее уравнение хорошо отражает сущность реакции, которая сводится к взаимодействию ионов серебра и хлора, образующих АgСl, независимо от того, какие именно растворимые соли, содержащие эти ионы, были взяты для проведения реакции. В этом случае реакция обмена имеет место, потому что образуется практически нерастворимый хлорид серебра, который выпадает в осадок. 2. В реакции 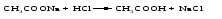 уксусная кислота ‒ слабый электролит, потому ее необходимо записать в молекулярной форме, в то время как все другие вещества ‒ соляная кислота и обе соли ‒ сильные электролиты, которые следует представить в ионной форме. Полное ионно-молекулярное уравнение будет иметь вид 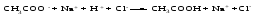 Сокращенное ионно-молекулярное уравнение 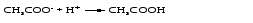 показывает, что реакция обмена имеет место, так как образуется слабый электролит ‒ уксусная кислота. 3. Хорошо знакомая из лабораторной практики реакция получения углекислого газа 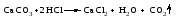 также представляет собой реакцию обмена, в которой СаСО3 ‒ малорастворимое вещество, Н2О ‒ слабый электролит, а СO2 ‒ газообразное вещество, которое не является электролитом. Полное ионно-молекулярное уравнение имеет вид  Сокращенное ионно-молекулярное уравнение 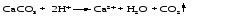 передает сущность реакции: углекислый газ можно получать действием кислот на карбонаты. Реакция практически необратима, так как СО2 удаляется в виде газа из реакционной системы. 4. Наконец, рассмотрим случай, когда смешиваются растворы КNО3 и NаСl. В этом случае образуется смесь четырех видов ионов (К+, NО32-, Nа+ и Сl-), которую с равным правом можно считать раствором КNО3 и NаС1 или КС1 и NаNО3, т.е. реакция обмена не происходит.
Вода – очень слабый электролит, диссоциирующий по схеме: 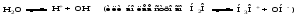 Выражение для константы диссоциации воды 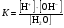 (1) (1)можно представить в другой форме: 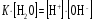 (2) (2)Так как диссоциирована лишь ничтожная доля молекул воды, то равновесную концентрацию недиссоциированных молекул, равную 55,5 моль/л, можно считать постоянной. Произведение двух постоянных величин K·[Н2О] можно представить в виде одной константы: 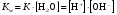 (3) (3)Константа Кw, равная произведению концентраций ионов Н+ и OH–, величина постоянная при данной температуре, получила название ионное произведение воды. Постоянство Кwтребует, чтобы изменение концентрации одного из ионов, на которые диссоциирует вода, компенсировалось изменением концентрации другого иона в противоположную сторону. На основании этого, зная концентрацию ионов Н+ в каком-то растворе, легко вычислить концентрацию ионов OH– и, наоборот, зная концентрацию ионов OH–, легко вычислить концентрацию Н+: 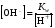 (4) (4)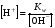 (5) (5)Отсюда следует, что для характеристики кислотности раствора (кислый, нейтральный, щелочной) достаточно указать концентрацию ионов водорода. В чистой воде при температуре 25 °С концентрации ионов водорода и гидроксид-ионов равны и составляют 10-7 моль/л. Растворы, в которых концентрации ионов водорода и гидроксид-ионов равны, называются нейтральными. В кислых растворах концентрация ионов Н+ выше, чем ионов OH–, а в щелочных ‒ концентрация ионов Н+ ниже концентрации OH–. Поскольку концентрация ионов водорода выражается числом 10 в отрицательной степени и оперировать такой малой величиной неудобно, то для характеристики кислотности растворов был введен водородный показатель рН, представляющий собой десятичный логарифм концентрации ионов водорода с обратным знаком: (6) Очевидно, что для чистой воды при комнатной температуре рН = 7. В кислой среде рН < 7, а в щелочной рН > 7. Зная водородный показатель, легко определить при необходимости и гидроксильный показатель рОН. Если 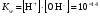 , то , то Точное значение рН растворов можно определять с помощью специальных приборов – рН-метров. Для приблизительного определения рН служат кислотно-основные индикаторы, которые представляют собой слабые органические кислоты (фенолфталеин) или основания (метилоранж). Действие кислотно-основных индикаторов основано на том, что диссоциированная и недиссоциированная формы индикатора имеют разную окраску. Например, фенолфталеин в недиссоциированной форме – бесцветный, а в анионной форме – малиновый. В зависимости от окраски молекулярной и ионной форм индикаторы могут быть двухцветными (имеют окраску обе формы), например, метилоранж, лакмус, или одноцветными (одна из форм бесцветна), например, фенолфталеин. При высокой концентрации ионов водорода, т.е. в кислой среде, равновесие диссоциации индикатора смещено влево, т.е. его диссоциация подавляется, причем в тем большей степени, чем меньше сила кислоты, являющейся индикатором. Для каждого индикатора существует определенный интервал изменения окраски, в этом интервале концентрации ионизованной и неионизованной форм соизмеримы, и окраска индикатора меняется в зависимости от рН раствора. За пределами этого интервала окраска индикатора остается практически постоянной вне зависимости от рН раствора. Существуют универсальные индикаторы, представляющие собой смесь нескольких индикаторов, каждый из которых меняет цвет в своей области рН, поэтому цвет универсального индикатора в целом изменяется в гораздо большем интервале рН. 8.3 Буферные растворы В лабораторной практике и ряде технологических процессов встречается необходимость проведения работы в растворах, способных сохранять рН практически постоянным, не изменяющимся при разбавлении раствора или при добавлении к нему некоторых количеств сильных кислот и оснований. В таких случаях пользуются так называемыми буферными растворами. Буферные растворы – это растворы, при внесении в которые малых количеств кислоты или щелочи значение рН раствора не изменяется. Наиболее часто применяемые буферные растворы содержат:
Меняя соотношение между компонентами такого раствора, можно получать разные значения рН. Буферные растворы кислот имеют рН меньше 7, буферные растворы оснований – больше 7 (таблица 8.1). Действие буферных растворов основано на том, что входящие в них компоненты связывают Н+-ионы кислот или OH–-ионы оснований, вводимых в раствор или образующихся в растворе при протекании реакции. Таблица 8.1 – Компоненты и рабочая область pH для некоторых практически важных буферных растворов
Например, если к ацетатной буферной смеси добавить сильную кислоту в малых количествах), то Н+-ионы добавляемой кислоты будут соединяться с СН3СОО- -ионами соли в малодиссоциированные молекулы соли с СН3СООН, а концентрация Н+-ионов в растворе увеличиваться не будет. При добавлении (в малых количествах) щелочи, добавляемые OH–-ионы будут связывать Н+-ионы буферной кислоты в малодиссоциированные молекулы воды, но концентрация протонов водорода сразу восстановится вследствие смещения равновесия диссоциации уксусной кислоты в сторону увеличения диссоциации кислоты. Таким образом, рН среды в обоих случаях остается практически неизменным. Количество молей сильной кислоты или щелочи, добавление которых к 1 л буферной смеси изменяет значение рН на единицу, называется буферной емкостью. Емкость буферного раствора возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве. Лекция 9 Вопросы 9.1 Гидролиз. Степень гидролиза. Константа гидролиза 9.2 Гидролиз солей, соответствующих сильному основанию и слабой кислоте 9.3 Гидролиз солей, соответствующих слабому основанию и сильной кислоте 9.4 Гидролиз солей, соответствующих слабому основанию и слабой кислоте 9.1 Гидролиз. Степень гидролиза. Константа гидролиза В общем случае гидролизом называется разложение какого-либо вещества под действием воды. Рассмотрим частный случай гидролиза – гидролиз солей. Так, если гидролизуется соль, состоящая из катиона А и аниона В (для простоты примем их однозарядными), то имеет место обратимая реакция:  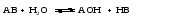 В результате гидролиза солей образуется либо кислота (кислая соль) и основание, либо основание (основная соль) и кислота. Следовательно, процесс гидролиза соли можно рассматривать как процесс, обратный реакции нейтрализации. Так как реакции нейтрализации обычно идут практически до конца (практически необратимо), то равновесие реакции гидролиза смещено в сторону реагирующих веществ. Концентрация продуктов гидролиза соли, как правило, мала. Гидролизу могут подвергаться только те соли, ионы которых способны связывать Н+ или ОН--ионы воды в малодиссоциированные соединения, т.е. соли, образованные слабыми кислотами и (или) слабыми основаниями. Соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются. Количественно процесс гидролиза можно характеризовать степенью гидролиза и константой гидролиза. Степень гидролиза соли (h) – отношение количества соли, подвергшейся гидролизу, к общему количеству соли в растворе. Степень гидролиза может быть выражена в долях от единицы или в процентах 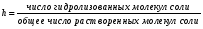 (1) (1)Основные факторы, влияющие на степень гидролиза соли – природа соли, концентрация соли, температура, добавление кислоты, щелочи или других солей. Влияние природы соли на степень ее гидролиза определяется тем, что чем более слабым электролитом (основанием или кислотой) образована данная соль, тем в большей степени она подвержена гидролизу. По мере уменьшения концентрации соли ее гидролиз усиливается, так как гидролиз соли лимитирован ничтожным количеством H+ и OH–-ионов, образующихся при диссоциации воды. Чем больше ионов воды приходится на долю ионов соли, тем полнее идет гидролиз. С увеличением температуры диссоциация воды несколько возрастает, что благоприятствует протеканию гидролиза. Влияние добавления в раствор соли кислоты, основания или другой соли можно определить исходя из принципа Ле-Шателье. В том случае, когда добавляемые электролиты связывают продукты гидролиза соли, гидролиз соли усиливается. Если же добавляемый электролит увеличивает концентрацию продуктов гидролиза или связывает исходные вещества, то гидролиз соли уменьшается. Например: 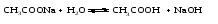 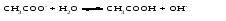 Прибавление к этому раствору щелочи, т.е. ионов OH– или другой соли, образованной слабой кислотой и сильным основанием, смещает равновесие гидролиза в сторону реагирующих веществ, а добавление кислоты, т.е. ионов H+ или соли, образованной сильной кислотой и слабым основанием, смещает равновесие гидролиза в сторону продуктов реакции. Константа гидролиза соли (Кh) – это константа равновесия процесса гидролиза соли.Константа гидролиза – это величина постоянная для данной соли при данной температуре. Рассмотрим три типичных случая гидролиза солей.
Гидролиз таких солей может быть выражен следующими уравнениями: 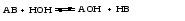 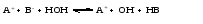 или сокращенно: 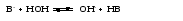 Так как кислота НВ слабая и поэтому мало диссоциирована, в растворе в результате гидролиза соли появляется избыток ионов ОН-, и раствор приобретает щелочную реакцию (рН > 7). В этом случае константа гидролиза равна 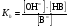 (2) (2)или 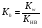 (3) (3)Таким образом, Кh обратно пропорциональна KHB, т. е., чем слабее кислота, соответствующая данной соли, тем больше константа гидролиза. Примерами солей, образованных сильным основанием и слабой кислотой, могут служить Nа2СО3, СН3СОONa, К2S, KCN. Гидролиз ацетата натрия CH3COONa В водном растворе:  Ионы СН3СОО- и H+ связываются, образуя слабую малодиссоциированную уксусную кислоту и вызывая смещение равновесия диссоциации воды вправо, в сторону увеличения концентрации OH-. Уравнение реакции гидролиза ацетата натрия: 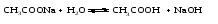 в ионной форме: 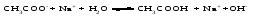 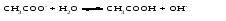 Гидролиз фосфата калия K3PO4 Эта соль образована сильным основанием и трехосновной слабой кислотой. Гидролиз солей, образованных многоосновными слабыми кислотами, проходит ступенчато: I ступень: 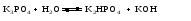 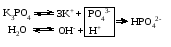 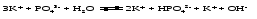 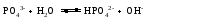 II ступень: 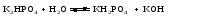 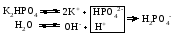  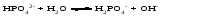 III ступень: 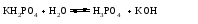 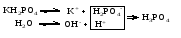 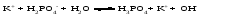 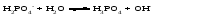 Наиболее полно гидролиз протекает по I ступени и практически не протекает по второй и третьей. Так как равновесие реакции гидролиза сильно смещено в сторону реагирующих веществ, то в растворе при обычных условиях обнаруживаются лишь продукты гидролиза по I ступени. Лишь при условиях, особо благоприятствующих гидролизу, можно обнаружить продукты II и III ступеней гидролиза.
Гидролиз таких солей можно записать следующими уравнениями: 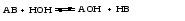 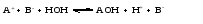 или в сокращенной ионно-молекулярной форме: 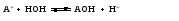 Так как основание АОН ‒ слабое и, следовательно, мало диссоциировано, в растворе в результате гидролиза солей, соответствующих слабому основанию и сильной кислоте, появляется избыток ионов Н+, и раствор приобретает кислую реакцию (рН < 7) 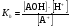 (4) (4)или 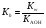 (5) (5)Таким образом, в этом случае Kh обратно пропорциональна KАОН, т.е., чем слабее основание, соответствующее данной соли, тем больше константа гидролиза. Примерами солей, образованных слабым основанием и сильной кислотой, могут служить NH4Cl, Al2(SO4)3, Cu(NO3)2. Гидролиз нитрата аммония NH4NO3 Нитрат аммония диссоциирует на ионы NO3– и ионы NH4+. Ионы NH4+ связывают ионы OH– воды, вызывая смещение равновесия диссоциации воды в сторону увеличения концентрации H+-ионов в растворе. 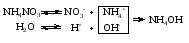 Уравнение гидролиза в молекулярной форме: 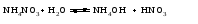 В ионной форме: 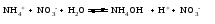  Гидролиз сульфата цинка ZnSO4 Сульфат цинка образован сильной кислотой и слабым двухкислотным основанием. Гидролиз этой соли может протекать по 2 ступеням, хотя при обычных условиях практически ограничивается лишь I ступенью. I ступень:  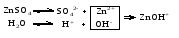 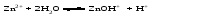 II ступень: 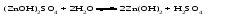 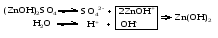 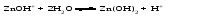
Подобные соли легче других подвергаются гидролизу, так как ионы этих солей одновременно связываются обоими ионами воды с образованием двух слабых электролитов. В результате гидролиза таких солей образуются два слабых электролита, а реакция среды зависит от соотношения силы этих электролитов. Уравнения гидролиза имеют вид: 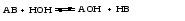 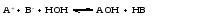 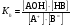 (6) (6)Запишем значение константы гидролиза соли, выразив ее через значения констант диссоциации соответствующих слабых электролитов ‒ основания и кислоты: 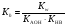 (7) (7)В этом случае константа гидролиза обратно пропорциональна произведению констант диссоциации обоих слабых электролитов, и, очевидно, чем слабее каждый из электролитов, тем больше константа гидролиза данной соли, образованной этими электролитами. Гидролиз таких солей не зависит от концентрации соли в растворе и проходит намного глубже, чем в предыдущих двух случаях. Примерами солей, соответствующих слабому основанию и слабой кислоте, могут служить (NH4)2S, (NH4)2CO3, СН3СОONH4. Несмотря на то, что гидролиз таких солей протекает намного глубже, чем в случае солей, соответствующих одному слабому электролиту, реакция среды раствора может быть даже нейтральной, если оба электролита (основание и кислота) являются электролитами приблизительно одинаковой силы. Гидролиз ацетата аммония CH3COONH4 Соль CH3COONH4 образована слабым основанием NH4OH и слабой кислотой CH3COOH одинаковой силы. Кдис.NH4OH =1.8∙10-5; Кдис.CH3COOH =1.8∙10-5. Реакция гидролиза в молекулярной форме: 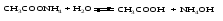 в ионно-молекулярной форме: 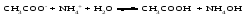 Поскольку концентрация ацетат-ионов и ионов аммония в растворе одинаковы, а константы диссоциации кислоты и основания равны, то реакция среды будет нейтральной (рН=7). В результате реакции гидролиза цианида аммония NH4CN (Кдис.HCN =7.2∙10-10; Кдис.NH4OH =1.8∙10-5) 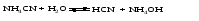 среда будет слабощелочной (рН>7). |
