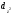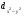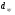КОНСПЕКТ ЛЕКЦИЙ ОБЩАЯ ХИМИЯ печать. Конспект лекций Могилев 2012 удк 54 ббк 24
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Периодическая система химических элементов Д. И. Менделеева Периодическая система химических элементов (таблица Менделеева) является графическим выражением Периодического закона. Периодическая система состоит из семи периодов, расположенных в таблице горизонтально, и восьми групп, расположенных вертикально. Период – это горизонтальный ряд элементов, начинающийся (за исключением 1-го периода) щелочным металлом и заканчивающийся инертным (благородным) газом. 1-й период содержит 2 элемента, 2-й и 3-й периоды – по 8 элементов. Первый, второй и третий периоды называются малыми (короткими) периодами. 4-й и 5-й периоды содержат по 18 элементов, 6-й период – 32 элемента, 7-й период содержит элементы с 87-го и далее, вплоть до последнего из известных на настоящее время элементов. Четвертый, пятый, шестой и седьмой периоды называются большими (длинными) периодами. Группа – это вертикальный ряд элементов. Каждая группапериодической системы состоит из двух подгрупп: главной подгруппы (А) и побочной подгруппы (В). Главная подгруппасодержит элементы малых и больших периодов (металлы и неметаллы). Побочная подгруппасодержит элементы только больших периодов (только металлы). Например, главную подгруппу I группы составляют элементы литий, натрий, калий, рубидий, цезий и франций, а побочную подгруппу I группы составляют элементы медь, серебро и золото. Главную подгруппу VIII группы образуют инертные газы, а побочную подгруппу – металлы железо, кобальт, никель, рутений, родий, палладий, осмий, иридий, платина, хасий и мейтнерий. Свойства простых веществ и соединений элементов изменяются монотонно в каждом периоде и скачкообразнона границах периодов. Такой характер изменения свойств составляет смысл периодической зависимости. В периодахслева направо неметаллические свойства элементов монотонно усиливаются, а металлические – ослабевают. Например, во втором периоде: литий – очень активный металл, берилий – металл, образующий амфотерный оксид и соответственно амфотерный гидроксид, В, С, N, О – типичные неметаллы, фтор – самый активный неметалл, неон – инертный газ. Таким образом, на границах периода свойства изменяются скачкообразно: период начинается щелочным металлом, а заканчивается инертным газом. В периодахслева направо кислотные свойства оксидов элементов и их гидратов усиливаются, а основные – ослабевают. Например, в третьем периоде оксиды натрия и магния – основные оксиды, оксид алюминия – амфотерный, а оксиды кремния, фосфора, серы и хлора – кислотные оксиды. Гидроксид натрия – сильное основание (щелочь), гидроксид магния – слабое нерастворимое основание, гидроксид алюминия – нерастворимый амфотерный гидроксид, кремниевая кислота – очень слабая кислота, фосфорная – кислота средней силы, серная – сильная кислота, хлорная – самая сильная кислота из этого ряда. В главных подгруппахсверху вниз металлические свойства элементов усиливаются, а неметаллические – ослабевают. Например, в подгруппе 4А: углерод и кремний – неметаллы, германий, олово, свинец – металлы, причем олово, свинец – более типичные металлы, чем германий. В подгруппе 1А все элементы – металлы, но по химическим свойствам также можно проследить усиление металлических свойств от лития к цезию и францию. В результате металлические свойства в наибольшей степени выражены у цезия и франция, а неметаллические – у фтора. В главных подгруппахсверху вниз основные свойства оксидов и их гидратов усиливаются, а кислотные – ослабевают. Например, в подгруппе 3А: В2О3 – кислотный оксид, а Т12О3 – основный. Их гидраты: Н3ВО3 – кислота, а Т1(ОН)3 – основание.
Открытие периодического закона стало предпосылкой к созданию в XX в. теории строения атома. В 1911 г. английский физик Э. Резерфорд предложил ядерную модель атома, согласно которой атом состоит из сравнительно небольшого положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и расположенных вокруг ядра электронов, составляющих электронную оболочку атома, которая занимает практически весь его объем. Были определены масса покоя и заряд электрона. Атом в целом электронейтрален, поскольку положительный заряд ядракомпенсируется отрицательным зарядом эквивалентного числа электронов. Позже, в 1913 г. английский физик Г. Мозли установил, что заряд ядра численно равен порядковому номеру элемента в периодической системе. Таким образом, заряд ядра атома – главная характеристика химического элемента. Химический элемент – это множество атомов с одинаковым зарядом ядра. Отсюда следует современная формулировка периодического закона: свойства элементов, а также свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядер их атомов. В четырех местах Периодической таблицы элементы «нарушают» строгий порядок расположения по возрастанию атомной массы. Это пары элементов: 18Ar(39,948) – 19K (39,098); 27Co(58,933) – 28Ni(58,69); 52Te(127,60) – 53I(126,904); 90Th(232,038) – 91Pa(231,0359). Во времена Д.И. Менделеева подобные отступления считались недостатками Периодической системы. Теория строения атома расставила все на свои места. В соответствии с величинами заряда ядра эти элементы были размещены Менделеевым в системе правильно. Таким образом, нарушив в этих случаях принцип размещения элементов в порядке возрастания атомных масс и руководствуясь физическими и химическими свойствами элементов, Менделеев фактически использовал более фундаментальную характеристику элемента – его порядковый номер в системе, который оказался равным заряду ядра. Классическая механика не могла объяснить многие экспериментальные факты, касающиеся поведения электрона в атоме. Так, согласно представлениям классической теории электродинамики система, состоящая из заряда, вращающегося вокруг другого заряда, должна излучать энергию, в результате чего электрон в конце концов упал бы на ядро. Возникла необходимость создания иной теории, описывающей поведение объектов микромира, для описания которых недостаточна классическая механика Ньютона. Основные законы такой теории были сформулированы в 1923 – 1927 гг. и она получила название квантовой механики. Квантовая механика базируется на трех основных положениях.
Так, двойственная природа электрона проявляется в том, что он обладает свойствами и частицы, и волны одновременно. Как частица электрон имеет массу и заряд, но движение электронов – это волновой процесс. Например, электронам свойственно явление дифракции (поток электронов огибает препятствие).
В 1900 г. М. Планк привлек для их объяснения квантовую гипотезу, согласно которой энергия может излучаться или поглощаться лишь определенными порциями – квантами. В 1913 г. Н. Бор применил квантовую теорию для объяснения спектра атомарного водорода, предположив, что электроны в атомах могут находиться только на некоторых «дозволенных» орбитах, отвечающих определенным значениям энергии. Бор предположил также, что, находясь на этих орбитах, электрон не излучает энергии. Поэтому, пока электроны в атоме не совершают переходов с одной орбиты на другую, энергия атома остается постоянной. При переходе же электрона с одной орбиты на другую происходит излучение кванта лучистой энергии, величина которого равна разности энергии, соответствующей этим орбитам.
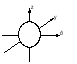
Электрон, который движется с очень большой скоростью, может находиться в любой части пространства вокруг ядра. Согласно представлениям квантовой механики, вероятность пребывания электрона в различных областях пространства неодинакова. Различные моментальные положения электрона образуют так называемое электронное облакоснеравномерной плотностью отрицательного заряда (рисунок 1.1.). 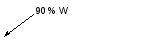  Рисунок 1.1 – Электронное облако атома водорода Форма и размеры электронного облака могут быть разными в зависимости от энергии электрона. Существует понятие «орбиталь», под которым понимают совокупность положений электрона в атоме. Каждую орбиталь можно описать соответствующей волновой функцией – атомной орбиталью, зависящей от трех целочисленных параметров, называемых квантовыми числами.
1.Главное квантовое число (п) характеризует энергетический уровень и принимает целочисленные значения от 1 до ∞, которые соответствуют номеру энергетического уровня. Иногда используют буквенные обозначения главного квантового числа, т.е. каждое численное значение п обозначают соответствующей буквой латинского алфавита:
Главное квантовое число определяет энергию электрона и размер электронного облака, т.е. среднее расстояние электрона от ядра. Чем больше п, тем выше энергия электрона, следовательно, минимальная энергия соответствует первому уровню (п = 1). В Периодической системе элементов максимальному значению главного квантового числа соответствует номер периода. 2.Орбитальное или побочное квантовое число (l)характеризует энергетический подуровень и определяет форму электронного облака; принимает целочисленные значения от 0 до (п –1). Его значения обычно обозначаются буквами:
Число возможных значений lсоответствует числу возможных подуровней на данном уровне, равному номеру уровня (п).
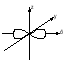
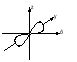
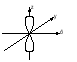
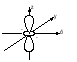
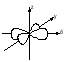
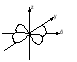
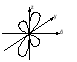
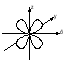
Энергия электронов на разных подуровнях одного уровня изменяется в зависимости от lследующим образом: каждому значению lсоответствует определенная форма электронного облака: s – сфера, р –объемная восьмерка, d и f – объемная четырехлепестковая розетка или более сложная форма (рисунок 1.2).
Рисунок 1.2, лист 1 – Электронные облака s-, p- и d-атомных орбиталей
Рисунок 1.2, лист 2 – Электронные облака s-, p- и d-атомных орбиталей 3. Магнитное квантовое число (ml) характеризует ориентацию электронного облака в магнитном поле; принимает целочисленные значения от –l до +l: ml = –l, ..., 0, ..., +l (всего 2l + 1 значений). При l = 0 (s-электрон) ml может принимать только одно значение (для сферического электронного облака возможна только одна ориентация в пространстве). При l = 1 (р-электрон) т1может принимать 3 значения (возможны три ориентации электронного облака в пространстве). При l = 2 (d-электрон) возможны 5 значений ml; (разные ориентации в пространстве при несколько изменяющейся форме электронного облака). При l = 3 (f-электрон) возможны 7 значенийml (ориентация и форма электронных облаков не сильно отличается от той, что наблюдается у d-электронов). Электроны, имеющие одинаковые значения п, lи ml, находятся на одной орбитали. Таким образом, орбиталь – это состояние электрона, характеризующееся определенным набором трех квантовых чисел: п, l и ml, определяющих размер, форму и ориентацию электронного облака. Число значений, которое может принимать ml, при данном значении l, равно числу орбиталей на данном подуровне. 4. Спиновое квантовое число (тs)характеризует собственный момент количества движения (спин) электрона (не связанный с движением вокруг ядра), который в виде нестрогой модели можно считать соответствующим направлению вращения электрона вокруг своей оси. Может принимать два значения: –1/2 и +1/2, соответствующие двум противоположным направлениям магнитного момента. Электроны, имеющие одинаковые значения главного, орбитального и магнитного квантовых чисел и отличающиеся только значениями спинового квантового числа, находятся на одной орбитали и образуют одно общее электронное облако. Такие два электрона, имеющие противоположные спины и находящиеся на одной орбитали, называют спаренными. Один электрон на орбитали является неспаренным. Таким образом, состояние электрона в атоме определяется набором значений четырех квантовых чисел. Лекция 2 Вопросы
Последовательность заполнения электронами подуровней в многоэлектронных атомах определяется принципом минимума энергии, принципом Паули и правилом Хунда. Принцип минимума энергии: заполнение электронами атомных орбиталей (AO) происходит в порядке возрастания их энергии. В устойчивом состоянии электроны находятся на наиболее низких энергетических уровнях и подуровнях. Это означает, что каждый новый электрон попадает в атоме на самый низкий (по энергии) свободный подуровень. Охарактеризуем уровни, подуровни и орбитали по запасу энергии электронов. Для многоэлектронного атома энергия орбиталей на уровнях и подуровнях изменяется следующим образом: 1s < 2s < 2р < 3s < 3р < 4s < 3d < 4р < 5s <4d < 5р < 6s < 5d (4f) < 6р < 7s < 6d (5f) < 7р Для сложных атомов действует правило (п+l)или правило Клечковского: энергия АО возрастает в соответствии с увеличением суммы (п+l) главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у АО с меньшим значением главного квантового числа. Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Каждая орбиталь – это энергетическое состояние, которое характеризуется значениями трех квантовых чисел: п, lи ml Эти числа определяют размер, форму и ориентацию орбитали в пространстве. Следовательно, на одной орбитали может быть не более двух электронов и различаться они будут значением четвертого (спинового) квантового числа: тs= +1/2 или –1/2 (таблица 2.1) Например, для 1s-орбитали существует два набора квантовых чисел:
Следовательно, здесь может находиться только два электрона с различными значениями спинового числа. Для каждой из трех 2p- орбиталей также возможно только два набора квантовых чисел:
Значит, на р-подуровне может находиться только шесть электронов. Наибольшее число электронов на энергетическом уровне равно: 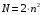 , ,где п –номер уровня, или главное квантовое число. Следовательно, на первом энергетическом уровне может находиться не более двух электронов, на втором – не более 8, на третьем – не более 18, на четвертом – не более 32 (таблица 2.1). Таблица 2.1 – Формирование электронной оболочки атома
Правило Хунда: при формировании электронного подуровня электроны заполняют максимальное число свободных орбиталей так, чтобы число неспаренных электронов было наибольшим.
Распределение электронов по различным атомным орбиталям называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состояниюатома, остальные конфигурации относятся к возбужденным состояниям. Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронографических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например, для основного состояния атома водорода электронная формула: 1s1. Более полно строение электронных уровней можно описать с помощью электронографических диаграмм, где распределение электронов по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны обозначают стрелками в зависимости от знака спинового квантового числа. Электронографическая диаграмма атома водорода:
Принцип построения электронных конфигураций многоэлектронных атомов состоит в добавлении протонов и электронов к атому водорода. Распределение электронов по энергетическим уровням и подуровням подчиняется рассмотренным ранее правилам. С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s-элементы, р-элементы, d-элементы, f-элементы. Элементы, в атомах которых последними заполняются s-орбитали, называются s-элементами. Элементы, в атомах которых последними заполняются p-орбитали, называются p-элементами. Элементы, в атомах которых последними заполняются d-орбитали, называются d-элементами. Элементы, в атомах которых последними заполняются f-орбитали, называются f-элементами. В атоме гелия Не (Z = 2) второй электрон занимает l s-орбиталь, его электронная формула: 1s2. Электронографическая диаграмма:
Гелием заканчивается первый самый короткий период Периодической системы элементов. Электронную конфигурацию гелия обозначают [Не]. Второй период открывает литий Li (Z = 3), его электронная формула: [Не] 2s1. Электронографическая диаграмма:
После лития следует бериллий Be (Z = 4), в котором дополнительный электрон заселяет 2s-орбиталь. Электронная формула Be: [He] 2s2
В основном состоянии следующий электрон бора В (Z = 5) занимает 2р-орбиталь, В: ls22s22p1; его электронографическая диаграмма:
Следующие пять элементов имеют электронные конфигурации:
Приведенные электронные конфигурации определяются правилом Хунда. Первый и второй энергетические уровни неона полностью заполнены. Обозначим его электронную конфигурацию [Ne] и будем использовать в дальнейшем для краткости записи электронных формул атомов элементов. Натрий Na (Z = 11) и Mg (Z = 12) открывают третий период. Внешние электроны занимают 3s-орбиталь:
Затем, начиная с алюминия (Z = 13), заполняется 3p-подуровень. Третий период заканчивается аргоном Ar (Z= 18):
Элементы третьего периода отличаются от элементов второго тем, что у них имеются свободные 3d-орбитали, которые могут участвовать в образовании химической связи. Это объясняет проявляемые элементами валентные состояния. В четвертом периоде, в соответствии с правилом (п + l), у калия К (Z = 19) и кальция Са (Z = 20) электроны занимают 4s–подуровень, а не 3d.Начиная со скандия Sc (Z = 21) и кончая цинком Zn (Z = 30), происходит заполнение 3d-подуровня: Sc: [Ar] 4s23d1 → Zn: [Ar] 4s23d10 Электронные формулы d-элементов можно представить в ином виде: подуровни перечисляются в порядке возрастания главного квантового числа, а при постоянном п – в порядке увеличения орбитального квантового числа. Например, для Zn такая запись будет выглядеть так: [Ar] 3d10 4s2. Обе эти записи эквивалентны, но приведенные ранее электронная формула цинка правильно отражает порядок заполнения подуровней. В ряду 3d-элементов у хрома Cr (Z = 24) наблюдается отклонение от правила (п + l). В соответствии с этим правилом электронная конфигурация Сг должна выглядеть так: [Аг] 3d44s2. Установлено, что его реальная конфигурация – [Ar] 3d54s1. Иногда этот эффект называют «провалом» электрона. Отклонения от правила (п + l) наблюдаются и у других элементов (таблица 2.2). Это связано с тем, что с увеличением главного квантового числа различия между энергиями подуровней уменьшаются. Далее происходит заполнение 4р-подуровня (Ga – Кг). В четвертом периоде содержится всего 18 элементов. Аналогично происходит заполнение 5s-, 4d-и 5р-подуровней у 18-ти элементов пятого периода. Отметим, что энергии 5s-и 4d-подуровней очень близки, и электрон с 5s-подуровня может легко переходить на 4d-подуровень. На 5s-подуровне у Nb, Mo, Tc, Ru, Rh, Ag находится только один электрон. В основном состоянии 5s-подуровень Pd не заполнен. Наблюдается «провал» двух электронов. Таблица 2.2 – Электронная конфигурация элементов с отклонением от правила Клечковского
В шестом периоде после заполнения 6s-подуровня у цезия Cs (Z = 55) и бария Ва (Z = 56) следующий электрон, согласно правилу (п + l), должен занять 4f-подуровень. Однако у лантана La (Z = 57) электрон поступает на 5d-подуро-вень. Заполненный наполовину (4f7) 4f-подуровень обладает повышенной устойчивостью, поэтому у гадолиния Gd (Z = 64), следующего за европием Eu (Z = 63), на 4f-подуровне сохраняется прежнее количество электронов (7), а новый электрон поступает на 5d-подуровень, нарушая правило (п + l). У тербия Tb (Z = 65) очередной электрон занимает 4f-подуровень и происходит переход электрона с 5d-подуровня (конфигурация 4f96s2). Заполнение 4f-подуровня заканчивается у иттербия Yb (Z = 70). Следующий электрон атома лютеция Lu занимает 5d-подуровень. Его электронная конфигурация отличается от конфигурации атома лантана только полностью заполненным 4f-подуровнем. В настоящее время в Периодической системе элементов Д.И. Менделеева под скандием Sc и иттрием Y располагают иногда лютеций (а не лантан) как первый d-элемент, а все 14 элементов перед ним, включая лантан, выносят в особую группу лантаноидовза пределы Периодической системы элементов. Химические свойства элементов определяются, главным образом, структурой внешних электронных уровней. Изменение числа электронов на третьем снаружи 4f-подуровне слабо отражается на химических свойствах элементов. Поэтому все 4f-элементы схожи по своим свойствам. Затем в шестом периоде происходит заполнение 5d-подуровня (Hf – Hg) и 6р-подуровня (Tl – Rn). В седьмом периоде 7s-подуровень заполняется у франция Fr (Z = 87) и радия Ra (Z = 88). У актиния наблюдается отклонение от правила (п + l), и очередной электрон заселяет 6d-подуровень, а не 5f. Далее следует группа элементов (Th – No) с заполняющимся 5f-подуровнем, которые образуют семейство актиноидов. У лоуренсия Lr (Z = 103) новый электрон поступает на 6d-подуровень. Этот элемент иногда помещают в Периодической системе под лютецием. Седьмой период не завершен. Элементы, начиная с 104, неустойчивы и их свойства мало известны. Таким образом, с ростом заряда ядра периодически повторяются сходные электронные структуры внешних уровней. В связи с этим следует ожидать и периодического изменения различных свойств элементов.
Структура электронной оболочки атома и положение элемента в периодической системе связаны между собой. Зная положение элемента в периодической системе, можно определить структуру электронной оболочки атома любого элемента. Порядковый номер элементав периодической системе показывает заряд ядра его атома и число электронов в атоме. Номер периодасоответствует числу энергетических уровней в электронной оболочке атомов всех элементов данного периода. При этом номер периода совпадает со значением главного квантового числа внешнего энергетического уровня. Номер группысоответствует, как правило, числу валентных электронов в атомах элементов данной группы. Валентные электроны– это электроны последних энергетических уровней. Валентные электроны имеют максимальную энергию и участвуют в образовании химической связи между атомами в молекулах. В атомах элементов главных подгрупп (А) все валентные электроны находятся на последнемэнергетическом уровне и их число равно номеру группы. В атомах элементов побочных подгрупп (В) на последнем энергетическом уровне находится не более двухэлектронов, остальные валентные электроны находятся на предпоследнемэнергетическом уровне. Общее число валентных электронов также, как правило, равно номеру группы. Изложенное показывает, что по мере роста заряда ядра происходит закономерная периодическая повторяемость сходных электронных структур элементов, а следовательно, и повторяемость их свойств, зависящих от строения электронной оболочки атомов. Таким образом, в периодической системе с возрастанием порядкового номера элемента свойства атомов элементов, а также свойства простых и сложных веществ, образованных этими элементами, периодически повторяются, так как периодически повторяются аналогичные конфигурации валентных электронов в атомах.В этом состоит физический смысл периодического закона. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||