|
|
КОНСПЕКТ ЛЕКЦИЙ ОБЩАЯ ХИМИЯ печать. Конспект лекций Могилев 2012 удк 54 ббк 24

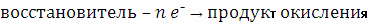 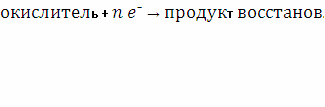   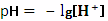 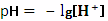     Министерство образования Республики Беларусь Министерство образования Республики Беларусь
Учреждение образования
«Могилевский государственный университет продовольствия»
Кафедра химической технологии высокомолекулярных соединений
ХИМИЯ
ОБЩАЯ ХИМИЯ
Конспект лекций
Могилев 2012
УДК 54
ББК 24
Х46
Рецензенты: кандидат технических наук, доцент УО «МГУП» Н.В. Абрамович; ведущий товаровед ЧУП «Могилевская межрайбаза» Т.И. Загурская
Рекомендовано кафедрой химической технологии высокомолекулярных соединений УО «МГУП»
Утверждено научно-методическим советом УО «МГУП»
Составители:
Н.В. Картель
Е.Н. Степурко
Химия. Общая химия : конспект лекций / сост. Н.В. Картель, Е.Н.
Х46 Степурко. – Могилев : УО «МГУП», 2012. – 96 с.
ISBN 978-985-6979-53-1.
Конспект лекций подготовлен в соответствии с учебными программами дисциплин «Химия» для студентов специальности 1 – 25 01 09, «Общая и органическая химия» для студентов специальности 1 – 27 01 01. Содержит раздел «Общая химия».
УДК 54
ББК 24
ISBN 978-985-6979-53-1
|
© Картель Н.В., Степурко Е.Н.,
составление, 2012
© Учреждение образования
«Могилевский государственный
университет продовольствия», 2012
|
Содержание
Тема 1. Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева . . . . . . . . . . . . . . . . . . . . . . . . .
Лекция 1 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Открытие Периодического закона . . . . . . . . . . . . . . . . . . . . . . . . . .
Периодическая система химических элементов Д.И. Менделеева . . . . . .
Строение атома. Современная формулировка Периодического закона . . .
Квантово-механическое описание состояния электрона в атоме . . . . . . .
|
5
5
5
6
8
10
|
Лекция 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Формирование электронной оболочки атома . . . . . . . . . . . . . . . . . . .
Электронные конфигурации атомов . . . . . . . . . . . . . . . . . . . . . . . . .
Электронная конфигурация атома и периодическая система . . . . . . . . .
|
11
12
13
17
|
Тема 2. Химическая связь . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Лекция 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Общие представления о химической связи. Первые теории химической связи . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Квантово-механическая теория химической связи . . . . . . . . . . . . . . . .
Основные характеристики и свойства химической связи . . . . . . . . . . .
|
18
18
18
19
21
|
Лекция 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4.1 Типы химических связей и их свойства . . . . . . . . . . . . . . . . . . . . . .
|
23
23
|
Тема 3. Химические реакции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Лекция 5 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.1 Понятие химической реакции. Признаки классификации химических реакций . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.2 Классификация химических реакций в зависимости от механизма
реакции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.3 Классификация химических реакций по признаку изменения числа
исходных и конечных веществ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.4 Классификация химических реакций по признаку изменения степеней окисления элементов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.5 Классификация химических реакций по признаку выделения или
поглощения энергии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5.6 Классификация химических реакций по признаку обратимости . . . . . . .
|
30
30
31
31
33
34
35
36
|
Тема 4. Основные положения химической кинетики . . . . . . . . . . . . . . . . .
Лекция 6 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
6.1 Понятие скорости химической реакции . . . . . . . . . . . . . . . . . . . . . .
6.2 Факторы, влияющие на скорость химической реакции . . . . . . . . . . . . .
6.3 Химическое равновесие . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
6.4 Смещение химического равновесия. Принцип Ле-Шателье . . . . . . . . . .
|
37
37
37
38
44
46
|
Тема 5. Ионно-молекулярные реакции . . . . . . . . . . . . . . . . . . . . . . . . . .
Лекция 7 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Понятие электролитической диссоциации. Истинные и потенциальные электролиты . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Равновесие в растворах электролитов. Степень диссоциации. Константа диссоциации . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Ступенчатая диссоциация электролитов . . . . . . . . . . . . . . . . . . . . . .
|
48
48
48
51
52
|
Лекция 8 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Ионные реакции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Ионное произведение воды. Водородный показатель . . . . . . . . . . . . . .
Буферные растворы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
|
54
54
56
57
|
Лекция 9 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Гидролиз. Степень гидролиза. Константа гидролиза . . . . . . . . . . . . . .
Гидролиз солей, соответствующих сильному основанию и слабой кислоте . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Гидролиз солей, соответствующих слабому основанию и сильной кислоте . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Гидролиз солей, соответствующих слабому основанию и слабой кислоте
|
59
59
60
62
63
|
Тема 6. Окислительно-восстановительные реакции . . . . . . . . . . . . . . . . .
Лекция 10 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Понятие окислительно-восстановительной реакции . . . . . . . . . . . . . .
Типы окислительно-восстановительных реакций . . . . . . . . . . . . . . .
Составление уравнений окислительно-восстановительных реакций
методом электронного баланса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Составление уравнений окислительно-восстановительных реакций
методом полуреакций . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
|
64
64
65
66
67
68
|
Лекция 11 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Типичные окислители и восстановители . . . . . . . . . . . . . . . . . . . . .
Поведение в окислительно-восстановительных реакциях типичных окислителей и восстановителей . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
|
70
70
71
|
Тема 7. Основные классы неорганических соединений . . . . . . . . . . . . . . .
Лекция 12 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Основные классы неорганических соединений . . . . . . . . . . . . . . . . .
Оксиды. Общая характеристика, номенклатура и классификация оксидов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Физические и химические свойства оксидов . . . . . . . . . . . . . . . . . .
Способы получения оксидов . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
12.5 Основания. Общая характеристика, номенклатура и классификация оснований . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Физические и химические свойства оснований . . . . . . . . . . . . . . . . .
12.7 Способы получения оснований . . . . . . . . . . . . . . . . . . . . . . . . . . .
|
75
75
76
76
77
78
79
80
81
|
Лекция 13 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Кислоты. Общая характеристика, номенклатура и классификация кислот . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Физические и химические свойства кислот . . . . . . . . . . . . . . . . . . .
Способы получения кислот . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Амфотерные оксиды и гидроксиды . . . . . . . . . . . . . . . . . . . . . . . .
|
81
82
83
85
86
|
Лекция 14 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Соли. Общая характеристика, номенклатура и классификация солей . . .
Физические и химические свойства средних солей . . . . . . . . . . . . . .
Способы получения средних солей . . . . . . . . . . . . . . . . . . . . . . . .
Физические и химические свойства кислых и основных солей . . . . . . .
Способы получения кислых и основных солей . . . . . . . . . . . . . . . . .
|
88
88
90
92
92
94
|
Список использованных источников . . . . . . . . . . . . . . . . . . . . . . . .
|
95
|
Тема 1. Строение атома. Периодический закон и периодическая
система химических элементов Д. И. Менделеева
Лекция 1
Вопросы
Открытие Периодического закона
Периодическая система химических элементов Д.И. Менделеева
Строение атома. Современная формулировка Периодического закона
Квантово-механическое описание состояния электрона в атоме
Открытие Периодического закона
Одной из важнейших проблем теоретической химии XIX века была проблема систематизации химических элементов, число которых постоянно росло. Со времён античности и средних веков были известны 14 элементов, в XVIII веке к ним добавилось 20 новых элементов; к 1860 году число известных элементов возросло до шестидесяти.
Важнейший вклад в систематизацию элементов внёс русский химик Дмитрий Иванович Менделеев. Д.И.Менделеев смог найти объективную основу для классификации элементов – единственную достаточно достоверно известную тогда характеристику элемента – атомную массу (по терминологии того времени «атомный вес»).
Расположив известные в то время 63 элемента в порядке возрастания их атомных масс, Менделеев обратил внимание на то, что в таком ряду через определенное число элементов их свойства периодически повторяются. Так, в рядах элементов
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
Na
|
Mg
|
Al
|
Si
|
P
|
S
|
Cl
|
K
|
Ca
|
|
|
|
|
|
обнаруживалось сходство между элементами. Расположив столбцами группы элементов, обнаруживающие сходство друг с другом, учитывая при этом не только физические и химические свойства соответствующих простых веществ, но также формулы их оксидов, гидридов и других соединений, Менделеев получил таблицу, выражающую периодичность изменения свойств элементов и их соединений – периодическую таблицу, в которой каждый элемент занимает определенное место.
В 1871 году Д.И. Менделеев обнаружил фундаментальный закон природы, который теперь известен как Периодический закон. Согласно первоначальной формулировке этого закона, свойства элементов, а также свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины атомных масс элементов.
До Менделеева уже были предприняты попытки систематизации химических элементов по их атомной массе. Наиболее удачные из них разработали
И. Деберейнер, Л. Гмелин, А. де Шанкуртуа, Дж. Ньюлендс, У. Одлинг и
Ю. Мейер.
Принципиальная новизна Периодического закона, открытого и сформулированного Д.И. Менделеевым, заключалась в следующем:
– устанавливалась связь между несходными по своим свойствам элементами. Эта связь заключалась в том, что свойства элементов плавно и примерно одинаково изменяются с возрастанием их атомной массы, а затем эти изменения периодически повторяются;
– в тех случаях, когда создавалось впечатление, что в последовательности изменения свойств элементов не хватает какого-нибудь звена, в Периодической таблице предусматривались пробелы, которые надо было заполнить еще не открытыми элементами.
Во всех предыдущих попытках определить взаимосвязь между элементами другие исследователи стремились создать законченную картину, в которой не было места еще не открытым элементам. Д.И. Менделеев считал важнейшей частью своей Периодической таблицы те ее клеточки, которые оставались пока пустыми. Это давало возможность предсказать существование еще неизвестных элементов.
С момента появления Периодического закона химия перестала быть описательной наукой. Закон позволил вести целенаправленный поиск новых, еще не открытых элементов. Атомные массы многих элементов, определенные до этого недостаточно точно, подверглись проверке и уточнению именно потому, что их ошибочные значения вступали в противоречие с Периодическим законом.
На основе периодического закона Менделеев смог указать в системе места для еще неизвестных тогда 12 элементов, а также описать физические и химические свойства образуемых ими простых веществ и соединений. Еще при жизни Менделеева были открыты галлий, скандий и германий, свойства которых с большой точностью совпали с предсказанием Менделеева. Также на основе периодического закона Менделеевым были исправлены атомные массы некоторых элементов, например бериллия. С 1894 по 1898 год периодическая система пополнилась инертными газами: гелий, неон, аргон, криптон и ксенон.
В настоящее время известно 118 химических элементов. Последние элементы получены в количестве всего нескольких атомов и практического значения не имеют. Тем не менее, периодическая система может быть расширена и дальше.
|
|
|
 Скачать 1.17 Mb.
Скачать 1.17 Mb.
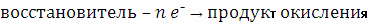
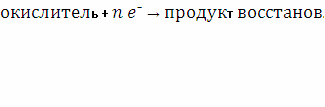


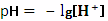
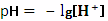

 Министерство образования Республики Беларусь
Министерство образования Республики Беларусь