Шпоры РХТУ им. Менделеева все формулы по ОНХ. химия онх. Конспект лекций, задачи и упражнения
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Решение. Для того чтобы осадок не выпадал, необходимо выполнение условия: ПК = [Ag+][Br–] ПР = 4,910–13 . Концентрация бромидных ионов в окончательном растворе известна: [Br–] = [KBr] = 10–4 моль/л. Находим критическую концентрацию ионов серебра в растворе: [Ag+] 10–4 4,910–13; [Ag+] 4,910–9 . Таким образом, задача сводится к определению концентрации избыточного аммиака, позволяющей поддерживать равновесную концентрацию ионов серебра меньше, чем 4,910–9 моль/л. Пусть искомая величина составляет Y моль/л. В соответствии с уравнением диссоциации комплексного соединения 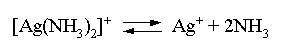 равновесные концентрации ионов составят: [Ag+] = 4,910–9; [NH3] = 24,910–9 +Y; [Ag(NH3)2]+ = 0,5 – 4,910–9 . Подставляем эти величины в выражение для константы нестойкости комплексного иона и находим нужное значение: 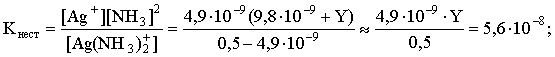 Y = 5,7. Следовательно, при концентрации аммиака, большей 5,7 моль/л, введение в 1 л 0,5 М раствора [Ag(NH3)2]Cl 0,0001 моль КBr не будет приводить к выпадению осадка бромида серебра. 5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Степенью окисления атома элемента в соединении называется условный заряд, вычисляемый по определенным правилам с учетом электроотрицательности атомов и смещения электронной плотности при образовании химической связи. В дальнейшем степень окисления атома будем указывать по системе знак-число, а заряд иона – по системе число-знак. Правила вычисления степеней окисления: 1) степень окисления атома фтора в любых соединениях всегда -1, 2) степени окисления атомов щелочных металлов в соединениях всегда +1, 3) степень окисления атома водорода в соединениях +1, а в гидридах металлов она равна -1, например: LiH, CaH2; 4) степень окисления атома кислорода обычно равна -2, кроме пероксидов (Na2O2–1), надпероксидов (KO2–1/2), озонидов (KO3–1/3) и соединений кислорода со фтором, где атомы кислорода имеют положительные степени окисления; 5) алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, а в ионе – заряду иона. Порядок "старшинства" названных правил возрастает с уменьшением указанного номера правила. Химические реакции, в которых происходит изменение степеней окисления атомов в молекулах, называются окислительно-восстановитель-ными реакциями (ОВР). Вещества, молекулы которых принимают электроны, называются окислителями. В химической реакции такие вещества восстанавливаются. Вещества, молекулы которых отдают электроны, называются восстановителями. В течение реакции такие вещества окисляются. Типичными окислителями являются: 1) вещества, молекулы которых содержат атомы элементов в высших положительных степенях окисления, например: KMn+7O4, KBi+5O3, K2Cr+62O7, Pb+4O2; 2) катионы металлов более высокого заряда (более высокой степени окисления), например: Fe3+, Au3+, Sn4+; 3) галогены и кислород (при повышенных температурах). Типичными восстановителями являются: 1) вещества, молекулы которых содержат атомы элементов в высоких отрицательных степенях окисления или степени окисления которых легко повышаются, например: Na2S–2, KI–1, N–3H3, KN+3O2, K2S+4O3; 2) катионы металлов более низкой степени окисления, например: Fe2+, Sn2+; 3) металлы, из них в первую очередь – щелочные и щелочно-земельные металлы, а также – водород при повышенных температурах. Обычно различают следующие основные типы ОВР: 1) межмолекулярные ОВР – в этих реакциях окислителем и восстановителем являются разные молекулы, например: 2KMn+7O4 + 10KI–1 + 8H2SO4 = 2Mn+2SO4 + 6K2SO4 + 5I2 + 8H2O Mn+7 + 5ē = Mn+2 | 2 (окислитель) 2I– – 2ē = I2 | 5 (восстановитель) 2O–1 + 2ē = 2O–2 | 1 (окислитель) 2I– – 2ē = I2 | 1 (восстановитель) 2) внутримолекулярные ОВР – в этих реакциях окислителем и восстановителем являются атомы различных или одинаковых элементов, находящихся в разных частях одной молекулы, например: t (N–3H4)2Cr+62O7 = N02 + Cr+32O3 + 4H2O 2N–3 – 6ē = | 1 (восстановитель) 2Cr6+ + 6ē = 2Cr3+ | 1 (окислитель) 250oC N–3H4N+5O3 = N+12O + 2H2O N+5 + 4ē = N+1 | 1 (окислитель) N–3 – 4ē = N+1 | 1 (восстановитель) 3) реакции диспропорционирования, в которых окислителем и восстановителем являются одни и те же атомы в молекуле, например: t 3Cl02 + 6KOH = 5KCl–1 + KCl+5O3 + 3H2O + ē = Cl– | 5 – 5ē = Cl+5 | 1 N+4 + ē = N+3 | 1 N+4 – ē = N+5 | 1 Рассмотрим поведение наиболее распространенных окислителей и восстановителей в ОВР. Азотная кислота, являясь окислителем, восстанавливается обычно до оксидов азота , , , или, в случае сильных восстановителей – до или иона аммония N-3H4+. Отметим, что образование N2O3 происходит редко и этот случай можно не рассматривать. Глубина восстановления N+5 из азотной кислоты одинаковой концентрации возрастает с увеличением силы восстановителя. При одном и том же восстановителе глубина ее восстановления увеличивается с уменьшением концентрации кислоты. Иллюстрируем эти закономерности на примерах взаимодействия азотной кислоты с металлами. При этом полезно помнить, что взаимодействие меди с азотной кислотой различной концентрации описывается уравнениями: Cu0 + 4HN+5O3 (конц) = Cu+2(NO3)2 + 2N+4O2 + 2H2O Cu0 – 2ē = Cu+2 | 1 N+5 + ē = N+4 | 2 3Cu0 + 8HN+5O3 (разб) = 3Cu+2(NO3)2 + 2N+2O + 4H2O Cu0 – 2ē = Cu+2 | 3 N+5 + 3ē = N+2 | 2 Разумеется, эти и последующие уравнения реакций различных веществ с азотной кислотой по составу продуктов соответствуют начальной стадии процессов, по мере их протекания и уменьшения концентрации кислоты-окислителя неизбежно меняется состав продуктов восстановления HNO3. Продукты же восстановления азотной кислоты другими металлами будут определяться положением этих металлов в ряду активности по отношению к меди или, говоря более строго, величинами стандартных электродных потенциалов. Так, например, при взаимодействии с Cu, Zn, Mg и К состав продуктов восстановления кислоты будет примерно следующим: Cu NO2 HNO3 (конц) + Zn NO (N2O) Mg N2O (N2) K N2 (NH4+) Cu NO HNO3 (разб) + Zn N2O (N2) Mg N2 (NH4+) K NH4+ С неметаллами реально взаимодействует лишь концентрированная азотная кислота, которая при этом, как правило, восстанавливается до NO2 или до NO. При этом неметалл окисляется до высшей положительной степени окисления в форме кислоты, если она устойчива, или в форме оксида, если кислота неустойчива, например: P4 H3P+5O4 HNO3 (конц) + S H2S+6O4 C C+4O2 B H3B+3O3 Окислительное действие перманганата калия в зависимости от кислотности среды описывается следующей схемой: +5ē, H+ Mn+2 (MnSO4) KMnO4 +3ē, H2O Mn+4 (MnO2) +ē, OH– Mn+6 (K2MnO4) Перманганат калия является сравнительно сильным окислителем в кислой среде, окислителем средней силы – в нейтральной среде, в щелочной среде представляет собой относительно слабый окислитель. Примеры ОВР с участием КМnO4: 2KMn+7O4 + 5KN+3O2 + 3H2SO4 = 2Mn+2SO4 + 5KN+5O3 + K2SO4 + 3H2O Mn+7 + 5ē = Mn+2 | 2 N+3 – 2ē = N+5 | 5 3KMn+7O4 + 3C–2H3OH 3HC0HO + 2Mn+4O2 + 2KOH + 2H2O Mn+7 + 3ē = Mn+4 | 2 C–2 – 2ē = C0 | 3 2KMn+7O4 + 2KI–1 2K2Mn+6O4 + I20 Mn+7 + ē = Mn+6 | 2 2I–1 – 2ē = I20 | 1 Обратим внимание, что в двух последних случаях вода и едкое кали не являются непосредственными участниками ОВР, однако они должны быть указаны над равенством, чтобы показать, в какой среде протекает химическая реакция. Отметим также, что приведенная выше схема восстановления КМnO4 отражает одновременно и наиболее стабильные в той или иной среде формы соединений. Серная кислота в разбавленном растворе является окислителем за счет ионов Н+, в концентрированном, горячем растворе (более 50 мас. % H2SO4) серная кислота представляет собой сравнительно сильный окислитель, при этом в качестве окислителя выступает S+6. В случае слабых восстановителей S+6 восстанавливается до S+4, как правило, в виде SO2, например: 2H2S+6O4 (конц) + Cu0 = Cu+2SO4 + S+4O2 + 2H2O Cu0 – 2ē = Cu+2 | 1 S+6 + 2ē = S+4 | 1 2H2S+6O4 (конц) + S0 = 3S+4O2 + 2H2O S+6 + 2ē = S+4 | 2 S0 – 4ē = S+4 | 1 2H2SO4 (конц) + 2KBr (кр) = K2SO4 + Br2 +SO2 + 2H2O S+6 + 2ē = S+4 | 1 2Br– – 2ē = Br20 | 1 При наличии сильного восстановителя восстановление S+6 идет более глубоко – до S0 или даже до Н2S–2, например: 4H2S+6O4 (конц) + 6KI–1 (кр) = S0 +3I20 + 3K2SO4 + 4H2O S+6 + 6ē = S0 | 1 2I– – 2ē = I20 | 3 5H2SO4 (конц) + Mg0 = 4Mg+2SO4 + H2S-2 + 4H2O S+6 + 8ē = S–2 | 1 Mg0 – 2ē = Mg+2 | 4 Широко распространенным и удобным окислителем является кислый раствор бихромата калия, Cr+6 в этом соединении восстанавливается до Cr+3 в форме солей: K2Cr+62O7 + 3KN+3O2 + 4H2SO4 = Cr+32(SO4)3 + 3KN+5O3 + K2SO4 + 4H2O 2Cr+6 + 6ē = 2Cr+3 | 1 N+3 – 2ē = N+5 | 3 K2Cr+62O7+3C-1H3C-1HO+4H2SO4 = Cr+32(SO4)3 + 3C0H3C0OOH+K2SO4+4H2O 2Cr+6 + 6ē = 2Cr+3 | 1 2C–1 – 2ē = 2C0 | 3 В щелочной среде бихроматы быстро переходят в хроматы в соответствии с уравнением: Cr2O72– + 2OH– = 2CrO42– + H2O, а в кислой среде, наоборот, хроматы легко переходят в бихроматы: 2CrO42– + 2H+ = Cr2O72– + H2O. Это обстоятельство следует учитывать при написании уравнений реакций с участием соединений Cr+6. Обратим внимание, что соединения Cr+6 в качестве окислителей целесообразно использовать лишь в кислой среде, в щелочной среде они представляют собой крайне слабые окислители; эти обстоятельства достаточно красноречиво иллюстрируются соответствующими величинами стандартных электродных потенциалов: Cr2O72- + 14H+ + 6ē = 2Cr+3 + 7H2O, E0 = 1,33 B CrO42- + 4H2O + 3ē = Cr(OH)3 + 5OH–, E0 = –0,13 B Поскольку в молекуле пероксида водорода атомы кислорода имеют промежуточную степень окисления (-1), то молекулы этого соединения могут быть как окислителями, так и восстановителями. Обычно в качестве окислителя используют водные растворы с концентрацией этого соединения более 10–15 мас.%, а разбавленные растворы (1–5 мас.% H2O2) – применяют в качестве восстановителя: H2O2–1 + 2KI–1 + H2SO4 = I20 +2H2O–2 + K2SO4 2O–1 + 2ē = 2O–2 | 1 2I–1 – 2ē = I20 | 1 5H2O2–1 + 2KMn+7O4 + 3H2SO4 = 2Mn+2SO4 + K2SO4 + 5O20 + 8H2O 2O–1 + 2ē = O20 | 5 Mn+7 + 5ē = Mn+2 | 2 Хлорная и бромная вода представляют собой разбавленные растворы соответствующих галогенов (растворимость Cl2 и Br2 невелика): окисляя какие-либо соединения, галогены восстанавливаются до анионов Г –1: Cl20 + 2ē = 2Cl–1 Br20 + 2ē = 2Br–1 Наиболее распространенными в лабораторной практике являются следующие восстановители: нитриты (например KN+3O2), сульфиды (K2S–2), сульфиты (K2S+4O3), иодиды (KI–1), гипофосфиты (KH2P+1O2), фосфиты (K2HP+3O3), соединения олова (II) (SnCl2), железа (II) (FeSO4), магний, алюминий, цинк. В реакциях окисления-восстановления указанные вещества окисляются, как правило, по следующим схемам: N+3O2– – 2ē N+5O3– S–2 – 2ē = S0 S+4O32– – 2ē S+6O42– 2I–1 – 2ē = I20 H2P+1O2– – 2ē H2P+3O3– или H2P+1O2– – 4ē H2P+5O4– Sn+2 – 2ē = Sn+4 Fe2+ – ē = Fe3+ Металлы окисляются до соответствующих катионов. Полезно помнить, что в случае амфотерных металлов в разбавленных водных растворах при наличии избытка щелочи формой существования соединений будут, как правило, гидроксокомплексы, например: K3[Al(OH)6], Na2[Zn(OH)4]. В неорганической химии существуют своеобразные универсальные окислитель и восстановитель – так называемые "щелочной плав" и "водород в момент выделения". Первый представляет собой композицию из кристаллического соединения, разлагающегося при нагревании с выделением кислорода (например К2O2, KNO3, KClO3 и т.п.) и щелочного компонента. "Щелочной плав" в большинстве случаев окисляет атомы элементов соответствующих соединений до высших положительных или близких к ним степеней окисления, например: 3KN+5O3 + W + 2KOH 3KN+3O2 + K2W+6O4 + H2O N+5 + 2ē = N+3 | 3 W0 – 6ē = W+6 | 1 KCl+5O3 + 3Mn+4O2 + 6KOH KCl–1 + 3K2Mn+6O4 + 3H2O Mn+4 – 2ē = Mn+6 | 3 Cl+5 + 6ē = Cl–1 | 1 Действующим началом "щелочного плава" является атомарный (молекулярный) кислород, получающийся при разложении соответствующего соединения. Реакция между кусочками металла, погруженного в минеральную кислоту, и раствором или кусочками амфотерного металла, находящегося в растворе щелочи, идет на поверхности металла. Именно там восстанавливаются протоны и образуются атомы (молекулы) водорода. Если в такой системе находится соединение, способное восстанавливаться, то оно и будет восстановлено до высшей отрицательной или близкой к ней степени окисления атома (атомов) элемента. Катионы металлов будут восстанавливаться в этих условиях до минимальной положительной степени окисления. Описанная восстановительная система и представляет собой "водород в момент выделения". Пример: 3Zn0 + 9HCl + Na3As+3O3 = As–3H3 + 3Zn+2Cl2 + 3NaCl + 3H2O Zn0 – 2ē = Zn+2 | 3 As+3 + 6ē = As–3 | 1 И "щелочной плав", и "водород в момент выделения" активно используются при проведении ОВР, первый особенно удобен при переведении металлов, не растворяющихся в обычных минеральных кислотах, в растворимые соли; второй – эффективен при получении водородных соединений неметаллов. Разумеется, не следует забывать, что абсолютным окислителем является электрический ток на аноде, а абсолютный восстановитель – электрический ток на катоде. 6. ЭКВИВАЛЕНТ, ЗАКОН ЭКВИВАЛЕНТОВ Эквивалентом называют реальную или условную частицу, соответствующую одному электрону в данной ОВР, или одному протону (одному гидроксилу, одному единичному заряду) в данной обменной реакции. Иными словами, эквивалент – это часть молекулы, приходящаяся на один электрон в данной ОВР или на один протон (один гидроксил, единичный заряд) в данной обменной реакции. Если эквивалентом является сама молекула, то тогда он представляет собой реальную частицу; если же эквивалент составляет часть молекулы (молекулу делить на части без разрушения нельзя!), то в этом случае он будет условной частицей. Обратим внимание, что понятие "эквивалент" без указания процесса (химической реакции) не имеет смысла. Фактор эквивалентности показывает, какую часть составляет эквивалент от молекулы. Эта величина меняется от нуля до единицы. Например, если азотная кислота восстанавливается в различных процессах до N+4O2, N+2O, N–3H4+, то ее фактор эквивалентности будет равен в первом случае единице, во втором – одной трети, в третьем – одной восьмой. Если ортофосфорная кислота в реакции с едким натром нейтрализуется до NaH2PO4, то фактор эквивалентности равен единице; если нейтрализация прошла до Na2HPO4, то фактор эквивалентности H3PO4 составит одну вторую; наконец, в случае полной нейтрализации кислоты до Na3PO4 ее фактор эквивалентности составит одну треть. Таким образом, фактор эквивалентности, как и сам эквивалент, зависит от процесса, в котором участвует данная молекула. При этом полезно помнить, что одноосновные кислоты и однокислотные основания в обменных реакциях имеют всегда фактор эквивалентности, равный единице. Из определения понятия "эквивалент" следует, что в ОВР nэквивалентов окислителя обязано реагировать с n эквивалентами восстановителя, при этом получится n эквивалентов вещества, до которого восстановился окислитель, и n эквивалентов вещества, до которого окислился восстановитель. Аналогично в обменной реакции типа нейтрализации m эквивалентов кислоты будут реагировать с m эквивалентами основания, в результате реакции получится m эквивалентов соли и m эквивалентов воды. Названные соотношения в сущности и выражают закон эквивалентов – число эквивалентов участников процесса есть постоянная величина. Однако эквивалент – слишком маленькая частица, и в реальных расчетах их число огромно. Поэтому аналогично тому, как от подсчета числа молекул переходят к подсчету числа молей (количества вещества), вводят понятия "моль эквивалентов" (моль экв.) и "молярная масса эквивалента " Мэкв. 1 моль экв. содержит 6,021023 эквивалентов, а его масса в граммах и будет молярной массой эквивалента. Очевидно, молярная масса эквивалента связана с молярной массой (М) соотношением: Мэкв = fэкв М. (6.1) Число молей эквивалентов каждого из участников процесса, очевидно, может быть найдено следующим образом: где mA и mB - массы веществ А и В. Закон эквивалентов приобретает теперь следующую формулировку – число молей эквивалентов участников данного процесса есть постоянная величина: nэквA = nэквB = nэквC = ... = const (6.3) Соотношения (6.1–6.3) являются достаточными для выполнения всех расчетов, связанных с понятием "эквивалент". Остановимся теперь на некоторых частных закономерностях и соотношениях. Молярная масса эквивалента бинарного соединения, то есть соединения, состоящего из атомов двух элементов, равна сумме молярных масс эквивалентов этих элементов. Из этой закономерности, в частности, вытекают следующие соотношения. Молярная масса эквивалента любого оксида (в оксиде кислород имеет степень окисления –2) в соответствии с процессом Э + Эх fэквO2 = ; MэквO2 = 32 = 8 г/(моль экв.) равна молярной массе эквивалента элемента плюс восемь. Аналогично молярная масса эквивалента любого водородного соединения в соответствии с процессом Э + Э fэквH2 = ; MэквH2 = 2 = 1 г/(моль экв.) равна молярной массе эквивалента элемента плюс один. Молярная масса эквивалента галогенида металла (или соединения галогена с неметаллом) согласно схеме Э + Э fэквГ2 = ; MэквГ2 = = АГ равна молярной массе эквивалента элемента плюс атомная масса галогена. Подобные соотношения можно легко получить и для других групп соединений. Если участники процесса находятся в растворе, то число молей эквивалентов каждого из них может быть найдено умножением нормальной концентрации вещества на объем его раствора, поскольку размерность произведения нормальности на объем (в литрах!) как раз и есть число молей эквивалентов. В результате для этого частного случая закон эквивалентов принимает форму: HAVA = HBVB = HCVC = ... const. (6.4) При использовании соотношения (6.4) для нахождения объемов растворов можно использовать любые единицы измерения; в случае применения названного соотношения для нахождения числа молей эквивалентов единицей измерения объемов могут быть только литры. Для химических расчетов с участием газов наряду с молярными массами активно используется величина 22,4 л, представляющая собой объем, который занимает 1 моль газа (строго говоря, идеального!) при нормальных условиях. Аналогично вводится величина объема 1 моль эквивалентов данного газа при н.у., которая равна: Vэкв = fэкв 22,4. (6.5) Задачи и упражнения |
