Шпоры РХТУ им. Менделеева все формулы по ОНХ. химия онх. Конспект лекций, задачи и упражнения
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
3.1. Образование растворов, растворимость Пример 1. Пользуясь справочными данными, определить давление паров над водой при 298,15 К. Решение. Равновесие испарения воды описывается соответствующей константой, численно равной давлению водяных паров (концентрация жидкой воды постоянна и равна 1!): Kравн = PH2O . Находим величину G0 указанного процесса: G0 = G0обр H2O(г) – G0 обр H2O(ж) = –228,6 – (–237,3) = 8,7 кДж . Вычисляем давление паров воды: G0 = – RTlnKравн = –RTlnPH2O; 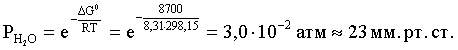 Пример 2. Пользуясь справочными данными, определить растворимость йода в воде при 298,15 К. Решение. Для равновесия константа равновесия равна: Kравн = . Определим G0 для указанного процесса: G0 = G0обр I2 (р-р, ст.с) – G0 обр I2 (к) = G0 обр I2 (р-р, ст.с) = 16 кДж . Далее: G0 = – RTlnKравн = –RTln a I2 (нас.р-р) = G0 обр I2 (р-р, ст.с) Как видно, растворимость йода в воде мала, поэтому активность можно уверенно считать равной концентрации (коэффициент активности равен единице). Таким образом, растворимость йода в воде при 298,15 К составляет 1,6·10-3 моль/л или 0,40 г/л. Пример 3. 44,8 л (н.у.) хлороводорода растворили в 300 мл воды. Определить моляльность полученного раствора и массовую долю НСl в нем. Решение. 44,8 л (н.у.) хлороводорода составляют 2 моль и имеют массу 2·36,5 = 73,0 г. Масса полученного раствора составляет (плотность воды 1,00 г/мл): 300 · 1 + 73,0 = 373,0 г. Определяем массовую долю хлороводорода в растворе: . Наконец, находим моляльность полученного раствора: 2 моль НСl – 0,30 кг Н2О Х – 1,00 кг, откуда Х = mр-ра = 6,67 моль/кг. Пример 4. Какой объем 3,00 мас.% раствора NaCl (плотность раствора 1,020 г/мл) и 12,00 мас.% раствора NaCl (плотность раствора 1,086 г/мл) необходимо смешать для приготовления 400 мл 7,50 мас.% раствора этого соединения с плотностью 1,053 г/мл? Решение. Задача сводится к составлению двух материальных балансов – масса приготовляемого раствора равна сумме масс составляющих его растворов и масса растворенного вещества в приготовляемом растворе равна сумме масс этого вещества в двух исходных растворах. Необходимо помнить, что для объемов растворов это правило не выполняется! Пусть необходимый объем 3,00 мас.% раствора составляет Х мл, а объем 12,00 мас.% раствора – Y мл. Первое уравнение: 1,020X + 1,086Y = 4001,053 = 421,2; второе уравнение: 0,031,020X + 0,121,086Y = 0,075421,2 = 31,6 Решение этой системы уравнений приводит к результату: Х = 205,4 мл, Y= 194,8мл. Пример 5. Сколько граммов кристаллогидрата Na2SO410H2O и мл воды необходимо для приготовления 400 мл 15 мас.% раствора Na2SO4 с плотностью 1,142 г/мл. Определить молярность, моляльность, титр приготовленного раствора, а также мольную долю Na2SO4 в растворе. Решение. Определим содержание Na2SO4 в приготовляемом растворе: mNa2SO4 = mр-ра 0,15 = 400 1,142 0,15 = 68,5 г . Молярная масса Na2SO4 составляет 142 г/моль, a Na2SO410H2O – 322 г/моль. Соответственно, 68,5 г Na2SO4 содержатся в 68,5322/142 = 155,3 г кристаллогидрата. Наконец, находим массу (объем) воды, необходимой для приготовления раствора: mH2O = VH2O = m р-ра – m кр-та = 400 1,142 – 155,3 = 301,5 г или 301,5 мл. Теперь решаем отдельную задачу о нахождении молярности, моляльности, титра и мольной доли соли в 15 мас.% растворе Na2SO4. Поскольку в определении молярности и титра задействованы литр и миллилитр, целесообразно отталкиваться от объема раствора, равного 1 л. Итак пусть имеется 1 л 15 мас.% раствора Na2SO4 с плотностью 1,142 г/мл. Находим массу растворенной в нем соли и переводим в моли: mNa2SO4 в 1 л р-ра = 1000 1,142 0,15 = 171,3 г Тут же легко находится титр: Т = 171,3 / 1000 = 0,1713 . Теперь определим массу воды в 1 л раствора: mH2O = 1142 - 171,3 = 970,7 г и вычисляем моляльность: . В 1 л раствора находится 1,21 моль соли и 970,7/18 = 53,9 моль воды, отсюда мольная доля соли составляет: мольная доля 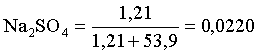 . .Пример 6. Сколько мл 20 мас.% раствора NaOH необходимо прилить к 500 мл 5 мас.% раствора того же соединения для получения 2М раствора NaOH. Плотности растворов равны соответственно 1,219; 1,054 и 1,080 г/мл. Решение. Решение задачи сводится к нахождению числа молей NaOH в приготовляемом растворе и его объема (в литрах). Пусть необходимо прилить Х мл 20 мас.% раствора. Определим число молей (количество вещества) NaOH в двух сливаемых растворах: 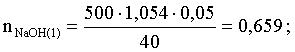 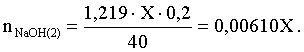 Объем окончательного раствора находим через его массу и плотность: mр-ра = mр-ра(1) + mр-ра(2) = 5001,054 + Х1,219 = 527 + 1,219Х 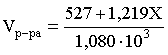 Согласно условию, число молей NaOH, отнесенное к объему раствора в литрах, равняется двум: 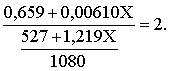 Решение этого уравнения и дает ответ – необходимо прилить 82,5 мл 20 мас.% раствора. Пример 7. Раствор имеет мольное отношение NaOH : H2O = 1 : 100. Определить концентрацию этого раствора в мас.% и его моляльность. Решение. Раствор содержит 1 моль NaOH и 100 моль Н2O, что составляет 40 г и 10018 = 1800 г соответственно. Находим моляльность: 1 моль NaOH – 1,8 кг Н2О Х – 1 кг Н2О, откуда Х = m = 0,556. Масса раствора составляет 40 + 1800 = 1840 г, а его концентрация мас.% . 3.2. Равновесие диссоциации электролитов Пример 1. Константа диссоциации муравьиной кислоты 1,7010–4. Найти концентрацию ионов водорода и степень диссоциации кислоты в ее 1 М растворе. Решение. В соответствии с уравнением диссоциации кислоты: записываем выражение для константы диссоциации: Кдис = 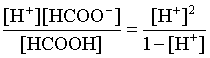 . .Концентрация ионов водорода существенно меньше единицы и ею можно пренебречь. Находим концентрацию ионов водорода: . Наконец, определяем степень диссоциации кислоты: 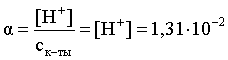 или 1,31 %. или 1,31 %.Пример 2. Степень диссоциации слабой одноосновной кислоты в 0,1 М растворе составляет 0,1 %. Найти концентрацию ионов водорода в ее 1 М растворе. Решение. Для нахождения константы диссоциации кислоты воспользуемся соотношением Кдис = 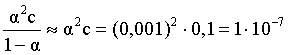 . .В соответствии с уравнением диссоциации кислоты константа диссоциации связана с концентрацией ионов водорода следующим образом: Кдис = 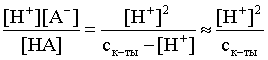 Определяем концентрацию ионов водорода в 1 М растворе: Пример 3. В 1 л 0,1 М раствора уксусной кислоты растворили 4,48 л (н.у.) хлороводорода. Как изменилась при этом степень диссоциации уксусной кислоты? Принять объем окончательного раствора равным 1 л, константа диссоциации уксусной кислоты составляет 1,7510–5. Решение. Определим степень диссоциации уксусной кислоты в исходном растворе: 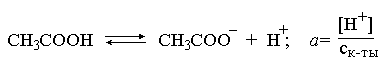 Кдис = 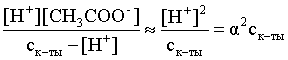  . .В соответствии с уравнением диссоциации появление в растворе сильной хлороводородной кислоты приведет к резкому смещению равновесия диссоциации уксусной кислоты влево. Пусть концентрация ионов водорода, образующихся за счет собственной диссоциации уксусной кислоты равна Х моль/л, такова же концентрация и ацетат-анионов; общая концентрация ионов водорода в растворе составит (X + 0,2) моль/л (4,48 л хлороводорода составляют 0,2 моль). Подставляем эти величины в выражение для константы диссоциации и находим X: Кдис = 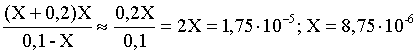 . .Определяем степень диссоциации уксусной кислоты в окончательном растворе: 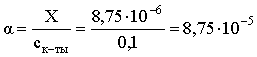 . .Таким образом, введение в раствор 0,2 моль хлороводорода привело к уменьшению степени диссоциации уксусной кислоты в: 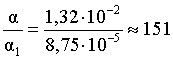 раз. раз.Пример 4. Константы ступенчатой диссоциации сероводородной кислоты составляют 9,7410–8, 1,3610–13. Найти концентрации ионов Н+, HS– и S2– в 0,01 М растворе этой кислоты. Решение. В соответствии с уравнением диссоциации H2S по первой ступени определяем концентрацию ионов Н+ и HS– : Кдис(1) = 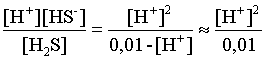 ; ;Диссоциация по второй ступени протекает в значительно меньшей степени за счет подавления ее продуктами диссоциации по первой ступени и большей трудности отрыва протона от аниона по сравнению с нейтральной молекулой. Пусть концентрация анионов серы в растворе равна Х моль/л, концентрация ионов водорода составит (X + 3,1210–5) моль/л, а концентрация ионов HS– – (3,1210–5 – X) моль/л. Подставляем эти величины в выражение для второй константы диссоциации: Кдис(2) = 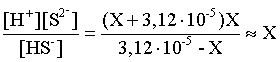 . .Таким образом, концентрация аниона серы практически равна значению второй константы диссоциации кислоты. 3.3. Шкала термодинамических функций образования ионов в водных растворах Пример 1. На основе справочных данных определить вторую константу диссоциации ортофосфорной кислоты при 298,15 К. Решение. Второй ступени диссоциации ортофосфорной кислоты соответствует процесс: Находим стандартную энергию Гиббса этого процесса: G0=G0обр H+(р-р, ст.с) + G0обр HPO42-(р-р, ст.с, гип.недис) – – G0обр H2PO4- (р-р, ст.с, гип.недис) = 0 + (–1083,2) – (–1124,3) = 41,1 кДж . Затем определяем константу диссоциации: G0 = –RTlnKравн = –RTlnKдис(2) Кдис(2) = Пример 2. Стандартная энтальпия образования NaCl (к) равна –411,1 кДж/моль, энтальпия растворения этого соединения в воде с образованием бесконечно разбавленного раствора равна 3,6 кДж/моль, а стандартная энтальпия образования аниона хлора в водном растворе составляет –167,1 кДж/моль. Определить стандартную энтальпию образования иона Na+ . Решение. Ключом к нахождению искомой величины является положение, что стандартная энтальпия образования NaCl в растворе равна сумме стандартных энтальпий образования ионов Na+ и Сl– в растворе. Первая же величина, в свою очередь, равна сумме стандартных энтальпий образования NaCl (к) и энтальпии его растворения с образованием бесконечно разбавленного раствора. Таким образом: H0обр NaCl (р-р, ст.с) = H0обр Na+ (р-р, ст.с) + H0обр Cl- (р-р, ст.с) = = H0обр NaCl (к) + H0раств; H0обр Na+ (р-р, ст.с) = H0обр NaCl (к) + H0раств – H0обр Cl- (р-р, ст.с) = = –411,1 + 3,6 – (–167,1) = –240,4 кДж/моль . Пример 3. По следующим данным: H0обр NaCl (р-р, ст.с) = –407,5 кДж/моль = H01; H0обр KCl (р-р, ст.с) = –419,4 кДж/моль = H02; H0обр NaBr (р-р, ст.с) = –361,8 кДж/моль = H03; H0обр NaI (р-р, ст.с) = –295,6 кДж/моль = H04 . определить H0обрKBr (р-р, ст.с); H0обрKI (р-р, ст.с) . Решение. Поскольку стандартные энтальпии образования электролитов в растворе тождественно равны сумме стандартных энтальпий образования составляющих их ионов, можно записать: H0обрKCl (р-р, ст.с) – H0обрNaCl (р-р, ст.с) = H0обрK+ (р-р, ст.с) + + H0обрCl– (р-р, ст.с) – H0обрNa+ (р-р, ст.с) – H0обрCl– (р-р, ст.с) = = H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с) Складываем эту величину c H0обрNaBr (p-p, ст.с) и получаем: H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с) + H0обрNaBr (р-р, ст.с) = = H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с) + H0обрNa+ (р-р, ст.с) + + H0обрBr– (р-р, ст.с) = H0обрKBr (р-р, ст.с) Находим одну из искомых величин: H0обрKBr (р-р, ст.с) = H02 – H01 + H03 = –419,4 – (–407,5) + (–361,8) = = – 373,7 кДж/моль. Аналогично определяем H0обрKI (р-р, ст.с): H0обрKCl (р-р, ст.с) – H0обрNaCl (р-р, ст.с) + H0обрNaI (р-р, ст.с) = = H0обрK+ (р-р, ст.с) – H0обрNa+ (р-р, ст.с) + H0обрNa+ (р-р, ст.с) + + H0обрI–(р-р, ст.с) = H0обрKI (р-р, ст.с) = H02 – H01 + H04 = = –419,4 – (–407,5) + (–295,6) = – 307,5 кДж/моль. |
