Шпоры РХТУ им. Менделеева все формулы по ОНХ. химия онх. Конспект лекций, задачи и упражнения
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
3.4. Равновесие растворения и диссоциации малорастворимого электролита Пример 1. Произведение растворимости Ag2S при 298,15 К составляет 6,9010-50. Определить: а) растворимость Ag2S в воде (моль/л, г/л); б) растворимость Ag2S в 0,1 М растворе AgNO3; в) растворимость Ag2S в 0,1 М растворе Na2S; г) в каком количестве воды растворяется 1 г Ag2S; д) G0 процесса растворения и диссоциации Ag2S (к). Решение: а) Пусть растворимость Ag2S в воде составляет Р моль/л. В соответствии с уравнением растворения и диссоциации 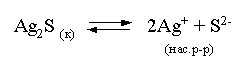 концентрации ионов составляют: [S2–] = Р , [Ag+] = 2P. Подставляем эти величины в выражение для ПР: ПР = [Ag+]2 [S2–] = (2P)2P = 4P3 = 6,9010–50 и находим величину растворимости: Р = 2,5810–17 моль/л. Для нахождения растворимости в г/л полученное значение следует умножить на молярную массу Ag2S, получим 6,4010–15 г/л. б) Теперь Ag2S растворяется в растворе, где уже есть ионы серебра с концентрацией 0,1 моль/л. Пусть растворимость Ag2S в этом случае составляет P1 моль/л. Концентрации ионов составят: [S2–] = P1; [Ag+] = 2P1 + 0,1. Подставляем эти величины в выражение для ПP: (2P1+0,1)2P1 0,01 P1 = 6,9010-50. Находим растворимость Ag2S в 0,1 М растворе AgNO3: P1 = 6,9010–48 моль/л. в) В этом случае Ag2S растворяется в растворе, где уже есть анионы серы, их концентрация составляет 0,1 моль/л. Пусть растворимость Ag2S в этом растворе составляет Р2 моль/л; концентрации ионов составят: [S2–]=P2 +0,1; [Ag+] = 2P2. Подставляем эти величины в выражение для ПР: ПР = (2P2)2 (P2+0,1) 0,4 P22 = 6,9010–50. Находим растворимость Ag2S в 0,1 М растворе Na2S: Р2 = 4,1510–25 моль/л. Как видно, в растворах с общим ионом растворимость Ag2S меньше, чем в воде – наиболее резко упала растворимость в случае раствора AgNO3. г) В пункте а) была найдена растворимость Ag2S в воде в г/л, она составила 6,4010–15. Эта величина позволяет определить, в каком объеме воды растворяется 1 г Ag2S: 6,4010–15 г – в 1л 1 г – в Х л; откуда Х = 1,561014 л. д) Поскольку величина ПР представляет собой константу равновесия, то значение G0 процесса растворения и диссоциации Ag2S легко вычисляется по известному соотношению: G0 = – RT ln ПР = –8,31298,15ln 6,9010–50 = 280,5 кДж. Пример 2. По справочным данным определить значение растворимости СаF2 при 298,15 К. Решение. Первоначально находим значение ПР для CaF2 по величине G0 процесса: G0 = G0обрСа2+ (р-р, ст.с) + 2G0обр F– (р-р, ст.с) – G0обрСаF2 (к) = = –552,8 + 2(–277,7) –(–1168,5) = 60,3 кДж. G0 = – RTlnПР = –8,31298,15 ln ПР Далее в соответствии с написанным выше уравнением растворения и диссоциации CaF2 растворимость этого соединения численно равна концентрации иона кальция, а концентрация фторидного иона в 2 раза больше растворимости: [Ca2+] = P; [F–] = 2P; ПР = [Ca2+] [F–] = P(2P)2 = 4P3 = 2,6910–11. Отсюда растворимость равна: 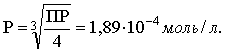 Пример 3. 0,1 г BaSO4 промыты 500 мл воды. Определить возможный процент потерь осадка вследствие растворимости, считая, что промывные воды насыщены сульфатом бария. ПР BaSO4 = 1,9510–10. Решение. Согласно уравнению: ПР BaSO4 = [Ba2+][SO42–] = PP = P2, где Р – растворимость BaSO4 в воде. Находим Р: 1,3910–5 моль/л 233,4 г/моль = 3,2610–3 г/л Соответственно, в 500 мл насыщенного раствора будет находиться 1,6310–3 г BaSO4. Отсюда возможная потеря соли вследствие растворимости осадка составит . Пример 4. Смешали 1 л 0,01 М раствора Pb(NO3)2 и З л 0,1 М раствора КI. Выпадет ли осадок РbI2, если ПРPbJ2 = З,5610–9. Считать объем окончательного раствора равным 4 л. Решение. Для ответа на вопрос задачи следует вычислить произведение концентраций ионов Рb2+ и I– в гипотетическом растворе после смешения и сравнить его с величиной ПР. В исходных растворах концентрации ионов составляли соответственно: [Pb2+] = 0,01; [I–] = 0,1 моль/л. После смешения они составят: 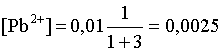 моль/л; моль/л;моль/л. Произведение концентраций ионов в полученном растворе составит ПК = [Pb2+][I–]2 = (0,0025)(0,075)2=1,4110–5. Как видно, ПК >ПР, следовательно осадок выпадет. Пример 5. Массовая доля растворенного вещества в насыщенном при 298,15 К водном растворе CdS составляет 1,1910–15. Определить ПР этого соединения, полагая, что плотность раствора равна 1 г/мл. Решение. В 1 кг раствора (1 л раствора) находится 10001,1910–15 = = 1,1910–12 г CdS, что составляет 1,1910–12 : MCdS = 8,2610–15 моль. Согласно уравнению растворения и диссоциации CdS: концентрации ионов в насыщенном растворе составят: [Cd2+] = [S2–] = = 8,2610–15 моль/л. Находим значение ПР: ПР = [Cd2+][S2–] = (8,2610–15)2 = 6,8210–29. 3.5. Равновесие диссоциации воды, буферные растворы Пример 1. Определить рН: а) 0,01М раствора HI; б) 0,01М раствора CsOH; в) 0,01М раствора СН3СООН, Кдис = 1,7510–5. Решение: a) HI в водном растворе является сильным электролитом, поэтому: [HI] = [H+] =0,01 моль/л. Отсюда рН = – lg 0,01 = 2. 6) CsOH – сильный электролит, поэтому: [CsOH] = [OH–] = 0,01 моль/л. Отсюда рОН = – lg 0,01 = 2, а рН = 14 – 2 = 12. в) CH3COOH – слабый электролит в водном растворе, уравнение диссоциации: Определим концентрацию ионов водорода: 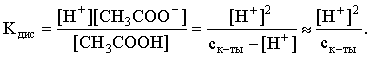 Затем находим рН раствора: pH = – lg [H+] = –lg 4,1810-4 = 3,38. Пример 2. рН 0,1 М раствора слабого однокислотного основания равен 11. Найти константу и степень диссоциации этого основания. Решение. Диссоциация слабого однокислотного основания описывается схемой: Если рН раствора равен 11, то рОН =14–11=3; отсюда [OH–]=110–3 моль/л. В соответствии с уравнением диссоциации: 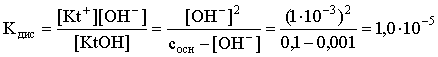 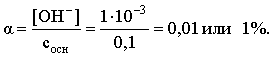 Пример З. Определить рН буферного раствора, полученного смешением 1 л 0,1 М раствора СН3СООН и 2 л 0,01 М раствора CH3COONa. Считать объем окончательного раствора равным З л. Кдис СН3СООН = 1,7510–5. Решение. В водных растворах СН3СООН и CH3COONa реализуются следующие равновесия: 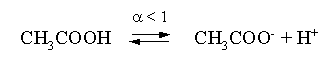 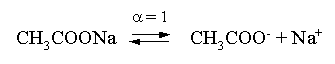 Диссоциация слабой кислоты подавлена диссоциацией соли, имеющей тот же анион, что и кислота. В силу этого: [CH3COO-] = [CH3COO-]к-ты + [CH3COO-]соли ссоли ; [CH3COOH] ск-ты . Учитывая это, запишем для Кдис кислоты и [Н+]: 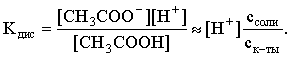 С учетом разбавления концентрации соли и кислоты составят: Находим из константы диссоциации концентрацию ионов водорода и рН раствора: 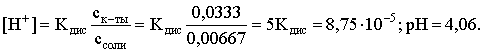 Пример 4. Какой объем 0,5 М раствора ацетата натрия следует прилить к 1 л 0,1 М раствора СН3СООН, чтобы рН полученного буферного раствора составил 5. Считать, что объем полученного раствора равен сумме объемов сливаемых растворов; Кдис СH3COOH =1,7510–5. Решение. В соответствии с формулой (3.21) для кислого буферного раствора 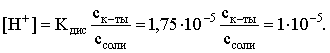 Отсюда: Пусть для получения требуемого раствора к 1 л 0,1 М раствора СН3СООН следует прибавить Х л 0,5 М раствора CH3COONa. Соответственно, тогда в буферном растворе: моль/л; моль/л. Подставляем эти величины в написанное выше соотношение: 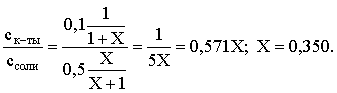 Таким образом, для получения раствора с требуемой величиной рН необходимо к 1 л 0,1 М раствора СН3СООН добавить 350 мл 0,5 М раствора CH3COONa. Пример 5. На сколько единиц изменится рН раствора слабой одноосновной кислоты при его разбавлении в 10 раз ? Решение. Константа диссоциации слабой одноосновной кислоты имеет вид (см. пример 1 этого раздела): Имея в виду равенство констант диссоциации кислоты в растворах двух концентраций, запишем: или . Логарифмируем это соотношение: 2 lg [H+]1 = 1 + 2lg [H+]2 . Делим обе части уравнения на 2 и меняем знаки: 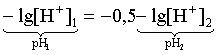 pH1 = pH2 – 0,5. Следовательно, при разбавлении раствора слабой одноосновной кислоты в 10 раз рН раствора возрастает на 0,5. Пример 6. Вычислить рН насыщенного раствора Mg(OH)2. ПР Mg(OH)2 = = 1,4710–11. Решение. В насыщенном растворе Mg(OH)2 существует равновесие: 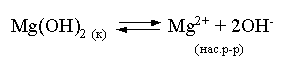 Пусть растворимость гидроксида магния в воде равна Р моль/л, тогда концентрации ионов в насыщенном растворе составят: [Mg2+] = P, [OH–] = 2P. Подставляем эти величины в выражение для ПР: ПР = [Mg2+] [OH–]2 = P(2P)2 = 4P3 = 1,4710–11. Находим рН насыщенного раствора гидроксида магния: ; [OH–] = 2P = 3,0810–4. pOH = –lg 3,0810–4 = 3,51; pH = 14 – 3,51 = 10,49. Пример 7. Определить рН, при котором начинается осаждение Fе(ОН)3 из 0,1 М раствора FeCl3. ПР Fe(OH)3 = 6,4010–40. Решение. Пусть растворимость Fe(OH)3 в 0,1 М растворе FeCl3 составляет Р моль/л. Тогда в соответствии с уравнением растворения и диссоциации Fе(ОН)3 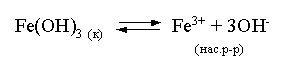 концентрации ионов в насыщенном растворе Fe(ОН)3 составят: [OH–]= 3P; [Fe3+] = 0,1 + P. Подставляем эти величины в выражение для ПР: ПР Fe(OH)3 = [Fe3+][OH–]3 = (0,1+P)(3P)3 2,7P3 = 6,4010–40; находим концентрацию ионов ОН– и рН начала выпадения Fе(ОН)3 из 0,1 М раствора FeCl3 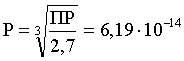 ; [OH–] = 3P = 1,8610–13. ; [OH–] = 3P = 1,8610–13.pOH = –lg 1,8610–13 = 12,7; pH = 14 – pOH = 1,3. 3.6. Гидролиз солей Пример 1. Определить рН 0,3 М раствора NH4Br, если константа диссоциации гидроксида аммония в водном растворе составляет 1,7110–5. Решение. Бромид аммония гидролизован по катиону в растворе: Согласно соотношению (3.23): 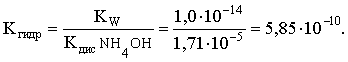 С другой стороны (соотношение 3.24): 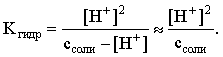 Из этих двух выражений и вычисляем рН 0,3 М раствора NH4Br: pH = – lg 1,3210–5 = 4,88 . Пример 2. Определить рН раствора и степень гидролиза соли в 0,1 М растворе Na2S, если константы ступенчатой диссоциации H2S составляют: К1=9,7410–8; К2= 1,3610–13. Решение. Сульфид натрия – соль, гидролизованная по аниону. Поскольку сероводородная кислота двухосновна, гидролиз идет по двум ступеням. Выше было показано, что для практических расчетов достаточно принимать во внимание лишь первую ступень гидролиза. В нашем случае это следующий процесс: Определяем константу гидролиза: 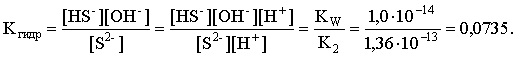 С другой стороны: 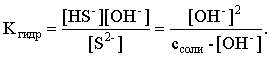 Решая полученное квадратное уравнение, находим рН раствора и степень гидролиза: [ОН–] = 0,0565 (второй корень уравнения отрицателен!) рОН = – lg 0,0565 = 1,25; рН = 14 – 1,25 = 12,75; 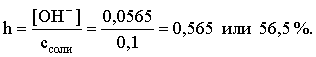 |
