Шпоры РХТУ им. Менделеева все формулы по ОНХ. химия онх. Конспект лекций, задачи и упражнения
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Пример 2. Какие вещества (молекулы, ионы) не должны существовать в водном растворе? Решение. Таковыми должны быть соединения, электродный потенциал которых для соответствующей электрохимической пары превышает потенциал разложения воды O2 + 4H+ + 4ē = 2H2O; E0 = 1,229 B. Выпишем некоторые из них: MnO4– + 8H+ + 5ē = Mn2+ + 4H2O; E0 = 1,51 B; BrO3– + 6H+ + 5ē = 0,5Br2 + 3H2O; E0 = 1,52 B; Cr2O72– + 14H+ + 6ē = 2Cr3+ + 7H2O; E0 = 1,33 B; Co3+ + ē = Co2+; E0 = 1,82 B; S2O82– + 2ē = 2SO42–; E0 = 2,01 B. Из приведенных цифр следует, что ионы MnO4–, Cr2O72–, BrO3–, S2O82– являются термодинамически неустойчивыми в водных растворах и должны окислять воду. Однако, кроме иона Со3+, остальные ионы кинетически устойчивы и реально существуют в водных растворах. Соединения же, дающие в водных растворах ион Со3+, окисляют воду. Пример 3. Оценить условия, при которых серебро будет растворяться в минеральных кислотах. Решение. Для того чтобы серебро растворялось в минеральных кислотах необходимо, чтобы процесс 2Ag + 2H+ = 2Ag+ + H2 был самопроизвольным, то есть имел G < 0 или φ > 0. Согласно соотношениям (1.27, 2.16): Ag+ + ē =Ag; 2H+ + 2ē = H2; 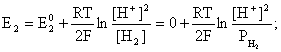 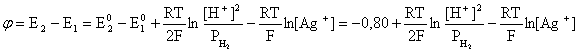 Проанализируем вопрос о том, какими должны быть величины [H+], и [Ag+] для того, чтобы выполнялось φ > 0. Пусть [Ag+] = 1, [H+] = 1, получаем: 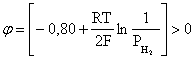 ; ;; lg < –27,1; < 7,910–28 атм. Пусть [Ag+] = 1, = 1, получаем: ; 0,059 lg [H+] > 0,80; lg [H+] > 13,6; [H+] > 4,01013 моль/л. Как видно, для осуществления указанного процесса необходимо мизерное парциальное давление водорода в системе (глубочайшее разрежение!), либо невероятно большая кислотность раствора. И то, и другое практически реализовать невозможно. Пусть = 1, [Н+] = 1, получаем: ; 0,059 lg [Ag+] < – 0,80; lg [Ag+] < – 13,6; [Ag+] < 2,510-14 моль/л. Таким образом, если в растворе поддерживать равновесную концентрацию ионов серебра на уровне, меньшем 10-14 моль/л, то процесс растворения серебра в кислоте с [Н+] = 1 при =1 станет самопроизвольным. Поддерживать столь малую концентрацию ионов серебра в растворе возможно только лишь в присутствии лигандов, образующих прочные комплексные соединения с ионами серебра. Фактически в этом случае электродный потенциал EAg+/Ag смещается из области положительных значений к отрицательным величинам. Пример 4. На примере комплексных соединений кобальта проанализировать возможность существования ионов Со2+ и Со3+ в водном растворе. Решение. Стандартный электродный потенциал для пары Со3+/Со2+ в водном растворе составляет 1,82 В, что значительно превышает потенциал разложения воды. Иными словами ион Со3+ (гидратированный!) не может существовать в водном растворе – он будет окислять воду до О2 и восстанавливаться до иона Со2+. С другой стороны, концентрационная зависимость этого потенциала выражается следующим выражением: . Из этого выражения видно, что чем меньше концентрация свободного (гидратированного!) иона Со3+ по сравнению с концентрацией иона Со2+ (гидратированного!), тем больше потенциал смещается в область отрицательных величин. Такая ситуация возникает практически всегда, когда в растворе находятся лиганды, образующие комплексы более прочные, чем аквакомплексы. Так, в аммиачных растворах [Co(NH3)6]3+ + ē = [Co(NH3)6]2+; E0=0,10 B. В цианидных же растворах потенциал смещается настолько сильно в отрицательную область, что не только Со3+ не окисляет воду, а наоборот – комплексный ион [Сo2+(CN)6]4– восстанавливает воду, окисляясь до [Сo3+(CN)6]3–: 2 [Сo2+(CN)6]4– + 2H2O = 2 [Сo3+(CN)6]3– + H2 + 2OH– . Пример 5. На основе значений следующих стандартных электродных потенциалов: Tl+ + ē= Tl; E01 = –0,34 B; Tl3+ + 2ē = Tl+; E02 = 1,25 B определить величину стандартного электродного потенциала для пары Tl3+/Tl. Решение. Уравнения окислительно-восстановительных полуреакций не являются термохимическими и поэтому не позволяют выполнять над собой алгебраические операции. Включим написанные две полуреакции и искомую Tl3+ + 3ē = Tl; E0X в реальные химические процессы, например, восстановления иона Tl3+ водородом и взаимодействия таллия с кислотой (протонами). Пусть все участники нижеследующих процессов находятся в стандартных состояниях. Тогда имеем: а) 2Tl + 2H+ = 2 Tl+ + H2 (2H+ + 2ē = H2, E0 = 0 B) G0a= –2F(0–E01) = 2FE01; б) Tl3+ + H2 = Tl+ + 2H+ G0б= –2F(E02 – 0) = –2FE02; в) 2Tl3+ + 3H2 = 2 Tl + 6H+ G0в= –6F(E0x – 0) = –6FE0x . Термохимическое уравнение "в" получается вычитанием уравнения "а" из удвоенного уравнения "б", таким образом: G0в =2G0б – G0а; –6FE0x = –4FE02 – 2FE01; 3E0x=2E02+E01; 2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ 2.1. Истинное и кажущееся равновесие, смещение равновесия Равновесным называют такое состояние системы, которое не изменяется во времени, и эта неизменность не обусловлена протеканием какого-либо внешнего процесса. Равновесие остается неизменным, пока не меняются внешние условия. Различают истинное (устойчивое) и кажущееся (кинетическое) равновесие. Истинное равновесие сохраняется неизменным не вследствие отсутствия процессов, а в силу протекания их одновременно в двух противоположных направлениях с одинаковой скоростью. Истинное равновесие имеет следующие признаки: 1. Если нет внешнего воздействия, то система неизменна во времени. 2. Система следует за любыми изменениями внешних условий, сколь угодно малыми они бы ни были, а если воздействие снято, то система возвращается в исходное состояние равновесия. 3. Состояние системы будет одинаковым независимо от того, с какой стороны она подходит к равновесию. Кажущееся равновесие также неизменно во времени при отсутствии внешнего воздействия, однако второй и третий признаки для него не характерны. Примером системы в кажущемся равновесии является пересыщенный раствор: достаточно попадания соринки в такой раствор или встряхивания – и начинается выделение из раствора избыточного растворенного вещества. Другой пример – смесь водорода и кислорода при комнатной температуре: внесение в нее зажженной спички или катализатора неизбежно ведет к взрыву. При изменении внешних условий равновесие изменяется сообразно новым условиям или, как говорят, смещается. Смещение равновесия подчиняется закономерности, называемой принципом Ле Шателье. Он гласит: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя одно из условий, определяющих состояние равновесия, то в системе усилится течение того процесса, который будет ослаблять оказываемое воздействие, а равновесие сместится в соответствующую сторону. Повышение температуры равновесной системы усиливает течение эндотермического процесса, охлаждение – наоборот. Например, в системе с ростом температуры равновесие диссоциации воды смещается вправо, то есть с повышением температуры усиливается диссоциация воды. Изменение давления существенно сказывается лишь на равновесиях газовых систем. Увеличение давления для них ведет к смещению равновесия в сторону меньшего объема, падение давления – в сторону большего объема. Например, равновесие в системе при увеличении давления смещается вправо, а при уменьшении – влево. Увеличение концентрации исходных веществ ведет к смещению равновесия вправо (в сторону продуктов). Степень смещения равновесия при данном количестве вещества определяется величиной стехиометрического коэффициента. Наконец, отметим, что введение в газовую систему, находящуюся при равновесии и имеющую постоянное давление, газа, не реагирующего ни с одним из компонентов, приводит к синхронному разбавлению всех участников. Следовательно, вопрос о смещении равновесия сводится к вопросу о влиянии уменьшения концентраций всех компонентов равновесной системы на положение равновесия. Согласно принципу Ле Шателье в этом случае смещение равновесия будет происходить в сторону большего объема (большего числа молей). Например, введение азота или аргона в равновесную систему приведет к смещению равновесия влево. 2.2. Количественные характеристики равновесия Методами термодинамики можно показать, что зависимость энергии Гиббса k-го компонента идеального газа от его парциального давления (Рk) выражается соотношением (речь идет об абсолютном значении энергии Гиббса!): . (2.1) Для реального газа это соотношение принимает вид: . (2.2) Аналогично выражения для энергии Гиббса m-го компонента идеального и реального растворов имеют вид (речь идет об абсолютном значении энергии Гиббса!): , . (2.3) Обратим внимание, что значения функций gk(T) и gm(T) неизвестны и поэтому неизвестны абсолютные величины энергий Гиббса. Кроме того, в силу логарифмической зависимости энергии Гиббса от давления (концентрации) нельзя принимать за стандартное состояние газообразных веществ и растворов (в отношении растворенных веществ) бесконечно разреженный газ и бесконечно разбавленный раствор соответственно. Изменение энергии Гиббса в химической реакции может быть найдено и через абсолютные величины энергий Гиббса компонентов, если бы они были известны: (продуктов) – (исходных веществ), (2.4) где ni и nj – числа молей (коэффициенты в уравнении). Рассмотрим равновесную газовую систему, подставим выражение (2.1) в соотношение (2.4): Первые слагаемые этой суммы являются функцией только температуры и в дальнейшем обозначим их через Ф(Т). С остальными слагаемыми выполним несложные математические преобразования, в результате получаем: = Ф(Т) + - = 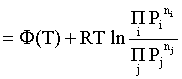 . (2.5) . (2.5) При равновесии Gреакции = 0, с учетом этого для выражения (2.5) получаем: 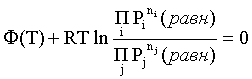 . (2.6) . (2.6)Логарифм отношения произведений является функцией только температуры: 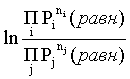 , (2.7) , (2.7)и пусть он равен ln KP. Выражение 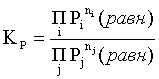 , (2.8) , (2.8)являющееся константой при данной температуре, называется константой равновесия. Для равновесной смеси реальных газов константа равновесия будет иметь такой же вид, но вместо давлений в ней будут фигурировать фугитивности. Повторяя эти выкладки с выражением для энергии Гиббса компонента раствора (2.3), получаем аналогичное выражение: 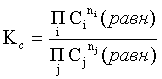 . (2.9) . (2.9) В случае реальных растворов концентрации должны быть заменены на активности. Для газовых равновесий величины Кр и Кс связаны: 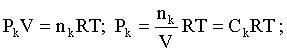 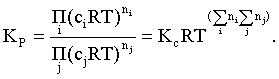 (2.10) (2.10)Например, для равновесной системы 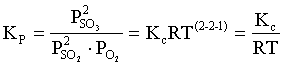 . .Уравнение (2.5) является общим выражением для энергии Гиббса химической реакции. Подставляя в него соотношения (2.7 – 2.9) получаем: 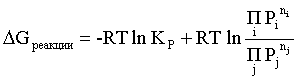 (газы); (газы);(2.11) 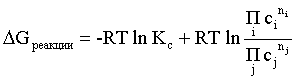 (растворы). (растворы).При Pi, Pj, ci и cj, равных единице (стандартное состояние!) эти соотношения переходят в одно из наиболее употребляемых уравнений термодинамики: . (2.12) Подчеркнем, что в уравнении (2.11) фигурирует термодинамическая константа, она равна Кр или Кс лишь в случае идеального газа или идеального раствора соответственно. Для реальных систем в выражении термодинамической константы равновесия должны быть подставлены величины фугитивностей компонентов газовой смеси или активностей компонентов раствора. Под знаком логарифма в (2.11) стоят отношения двух величин, выраженных в одних и тех же единицах, – отношение давления к давлению в стандартном состоянии или отношение концентрации к концентрации в стандартном состоянии, то есть безразмерные величины. Таким образом, термодинамическая константа равновесия, стоящая под знаком логарифма в выражении (2.11), является безразмерной величиной. Наконец, отметим, что концентрация индивидуальных жидких и кристаллических веществ постоянна и равна единице и не включается в выражение константы равновесия. Уравнение (2.12) является одной из основ экспериментального определения стандартных величин энергий Гиббса процессов, в частности – энергий Гиббса образования соединений. Среди других поставщиков термодинамических данных отметим электрохимические измерения. Наконец, подчеркнем, что основным поставщиком термодинамических данных являются калориметрические измерения, позволяющие определять энтальпии и внутренние энергии различных процессов, теплоемкости веществ и систем, что дает возможность определять энтальпии образования соединений и энтропии индивидуальных веществ. Вернемся теперь к концентрационной и температурной зависимости электродного потенциала. Объединим уравнения (1.20), (1.28) и (2.10) для реального раствора: 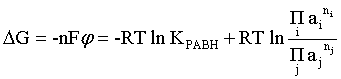 . (2.13) . (2.13)Отсюда ЭДС электрохимической системы равна: 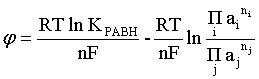 (2.14) (2.14) При активностях компонентов, равных единице (стандартное состояние!), это уравнение переходит в . (2.15) Сочетая (2.14) и (2.15), получаем 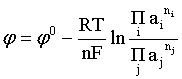 . (2.16) . (2.16)С учетом сказанного в разделе 1.6, соответствующее выражение для электродного потенциала имеет вид: 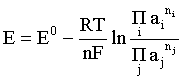 . (2.17) . (2.17)Например, для электродных процессов: Ni2+ + 2 ē = Ni; E1 Fe3+ + ē = Fe2+; E2 MnO4– + 8H+ + 5 ē = Mn2+ + 4 H2O; E3 выражения для электродных потенциалов будут следующими: ; 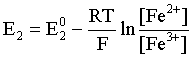 ; ;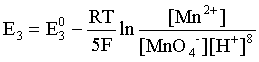 . .Обратим внимание, что, меняя концентрации потенциалопределяющих ионов, можно значительно изменять величину, а порой и знак электродного потенциала. Конкретные примеры, иллюстрирующие это, приведены в разделе "Задачи и упражнения" (с. 28). Задачи и упражнения |
