Конспект лекций. Конспект лекций, задачи и упражнения
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
1.2. Термохимия, закон Г.И. Гесса Пример 1. При сгорании 6,048 г водорода в кислороде при 298,15 К в стандартных условиях выделяется 857,5 кДж теплоты. Определить стандартную энтальпию образования H2O (ж) при 298,15 К. Решение. Водород сгорает в кислороде согласно уравнению: H2 (ж) + O2 (ж) = H2O (ж) Все вещества находятся в стандартных состояниях, поэтому энтальпия сгорания 1 моль Н2 (2,016 г) и будет стандартной энтальпией образования Н2О (ж) при 298,15 К; найдем эту величину: 6,048 – 857,5 2,016 – х, откуда х = 258,8; Hoбp.H2O(ж) = – 285,8 кДж/мoль. Пример 2. Энтальпия какого процесса отвечает термину “стандартная энтальпия образования НNO3 при 298,15 К”: а) H2 (г) + N2 (г) + O2 (г) = HNO3 (ж); б) H2 (г) + N2 (г) + O3 (г) = HNO3 (ж); в) H2 (г) + N2 (г) + O2 (г) = HNO3 (ж); г) H2 (г) + N2 (г) + O2 (г) = HNO3 (к); д.) N2O5 (к) + H2O(ж) = HNO3 (ж)? Решение. При 298,15 К стандартными состояниями для простых веществ будут H2 (г), O2 (г) и N2 (г), а для азотной кислоты - жидкость (хотя можно говорить и о стандартных термодинамических функциях, например, и HNO3 (г) при этой температуре). Поэтому лишь процесс "в" строго отвечает названному термину. Пример 3. Определить величину стандартной энтальпии образования C3H8 (г), если стандартные энтальпии образования CO2 (г) и Н2О (ж) равны соответственно –393,5 и –285,8 кДж/моль, а стандартная энтальпия сгорания С3Н8 (г) составляет –2219,9 кДж/моль. Решение. Запишем уравнение процесса, соответствующего термину "стандартная энтальпия образования С3Н8 (г)": 3C (к, графит) + 4H2 (г) = C3H8 (г); . Для определения Н воспользуемся 2-м следствием из закона Гесса (соотношение 1.12): =3H0сгорС (к, графит) + 4H0сгорH2(г) – H0сгор.C3H8 (г). Далее обратим внимание, что стандартные энтальпии образования СО2(г) и Н2O(ж) есть не что иное, как стандартные энтальпии сгорания графита и водорода. Следовательно: =3H0обрСO2 (г) + 4H0обрH2O (ж) – H0сгорC3H8 (г) = = 3(–393,5) + 4(–285,8) – (–2219,9) = – 103,8 кДж/моль. Пример 4. Энтальпия растворения Na2SO4 (к) в воде с образованием раствора состава Na2SO4 (к) 400 H2O составляет –1,5 кДж/моль, а энтальпия присоединения воды к Na2SO4 (к) c образованием Na2SO4 10H2O (к) равна –82,0 кДж/моль. Определить энтальпию растворения Na2SO410H2O (к) в воде с образованием раствора состава Na2SO4 400 H2O. Решение. Запишем условие задачи в виде термохимических уравнений: а) Na2SO4 (к) + 400 H2O (ж) = Na2SO4 (р-р, Na2SO4400H2O); H1; б) Na2SO4 (к) + 10 H2O (ж) = Na2SO410H2O (к); H2; в) Na2SO410H2O (к) + 390 H2O (ж) = Na2SO4 (р-р, Na2SO4400H2O); HХ. Как видно, искомое (третье) уравнение получается путем вычитания второго термохимического уравнения из первого, следовательно: HХ = H1–H2 = 1,5 – (–82,0) = 80,5 кДж. Пример 5. На основе справочных данных определить, в каком случае в стандартных условиях выделится больше теплоты – при сгорании 2 моль CH4 или 1 моль C2H6? Решение. Термохимические уравнения процессов горения: СH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (ж); С2H6 (г) + 3,5O2 (г) = 2CO2 (г) + 3H2O (ж). Выписываем из справочных данных стандартные энтальпии образования СО2(г), H2O(ж), CH4(г) и C2H6(г), пользуясь 1-м следствием из закона Гесса, вычисляем энтальпии написанных процессов, то есть стандартные энтальпии сгорания CH4(г) и C2H6(г): H0сгорСH4 (г) = H0обрCO2(г) + 2H0обрH2O(ж) – H0обрСH4 (г) – 2H0обрO2(г) = = – 393,5 + 2(–285,8) – (–74,8) – 20 = –890,3 кДж; H0сгорС2H6 (г) = 2H0обрCO2(г) + 3H0обрH2O(ж) – H0обрС2H6 (г) – – 3,5H0обрO2(г) = 2(–393,5) + 3(–285,8) – (–84,7) – 3,50 = – 1273,9 кДж. Из полученных величин следует, что при сгорании 2 моль CH4(г) выделяется теплоты больше, чем при сгорании 1 моль C2H6(г). Пример 6. Вычислить среднюю энтальпию связи С–Н в метане на основе следующих термохимических данных: 1) C (к,графит) + 2H2 (г) = CH4 (г), = –74,8 кДж; 2) H2 (г) = 2H (г), = 436,0 кДж; 3) C (к,графит) = C (г) , =715,1 кДж. Решение. Согласно определению средняя энтальпия связи С–Н в СН4 – это часть энтальпии следующего процесса: CH4 (г) = C (г) + 4H (г);= 4C–H. Это уравнение может быть получено путем сложения третьего уравнения с удвоенным вторым уравнением и вычитанием из этой суммы первого уравнения, следовательно: = 715,1 + 2(436,0)–(–74,8)=1661,9 кДж. Отсюда: H0ср.С–H = =415,5 кДж. Пример 7. Определить энтальпию связи С–С в этане на основе следующих данных: НобрС2Н6(г) = –84,7 кДж/моль; НсублимацииС(к,графит) = 715,1 кДж/моль; Н дисН2 на атомы = 436,0 кДж; Н ср. С–Н = 415,5 кДж/моль связи. Решение. Запишем исходные данные в виде термохимических уравнений: 1) C (к,графит) + 3H2 (г) = C2H6 (г), обрC2H6(г); 2) C (к,графит) = C (г) , сублимации C (к,графит); 3) H2 (г) = 2H (г), диссоциации H2 на атомы. Основой для нахождения искомой величины является термохимическое уравнение C2H6 (г) = 2C (г) + 6H (г); При распаде на атомы 1 моль С2Н6(г) будет разорвано 1 моль связей С–С и 6 моль связей С–Н, следовательно: = + 6. С другой стороны, может быть найдена на основе исходных термохимических данных, а именно – искомое уравнение получается путем сложения удвоенного второго уравнения с утроенным третьим уравнением и вычитания из полученной суммы первого уравнения, отсюда: =2+3–=2715,1 + 3(436,0) – (–84,7) = 2822,9 кДж. Находим теперь энтальпию связи С–С в этане: = 2822,9 – 6(415,5) = 329,9 кДж/моль связи. 1.3. Энтропия Пример 1. В каком из следующих процессов следует ожидать наибольшего и наименьшего изменения энтропии: 1) H2 (г) + 0,5O2 (г) = H2O (ж); 2) H2 (г) + 0,5 O2 (г) = H2O (г); 3) C2H6 (г) + 3,5O2 (г) = 2 CO2 (г) + 3 H2O (г); 4) KClO3 (к) = KCl (к) + 1,5 O2 (г). Решение. Знак и величину S процесса можно оценить, не производя вычислений, если вспомнить, что энтропия газа существенно больше энтропии жидкости и тем более – кристаллического вещества. Поэтому, определяя, насколько число молей газообразных веществ в правой части уравнения больше числа молей газообразных веществ в левой части уравнения, приходим к выводу, что наибольшая положительная энтропия характеризует четвертый процесс. Энтропии первого и второго процессов отрицательны, наибольшая отрицательная энтропия соответствует первому процессу. Пример 2. Пользуясь справочными данными, определить стандартную энтропию образования K2Cr2O7 (к). Решение. Искомая величина – это Sо следующего процесса: 2K (к) + 2Cr (к) + 3,5 O2 (г) = K2Cr2O7 (к). Эта величина может быть найдена на основе соотношения (1.18): S0 = S0 K2Cr2O7 (к) – 2S0 K (к) – 2S0 Cr (к) – 3,5S0 02 (г) = = 291 – 264,48 – 223,6 – 3,5205,0 = – 603,1 Дж/К. Пример З. Пользуясь справочными данными, определить возможность самопроизвольного протекания при 298,15 К следующих процессов в изолированных системах: 1) KClO3 (к) = KCl (к) +1,5 O2 (г); 2) N2 (г) + 2H2 (г) + Cl2 (г) = NH4Cl (к). Решение. Для изолированных систем критерием самопроизвольного течения процесса является положительное значение энтропии. Поэтому, пользуясь справочными данными, вычисляем для указанных процессов = S0 KCl (к) + 1,5S0 O2 (г) – S0 KClO3 (к) = = 82,6 + 1,5205,0 – 143,0 = 247,1 кДж/К; = S0 NH4Cl (к) – 0,5S0 N2 (г) – 2S0 H2 (г) – 0,5S0 Cl2 (г) = = 95,8 – 0,5191,5 – 2130,5 – 0,5223,0 = – 372,5 Дж/К. В результате делаем вывод, что в изолированной системе первый процесс разрешен в самопроизвольном течении, а второй - запрещен. 1.4. Энергия Гиббса 1.5. Критерий самопроизвольного протекания процессов Пример 1. На основе справочных данных проанализировать вопрос о возможности самопроизвольного протекания следующего процесса при 298,15 К в стандартных условиях: NaH (к) + H2O (ж) = NaOH (к) + H2 (г). Решение. Вычисляем стандартную энергию Гиббса данного процесса по соотношению (1.22): G0=G0обрH2(г) + G0обрNaOH (к) – G0обрH2O (ж) – G0обрNaH (к) = = 0 + (–495,9) – (–285,8) – (–56,4) = –153,7 кДж. Поскольку G отрицательно, то данный процесс может самопроизвольно протекать при 298,15 К в стандартных условиях. Пример 2. Почему многие соединения, имеющие Gобр > 0, могут быть получены и даже порой оказываются сравнительно стабильными? Решение. Действительно, соединения, имеющие Gобр > 0, могут самопроизвольно распадаться на простые вещества (G такого процесса отрицательно!), однако скорость подобного распада может оказаться незначительной и подобные соединения оказываются сравнительно стабильными. В таких случаях говорят о термодинамически неустойчивых, но устойчивых кинетически соединениях. Примеры таких соединений: H2Te, SiH4, NO2. Пример 3. На основе расчетов термодинамических величин покажите, чем эффективнее восстанавливать при 298,15 К Сr2O3 (к) до металла – алюминием или магнием? Решение. Для ответа на поставленный вопрос, очевидно, необходимо вычислить Gо двух процессов: 1) Cr2O3(к) + 3Mg(к) = 3MgO(к) + 2Cr(к); 2) Cr2O3(к) + 2Al(к) = Al2O3(к) + 2Cr(к); G01= 2G0обрCr(к) + 3G0обрMgO(к) – 3G0обрMg(к) – G0обрCr2O3(к) = = 3G0обрMgO(к) – G0обрCr2O3(к) = 3(–569,3) – (–1059,0) = – 648,9 кДж; G02= G0обрCr(к) + G0обрAl2O3(к) – 2G0обрAl(к) – G0обрCr2O3(к) = = G0обрAl2O3(к) – G0обрCr2O3(к) = – 1582,3 – (–1059,0) = – 523,3 кДж. Самопроизвольное восстановление Сr2O3(к) до Сr(к) при 298,15 К возможно и Mg, и А1; учитывая, что G0 процесса с Mg более отрицательно, можно сказать, что восстановление магнием более эффективно. Пример 4. На основе справочных данных оценить температуру восстановления WO3(к) водородом. Решение. Для начала определим термодинамические функции процесса восстановления при 298,15 К: WO3(к) + 3H2(г) = W(к) + 3H2O(г); G0298,15 = 3G0обрH2O(г) + G0обрW(к) – 3G0обрH2(г) – G0обрWO3(к) = = 3G0обрH2O(г) – G0обрWO3(к) = 3(–228,6) – (–763,8) = – 78,0 кДж; H0298,15= 3H0обрH2O(г) + H0обрW(к) – 3H0обрH2(г) – H0обрWO3(к) = = 3H0обрH2O(г) – H0обрWO3(к) = 3(–241,8) – (–842,7) = 117,3 кДж; S0298,15= 3S0H2O(г) + S0W(к) – 3S0H2(г) – S0WO3(к) = = 3188,7 + 32,7 – 3130,5 – 76 = 131,3 Дж/К. Как видно, самопроизвольное течение процесса при 298,15 К невозможно. Однако, принимая во внимание положительное значение энтропии процесса, следует ожидать, что с ростом температуры отрицательный энтропийный вклад (–ТS0298,15K) будет увеличиваться и при некоторой температуре превысит положительное значение энтальпии процесса, а энергия Гиббса станет отрицательной. Границей начала самопроизвольного протекания процесса будет G0T = 0. Поскольку информация о температурной зависимости величин Н0 и S0 отсутствует, примем в первом приближении, что они неизменны с ростом температуры, то есть: Н0T Н0298; S0T S0298. Иными словами, строгое термодинамическое соотношение G0T = Н0T – TS0T переходит в приближенное G0T Н0298,15 – TS0298,15 . Полагая G0T = 0, вычисляем соответствующую температуру: H0298,15 – TS0298,15 = 0; 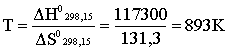 или 6200С. или 6200С.Таким образом, при температуре выше 620°С возможно самопроизвольное течение процесса восстановления WO3(к) водородом. 1.6. Изменение энергии Гиббса в окислительно-восстановительных реакциях Пример 1. Пользуясь таблицей величин стандартных электродных потенциалов, приведите примеры нескольких окислителей, позволяющих перевести соединения Mn+2 в соединения Mn+7. Решение. Величина электродного потенциала для системы MnO4– + 8H+ + 5ē = Mn2+ + 4H2O равна 1,51 В. Поскольку φ0= Е0окисл – Е0восст, а критерием самопроизвольного протекания ОВР в стандартных условиях является φ0 > 0, то любое вещество – окислитель, стандартный электродный потенциал для которого превышает 1,51 В, в принципе должен окислять ион Mn2+ до иона МnO4– в кислой среде. Таковыми являются, например, ион Со3+, персульфаты, озон, фтор. Это подтверждается значениями величин электродных потенциалов: Co3+ + ē = Co2+; E0 = 1,82 В; S2O82– + 2ē = 2SO42–; E0 = 2,01 В; O3 + 2H+ +2ē = O2+H2O; E0 = 2,07 В; F2 + 2H+ + 2ē =2HF; E0 = 3,06 В. |
