Конспект лекций. Конспект лекций, задачи и упражнения
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Пример 3. рН 0,5 М раствора ацетата калия равен 9,23. Определить константу диссоциации уксусной кислоты. Решение. Ацетат калия – соль, гидролизованная по аниону: 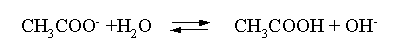 Согласно соотношению (3.27) для этой системы: 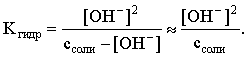 Находим величину константы гидролиза: pH = 9,23; pOH = 14 – 9,23 = 4,77; [OH–] = 1,7010–5; 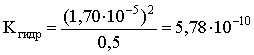 . .С другой стороны, согласно (3.26) в случае гидролиза по аниону: 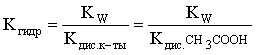 . .Отсюда определяем константу диссоциации уксусной кислоты: 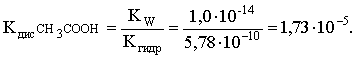 Пример 4. По справочным данным определить константу гидролиза НСООК при 298,15 К. Решение. Формиат калия – соль, подвергающаяся гидролизу по аниону: Константа равновесия этого процесса и есть константа гидролиза, она соответственно может быть найдена на основе стандартного значения энергии Гиббса: G0 = G0обрOH–(р-р, ст.с) + G0обрHCOOH(р-р, ст.с., гип.недис) – G0обрH2O(ж) – –G0обрHCOO–(р-р, ст.с) = –157,3 + (–373,0) – (–237,3) – (–351,5) = 58,5 кДж. Далее находим константу гидролиза: G0 = – RT ln Kгидр; 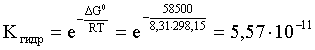 . .Пример 5. На сколько единиц изменится рН раствора соли, гидролизованной по аниону, при его разбавлении в 100 раз? Решение. В случае гидролиза по аниону согласно (3.27): 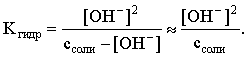 Запишем равенство величин констант гидролиза в растворах соли двух концентраций: 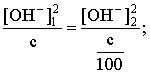 . .Логарифмируем полученное соотношение и меняем знаки в уравнении: 2 lg [OH–]1 = 2 + 2 lg [OH–]2 – lg [OH–]1 = –1 – lg [OH–]2 pOH1 = pOH2 – 1 14 – pH1 = 14 – pH2 – 1 pH1 = pH2 + 1. Таким образом, при разбавлении раствора соли, гидролизованной по аниону, в 100 раз, величина рН уменьшается на единицу. 4. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ 4.1. Общие сведения о комплексных соединениях Соединения, образованные из двух или более простых соединений, каждое из которых может существовать независимо, называют комплексными соединениями. Иногда, чтобы подчеркнуть особенность образования химической связи в этих соединениях, их определяют как соединения высшего порядка, образованные из более простых, устойчивых соединений без возникновения новых электронных пар. 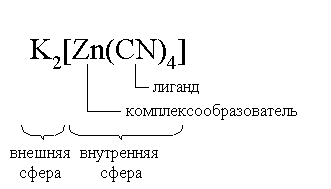 Центральный ион (атом) в комплексном соединении называется комплексообразователем. Это обычно ион d- или f-элемента, реже – р- или s-элемента. Непосредственно окружающие комплексообразователь ионы или молекулы, называемые лигандами, образуют вместе с комплексообразователем так называемую внутреннюю (координационную) сферу комплексного соединения. Ее обычно выделяют квадратными скобками. Ионы (молекулы) за пределами внутренней сферы образуют внешнюю сферу комплексного соединения. Например, в соединении Центральный ион (атом) в комплексном соединении называется комплексообразователем. Это обычно ион d- или f-элемента, реже – р- или s-элемента. Непосредственно окружающие комплексообразователь ионы или молекулы, называемые лигандами, образуют вместе с комплексообразователем так называемую внутреннюю (координационную) сферу комплексного соединения. Ее обычно выделяют квадратными скобками. Ионы (молекулы) за пределами внутренней сферы образуют внешнюю сферу комплексного соединения. Например, в соединении Общее число лигандов во внутренней сфере называется координационным числом (к.ч.). Простейшее объяснение механизма образования химической связи в комплексных соединениях – донорно-акцепторное взаимодействие между лигандами и комплексообразователем: лиганды поставляют свободные электронные пары на пустые d-ор6итали комплексообразователя (подробнее – во второй части этого пособия). Лиганд в общем случае может занимать во внутренней сфере не одно, а два (или более) координационных мест в соответствии с числом свободных электронных пар, поставляемых лигандом на свободные орбитали комплексообразователя. Число таких координационных мест, занимаемых лигандом, называется дентатностью. Соответственно различают: монодентатные лиганды – F─, Cl─, CN─, ОН─, NH3, H2O и т.д.; бидентатные лиганды – С2О42─, этилендиамин и т.п. Возможны лиганды и большей дентатности, так, в аналитической химии широко применяется этилендиаминтетрауксусная кислота и ее динатриевая соль (ЭДТА), эти лиганды имеют дентатность, равную шести. Координационные числа обычно четные, наиболее распространены к.ч. 6 и 4. Как правило, координационное число равно удвоенной степени окисления иона-комплексообразователя, то есть комплексным соединениям Ме2+ наиболее характерно к.ч.=4, а для комплексов Ме3+ к.ч.=6. Однако следует иметь в виду, что координационные числа часто бывают и больше, чем удвоенная степень окисления иона-комплексообразователя, и, гораздо реже, меньше. Так, в водных растворах большинство ионов двухвалентных металлов представляют собой гексаакваионы [Me(H2O)6]2+. По характеру лигандов можно выделить следующие основные типы комплексных соединений. В аквакомплексах лигандом является молекула воды, например, кристаллогидраты. В гидроксокомплексах лиганд – ОН─, например: K2[Sn(OH)4], Na3[Cr(OH)6]. Аммиачные комплексы (лиганд – NH3), например: [Ag(NH3)2]Cl, [Cu(NH3)4](OH)2. Наиболее обширную группу составляют ацидокомплексы, в которых лигандами выступают анионы кислотных остатков, например: K[Au(CN)2], K2[HgI4]. Все приведенные выше комплексные соединения являются однородными, то есть содержат единственный лиганд; возможны и комплексные соединения с различными лигандами, например: [Cr(H2O)5Cl]Cl2. Могут быть комплексные соединения и без внешней сферы, то есть внутрисферные комплексные соединения, например: [Pt(NH3)2Cl2]. Названия комплексных соединений строятся по принципу названий солей с указанием лигандов и степени окисления комплексообразователя. При построении названия комплексного катиона или аниона первоначально называют ионные лиганды в порядке возрастания степени их сложности. Далее называют лиганды-молекулы также в порядке возрастания степени их сложности. При этом молекулы H2O и NH3 обозначаются "аква" и "аммин". При необходимости используются соответствующие соединительные гласные. В конце названия комплексного катиона или аниона называется ион-комплексообразователь с указанием его степени окисления римскими цифрами в скобках. В случае аниона берется корень латинского названия элемента, к нему прибавляется окончание "ат", например: станнат, аурат, плюмбат. Примеры: [Cr(NH3)4Cl2]Cl хлорид дихлоротетрамминхрома (III); K3[Al(OH)6] гексагидроксоалюминат (III) калия; [Co(NH3)6][Cr(CN)6] гексацианохромат (III) гексаамминкобальта (III); [Pt(NH3)2Cl2] дихлородиамминплатина (II). Для комплексных соединений характерно явление изомерии, рассмотрим кратко основные его типы. Ионизационная изомерия обусловлена различным распределением ионов между внутренней и внешней сферами комплексного соединения, например: [Cr(NH3)4Cl2]Br и [Cr(NH3)4ClBr]Cl . В случае если катион и анион являются комплексными, возможна координационная изомерия, она связана с различным распределением лигандов между комплексообразователями, например: [Cr(NH3)6][Co(CN)6] и [Co(NH3)6][Cr(CN)6] . Если молекулы или ионы, являющиеся лигандами, могут существовать в различных изомерных формах, возможна изомерия лигандов. Такой вид изомерии чаще характерен для комплексных соединений с органическими лигандами, например: 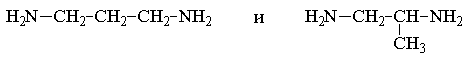 Различное пространственное расположение лигандов ведет к цис-транс-изомерии и зеркальной изомерии. Так для комплексов с к.ч.=4, имеющих квадратное строение, существуют цис- и транс-изомеры, например: 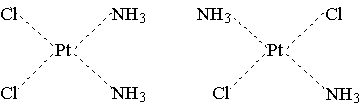 цис-изомер транс-изомер Зеркальные изомеры комплексных соединений имеют идентичные химические и физические свойства, они различаются лишь асимметрией кристаллов и разным направлением вращения плоскости поляризации света. 4.2 Образование и разрушение комплексных соединений. Диссоциация комплексных соединений Комплексные соединения образуются и существуют в растворах при сравнительно большом избытке лиганда. Обычно его берут в несколько раз больше того количества, которое необходимо в соответствии со стехиометрическим соотношением. В результате подавляется диссоциация комплексного соединения и оно стабилизируется. 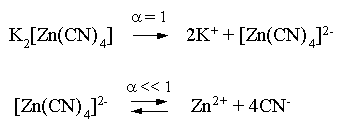 Разная прочность связи во внутренней и внешней сферах комплексного соединения ведет к различию в характере диссоциации этих частей молекулы. По внешней сфере в водных растворах все комплексные соединения являются сильными электролитами, тогда как диссоциация по внутренней сфере происходит в незначительной степени. Например, для приведенного выше соединения: Разная прочность связи во внутренней и внешней сферах комплексного соединения ведет к различию в характере диссоциации этих частей молекулы. По внешней сфере в водных растворах все комплексные соединения являются сильными электролитами, тогда как диссоциация по внутренней сфере происходит в незначительной степени. Например, для приведенного выше соединения:Константа равновесия для последнего процесса (диссоциация комплексного иона) называется константой нестойкости: Кравн = Кнест = . Константа равновесия обратного процесса называется константой устойчивости: Кравн = Куст = . Чем больше Куст (меньше Кнест), тем прочнее комплексное соединение, тем слабее оно диссоциирует. Ясно, что произведение Кнест и Куст равно единице. Разрушить комплексные соединения можно следующим образом: 1) нагрев приводит к удалению летучего лиганда, например: t [Cr(H2O)6]Cl3 = CrCl3 + 6H2O ; t [Cu(NH3)4]SO4 = CuSO4 + 4NH3 ; 2) связывание основного лиганда кислотой, например: [Cu(NH3)4](OH)2 + 6HCl = CuCl2 + 4 NH4Cl + 2H2O, движущей силой процесса в этом случае является то, что ион аммония значительно прочнее аммиачного комплекса; 3) образование малорастворимого соединения с ионом комплексообразователем, например: [Cu(NH3)4]SO4 + K2S = CuS↓ + 4 K2SO4 + 4NH3 , в данном случае равновесие смещается вправо в силу того, что ПР CuS << Кнест [Cu(NH3)4]2+; 4) связывание иона-комплексообразователя в более прочный комплекс, то есть разрушение первоначального комплекса за счет образования более прочного нового комплекса, например: [Cu(NH3)4]SO4 + 4KCNизб = K2[Cu(CN)4] + K2SO4 + 4NH3 ; 5) окисление иона-комплексообразователя, например: 5K4[Fe(CN)6] + KMnO4 + 4H2SO4 = 5K3[Fe(CN)6] + MnSO4 + 3K2SO4 + 4H2O 6) в случае сравнительно непрочных комплексных соединений для их разрушения достаточным оказывается разбавление растворов, например: H2O K[BiI4] = KI + BiI3 . Задачи и упражнения Задачи и упражнения 4.2. Образование и разрушение комплексных соединений. Диссоциация комплексных соединений Пример 1. Константа нестойкости комплексного иона [Zn(CN)4]2– равна 2,510–20. Определить концентрацию иона Zn2+ в 0,1 М растворе K2[Zn(CN)4], содержащем избыток KCN в количестве 1 моль/л. Решение. Диссоциация фигурирующих в задаче электролитов описывается следующим образом: 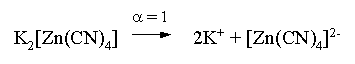 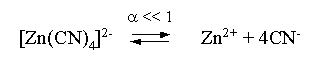 Константа равновесия диссоциации комплексного иона – константа нестойкости. Пусть равновесная концентрация иона Zn2+ составляет Х моль/л, концентрации остальных ионов составят: [CN–] = 4X+1; [Zn(CN)4]2– = 0,1 – Х. Подставляем эти значения в выражение для константы нестойкости и находим искомую величину: 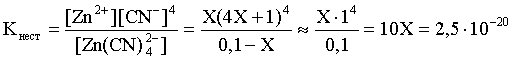 X = [Zn2+] = 2,510–21. Пример 2. При какой концентрации ионов S2– начнет выпадать осадок CdS из 0,1 М раствора K2[Cd(CN)4], содержащего избыток KCN в количестве 1 моль/л? Kнест. [Cd(CN)4]2– = 1,410–19; ПРZnS = 1,210–28. Решение. Условием выпадения осадка является превышение значения ПК над величиной ПР. Повторяя выкладки предыдущей задачи, находим равновесную концентрацию иона Cd2+: 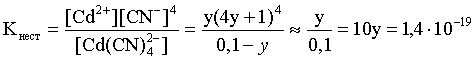 y = 1,410–20. Наконец, определяем концентрацию иона S2– : ПК > ПР; [Cd2+][S2–] > ПР; 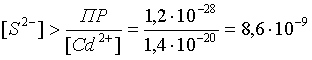 . .Пример З. На основе справочных данных вычислить при 298,15 К константу устойчивости комплексного иона [Zn(OH)4]2–. Решение. Константа устойчивости иона [Zn(OH)4]2– – это константа равновесия процесса и она, естественно, может быть найдена через значение G0 для написанного процесса: G0 = G0 обр [Zn(OH)4]2– (р-р, ст.с.,гип.недис) – G0 обр Zn2+ (р-р, ст.с) – – 4 G0 обр OH– (р-р, ст.с) . Выписываем из справочника необходимые величины и находим значение G0 процесса, а затем – и константу устойчивости: G0 = – 860,8 – (–147,2) – 4(–157,3) = – 84,4 кДж ; G0 = – RT ln Kуст ; 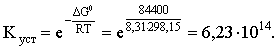 Пример 4. Определить, какова должна быть концентрация избыточного аммиака в 0,5 М растворе [Ag(NH3)2]Cl, чтобы введение 0,0001 моль KBr в 1 л такого раствора не приводило к образованию осадка AgBr. При решении считать, что введение 0,0001 моль KBr в 1 л раствора комплексного соединения не изменит объем раствора. Kнест [Ag(NH3)2]+ = 5,610–8; ПР AgBr = 4,910–13. |
