Конспект лекций. Конспект лекций, задачи и упражнения
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
6. Эквивалент. Закон эквивалентов Пример 1. При взаимодействии 3,49 г металла с избытком разбавленной серной кислоты выделилось 1,68 л (н.у.) газа. Определить молярную массу эквивалента металла и его оксида. Решение. В соответствии с законом эквивалентов (соотношение 6.3) для процесса nэкв Me = nэкв H2 Поскольку fэкв Н2 = 0,5, то 1 моль эквивалентов водорода при н.у. занимает объем 0,522,4 = 11,2 л. Находим число молей эквивалентов участников реакции: 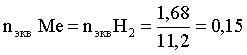 моль экв. моль экв.Наконец, определяем молярную массу эквивалента металла: , г/(моль экв). Молярная масса эквивалента оксида составит соответственно 23,3 + 8 = 31,3 г/(моль экв). Пример 2. Сколько литров (н.у.) сероводорода может быть окислено 0,316 г перманганата калия в кислой среде? Сколько граммов серы при этом будет получено? Решение. Схема протекающего процесса: KMn+7O4 + H2S–2 + H+ = Mn+2 + S0 + ... . По закону эквивалентов: nэкв KMnO4 = nэкв H2S = nэкв S. Эту величину находим по перманганату калия: 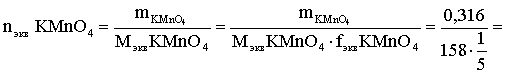 = 0,01моль экв. Далее определяем массу серы: 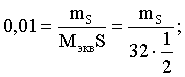 mS = 0,16 г. mS = 0,16 г.Объем 1 моль эквивалентов сероводорода (н.у.) составит 22,4 fэкв H2S = 22,4 0,5 = 11,2 л. Отсюда вычисляем объем газа: VH2S = n экв H2S Vэкв = 0,01 11,2 = 0,112 л. Пример 3. На нейтрализацию 0,164 г кислоты израсходовано 40 мл 0,1 М раствора NaOH. Найти молярную массу эквивалента кислоты. Решение. По закону эквивалентов: nэкв NaOH = nэкв к-ты Фактор эквивалентности NaOH в любых обменных реакциях составляет единицу, следовательно, для NaOH молярность и нормальность раствора совпадают. Тогда число молей эквивалентов едкого натра составит 0,040,1=0,004 моль экв. Это значение позволяет определить молярную массу эквивалента кислоты: 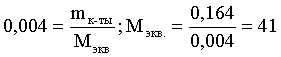 г. г.Пример 4. Какой объем 0,1 М раствора К2Cr2O7 потребуется для окисления в кислой среде 200 мл 0,1 М раствора нитрита калия? Решение. Схема протекающего процесса: K2Cr+62O7 + KN+3O2 + H+ Cr+3 + KN+5O3 + … Воспользуемся законом эквивалентов в варианте соотношения (6.4): . Нормальности растворов составят: 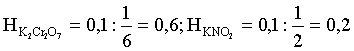 . .Находим неизвестный объем: мл. Пример 5. Каким объемом 0,05 М раствора KMnO4 можно заменить 1 л 10 мас.% раствора K2Cr2O7 плотностью 1,08 г/мл в реакциях окисления-восстановления, протекающих в кислой среде? Решение. По закону эквивалентов: nэкв KMnO4 = nэкв K2Cr2O7 Задача фактически сводится к нахождению молярной, а затем – нормальной концентрации раствора K2Cr2O7. Первоначально находим молярную концентрацию: 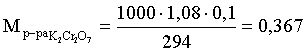 ; г/моль. ; г/моль.Далее, учитывая процессы, происходящие при окислении перманганатом и бихроматом калия в кислой среде Mn+7O4– + 8H+ + 5 ē = Mn2+ + 4 H2O, Cr+62O7 + 14H+ + 6 ē = 2Cr3+ + 7 H2O, производим необходимые вычисления и определяем требуемый объем: ; ; , л. ПРИЛОЖЕНИЕ Таблица 1 Стандартные термодинамические характеристики образования индивидуальных веществ, водных растворов и ионов при 298,15 К
Продолжение табл. 1
Продолжение табл. 1
|
