фарм химия. фхкурс. "Контроль качества лекарственных средств промышленного производства"
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
|
Глава 2. Контроль качества Производитель лекарственных средств должен организовать их производство так, чтобы лекарственные средства гарантированно соответствовали своему назначению и предъявляемым к ним требованиям и не создавали риска для потребителей из-за нарушения условий безопасности, качества или эффективности. Ответственность за выполнение этих требований несут руководители и все работники предприятия-производителя, а также поставщики и дистрибьюторы. Высокое качество лекарства подразумевает: высокую химическую чистоту действующего вещества (примеси есть всегда, вопрос в том, сколько их в процентном отношении к общему составу и нет ли среди них вредных даже в очень малых количествах); точное соответствие содержания действующего вещества заявленному (например, устаревшее оборудование не может обеспечить точность дозировки при серийном изготовлении или недобросовестные производители могут "экономить" на содержании действующего вещества и лечебный эффект лекарства может снижаться - что не только наносит потребителям финансовый ущерб, но и может быть попросту опасно для здоровья); высокое качество и безопасность "наполнителей" (большинство лекарственных форм состоит не только из действующего вещества, но и из дополнительных ингредиентов, служащих для правильного введения действующего вещества в организм - так называемого "механизма доставки"); качество упаковки, соответствие реальной и заявленной даты производства, правильность транспортировки и хранения (большинство химических веществ с течением времени трансформируется, например, распадется, улетучивается, вступает в химические реакции от воздействия температуры, света, кислорода и влаги атмосферы и т.п.). [4,18] 2.1 Система GMP Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе. В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты: национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов; постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области; постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики; приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом; приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики; приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России. При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. [1] Применение таких стандартов регулируется следующими нормативными документами: Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС; Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам. Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло. Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. [15] 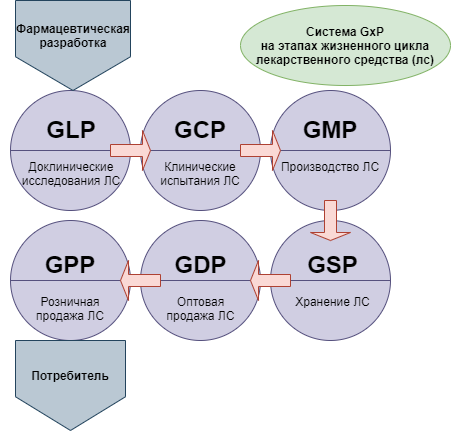 2.1.1 Управление качеством Система обеспечения качества (система качества) при производстве лекарственных средств должна гарантировать следующее: 1. Лекарственные средства разработаны с учетом требований настоящего стандарта и требований к работе лабораторий. 2. На все производственные и контрольные операции разработана документация в соответствии с настоящим стандартом. 3. Ответственность и обязанности всех работников четко определены. 4. Предусмотрены меры, обеспечивающие производство, поставку и использование исходных и упаковочных материалов, соответствующих заданным требованиям. 5. Контроль промежуточной продукции и технологического процесса (внутрипроизводственный контроль), аттестация (валидация) процессов и оборудования проводятся в необходимом объеме. 6. Производство и контроль готовой продукции соответствуют утвержденным инструкциям (методикам). 7. Реализация лекарственных средств до выдачи Уполномоченным лицом разрешения на выпуск исключена. Уполномоченное лицо должно подтвердить, что каждая серия продукции произведена и проверена в соответствии с установленными требованиями. 8. Существующая система мер обеспечивает уровень качества лекарственных средств при их хранении, отгрузке и последующем обращении в течение всего срока годности. 9. Порядок проведения самоинспекции и/или аудита качества позволяет регулярно оценивать эффективность системы обеспечения качества. 2.1.2 Требования к производству и контролю качества лекарственных средств Настоящий стандарт входит в систему качества и направлен на обеспечение гарантии того, что производство и контроль качества продукции постоянно соответствуют требованиям, установленным в документации. Основные требования: I. Все производственные процессы должны быть четко регламентированы и периодически пересматриваться с учетом накопленного опыта. Следует контролировать стабильность производства лекарственных средств с заданным качеством в соответствии со спецификациями на них. II. Следует проводить аттестацию (валидацию) критических стадий процессов производства, в том числе при внесении существенных изменений в технологический процесс. III. Следует обеспечить все необходимые условия для выполнения требований настоящего стандарта, в т.ч. включая наличие: а) обученного и аттестованного персонала; б) необходимых помещений и площадей; в) соответствующего оборудования и системы обслуживания; г) материалов, средств упаковки и маркировки, удовлетворяющих заданным требованиям; д) утвержденных инструкций и методик; е) требуемых условий хранения и транспортирования. IV. Инструкции и методики должны быть конкретными, изложены ясно и однозначно в письменной форме. V. Персонал должен быть обучен правильному выполнению инструкций. VI. В процессе производства следует составлять протоколы (заполняемые в рукописной форме и/или с использованием технических средств), документально подтверждающие фактическое проведение предусмотренных инструкциями технологических стадий и получение продукции требуемого качества в количестве, соответствующем установленным нормам. Все отклонения необходимо расследовать и протоколировать в полном объеме. VII. Протоколы на серию, в т.ч. документацию по реализации продукции, должны давать возможность прослеживать изготовление каждой серии продукции и должны храниться в полном объеме в доступной форме. VIII. Порядок реализации (оптовой продажи) продукции должен сводить к минимуму любой риск для ее качества. IX. Следует организовать систему отзыва любой серии продукции из продажи или поставки. X. Рекламации на качество продукции следует тщательно рассматривать, а причины ухудшения качества расследовать с принятием соответствующих мер по их предотвращению. 2.1.3 Контроль качества Контроль качества включает в себя отбор проб, проведение испытаний (анализов) и оформление соответствующей документации. Инструкции по организации, документированию и выдаче разрешения на выпуск продукции должны включать в себя проведение всех необходимых испытаний и запрещать использование исходного сырья и материалов и реализацию готовой продукции до подтверждения соответствия качества установленным требованиям. Цель контроля качества - не допустить к использованию или реализации материалы или продукцию, не удовлетворяющие требованиям качества. Служба контроля качества выполняет исследования, проверки и участвует в принятии любых решений, касающихся качества продукции. Основополагающим принципом обеспечения контроля качества является независимость отдела контроля качества. На каждом предприятии, выпускающем лекарственные средства, должен быть отдел контроля качества, независимый от других подразделений. Руководитель этого отдела должен иметь необходимый опыт и квалификацию. К отделу контроля качества относятся одна или несколько контрольных лабораторий. Для выполнения своих функций отдел должен быть обеспечен всеми необходимыми ресурсами. Основные обязанности начальника отдела контроля качества изложены выше. На отдел возлагаются также обязанности по разработке, аттестации (валидации), внедрению всех инструкций (методик) по контролю качества; хранению контрольных образцов. [12] 2.1.3.1 Основные требования к контролю качества 1. Наличие необходимых помещений и оборудования, обученного персонала, утвержденных методик по отбору проб, проверке и проведению испытаний исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции, контролю окружающей среды в случае необходимости. 2. Проведение отбора проб исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции аттестованным персоналом в соответствии с методиками, утвержденными отделом контроля качества. 3. Проведение испытаний аттестованными (валидированными) методами. 4. Составление протоколов (заполняемых рукописным способом и/или с применением технических средств), подтверждающих фактическое проведение всех необходимых отборов проб, проверок и испытаний, а также регистрацию любых отклонений и расследований в полном объеме. 5. Подтверждение того, что готовая продукция содержит активные ингредиенты по качественному и количественному составу, соответствующие регистрационному досье, имеет требуемую чистоту, правильно упакована и маркирована. 6. Оформление протоколов проверки исходного сырья и материалов, промежуточной, нерасфасованной и готовой продукции, их анализ и сравнение со спецификациями. Оценка продукции включает в себя изучение всей необходимой производственной документации и анализ отклонений от установленных требований. 7. Получение разрешения на продажу или поставку любой серии продукции только после подтверждения Уполномоченным лицом ее соответствия регистрационному досье. 8. Сохранение достаточного количества образцов исходных материалов и продукции для возможной проверки в случае необходимости. Образцы продукции следует хранить в своей окончательной упаковке, за исключением крупных упаковок. 2.1.3.2 Персонал Организация и функционирование производства и системы обеспечения качества лекарственных средств зависят от персонала. Предприятие должно быть укомплектовано персоналом необходимой численности и квалификации. Должностные обязанности каждого сотрудника должны быть оформлены документально и усвоены каждым сотрудником. Все сотрудники также должны знать требования настоящего стандарта (Правил GMP), относящиеся к сфере их деятельности, и проходить начальное и повторное обучение в необходимом объеме, в т.ч. по правилам личной гигиены. Основные обязанности руководителя производства: 1. Организация производства и хранения продукции в соответствии с документацией с целью обеспечения требуемого качества. 2. Утверждение инструкций, связанных с производственным процессом, и обеспечение их точного выполнения. 3. Контроль за рассмотрением и подписанием всех производственных протоколов лицами, имеющими необходимые полномочия, до передачи их в службу контроля качества. 4. Контроль за работой своего подразделения, содержанием помещений, эксплуатацией и техническим обслуживанием оборудования. 5. Контроль за проведением работ по аттестации (валидации). 6. Организация первичного и последующего обучения производственного персонала Основные обязанности руководителя службы контроля качества. 1. Утверждение или отклонение исходных и упаковочных материалов, промежуточной, нерасфасованной и готовой продукции. 2. Оценка протоколов на серию продукции. 3. Проведение необходимых испытаний. 4. Утверждение спецификаций, инструкций по отбору проб, методик испытаний и других методик по контролю качества. 5. Допуск к работе специалистов-аналитиков, работающих по контракту, и контроль за их деятельностью. 6. Контроль работы подведомственного отдела, обслуживания его помещений и оборудования. 7. Контроль проведения аттестации (валидации). 8. Организация первичного и последующего обучения персонала подведомственного отдела. 2.1.4 Документация Правильно составленная документация является важной частью системы обеспечения качества. Четкое оформление документации позволяет предотвратить ошибки, возможные при устном общении, и проследить все этапы производства конкретной серии продукции. Спецификации, промышленные регламенты, инструкции, методики и протоколы серии продукции должны быть оформлены надлежащим образом и не должны содержать ошибок. Виды документов: спецификация: документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств; промышленный регламент, технологическая инструкция и инструкция по упаковке: документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции; инструкция, методика, процедура: документ, содержащий указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования); протокол на серию: документ, отражающий ход производства каждой серии продукции, в т.ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции. Глава 3. Производство ЛС Для получения продукции требуемого качества технологические операции следует выполнять согласно промышленному регламенту и соответствующим инструкциям, требованиям настоящего стандарта, нормативных документов и регистрационного досье. |
