Аналитическая химия (Семинары по аналитической и коллоидной химии). Аналитическая химия (Семинары по аналитической и коллоидной хими. Курс физической и коллоидной химии, включающий физикохимические методы анализа и методы разделения и очистки, играет существенную роль при подготовке специалистов в области инженерной экологии
 Скачать 402.5 Kb. Скачать 402.5 Kb.
|
6. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗАОснованы на изучении процессов, протекающих на поверхности электрода или вблизи него. Любой электрический параметр (потенциал Е, сила тока I, сопротивление R) связан с концентрацией анализируемого раствора и могут служить аналитическим сигналом. В прямых электрохимических методах исследуется зависимость Е, I, R от концентрации определяемого компонента, в косвенных эти параметры используются для определения конечной точки титрования. Классификация электрохимических методов по измеряемому параметру.
6.1. КУЛОНОМЕТРИЯОснована на использовании законов электролиза Фарадея: 1. Количество восстановленного или окисленного в результате электролиза вещества прямо пропорционально количеству прошедшего электричества. 2. Массы различных веществ, выделенных на электроде при прохождении 1 Кулона электричества, равны их электрохимическим эквивалентам. Электролиз начинается при определенном напряжении между электродами, называемом потенциалом разложения. Для того чтобы электролиз проходил быстро, напряжение в цепи поддерживают выше потенциала разложения. Если раствор содержит несколько компонентов, имеющих различные потенциалы разложения, можно выделять их из смеси в определенной последовательности, регулируя напряжение. При увеличении напряжения сначала выделяются на катоде металлы, имеющие меньший потенциал разложения. Например, из раствора ионов Pb+2 и Cd+2 (с единичными активностями) сначала будут восстанавливаться на катоде ионы свинца (E0Pb=-0126 В, Е0Св=-0,402 В). Если потенциал катода сделать равным -0,35 В, то будут восстанавливаться только ионы свинца, а ионы кадмия останутся в растворе. При прохождении тока через раствор на электродах накапливаются продукты восстановления и окисления, которые образуют как бы новый гальванический элемент, ЭДС которого направлена против внешнего источника. Это явление называется поляризацией электродов. Различают химическую и концентрационную поляризацию, Химическая вызвана образованием на электродах продуктов электролиза, а концентрационная возникает за счет изменения концентрации ионов вблизи электродов по сравнению с объемом раствора, то-есть возникает концентрационный гальванический элемент, ЭДС которого направлена против напряжения внешнего источника тока. Она зависит от плотности тока и больше в случае небольших электродов. Количественной мерой поляризации является разность равновесной ЭДС и ЭДС при прохождении тока, называемая перенапряжением. Электролиз - химическая реакция окисления или восстановления на электроде под действием электрического тока, проводится либо при постоянной силе тока, либо при постоянном потенциале. Для измерения количества прошедшего через ячейку заряда применяются кулонометры или электронные интеграторы. В кулонометре протекает известная реакция с 100%-ным выходом по току. Измерение массы образовавшегося в кулонометре вещества позволяет рассчитать прошедший заряд. Кулонометрия - высокочувствительный и точный метод анализа, позволяющий определить до 10-9 г вещества. Однако, необходимо правильно подобрать напряжение (потенциал) электролиза, для того чтобы исключить протекание побочных реакций. При прохождении тока изменяется потенциал электрода по сравнению с равновесным (определенным уравнением Нернста), это явление называется поляризацией электрода. Оно связано с тем, что прохождение электрического тока делает процесс неравновесным (необратимым). Рассмотрим две стадии реакции окисления-восстановления. Если медленной (лимитирующей) стадией является массоперенос (обеднение граничного слоя раствора веществом, расходующимся при электролизе из-за медленной его диффузии), то возникает концентрационная поляризация. Если лимитирующая стадия - перенос электрона, то возникает кинетическая поляризация, или перенапряжение. В последнем случае необходимо приложить дополнительную разность потенциалов к электродам для проведения электролиза. 6.2. ПОТЕНЦИОМЕТРИЯИзмеряется зависимость равновесного потенциала электрода от активности определяемого иона. Зависимость потенциала электрода от состава раствора используют для определения конечной точки титрования (потенциометрическое титрование). В качестве индикаторных электродов применяют металлические либо ионоселективные (мембранные). Потенциал ионоселективного электрода чувствителен к определенному иону, он линейно зависит от логарифма активности определяемого иона в растворе. Такие электроды называются также сенсорами. Важная часть сенсора - полупроницаемая мембрана - тонкая пленка, отделяющая внутреннюю часть электрода (внутренний раствор) от анализируемого и обладающая способностью пропускать ионы только одного вида. Эта способность связана с наличием в мембране ионогенных групп. Мембрана контактирует с двумя растворами иона - внешним и внутренним, и с обеих сторон происходит обмен ионами и на обеих сторонах возникают граничные потенциалы. С помощью электродов сравнения, помещенных во внешний и внутренний растворы, измеряют их разность (мембранный потенциал), который линейно зависит от активности иона в анализируемом растворе. Влияние других ионов на потенциал учитывается с помощью уравнения Никольского (модифицированного уравнения Нернста). Раздел потенциометрии, где индикаторным электродом служит ионоселективный электрод, называется ионометрией. 6.3. ВОЛЬТАМПЕРОМЕТРИЯ (ПОЛЯРОГРАФИЯ).Метод основан на расшифровке кривых зависимости тока от потенциала (поляризационных кривых), измеренных в ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения (метод называется также полярографией). Это высокочувствительный и быстрый метод определения неорганических и органических веществ, один из универсальных методов определения следовых количеств веществ, позволяющий одновременно определять несколько компонентов в смеси. Особенность ячейки для полярографии - сильно различающиеся площади поверхности электродов. Плотность тока на меньшем электроде в несколько тысяч раз больше, чем на электроде сравнения. Индикаторными электродами могут быть ртутный, платиновый, графитный. Если ртуть капает из капилляра под давлением своего столба, электрод называется капающим ртутным, а полученные вольтамперограммы называются полярограммами. Вторым электродом может быть донная ртуть. На ячейку подается постоянный потенциал и его медленно изменяют, при этом изменяется ток. Полученный график зависимости тока от потенциала называется полярограммой показан на рисунке 6.1. Он состоит из трех участков: А-Б от начала записи до начала реакции;  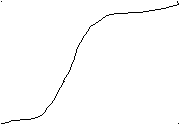 Б-В резкий подъем тока за счет реакции, В-Г- установление практически постоянного тока. На первом участке идет слабый ток заряжания обновляющейся поверхности капающего ртутного Б-В резкий подъем тока за счет реакции, В-Г- установление практически постоянного тока. На первом участке идет слабый ток заряжания обновляющейся поверхности капающего ртутного  электрода. При достижении Е1 (потенциала выделения) начинается реакция восстановления. Н электрода. При достижении Е1 (потенциала выделения) начинается реакция восстановления. Н апример: Cd+2+2e=Cd. апример: Cd+2+2e=Cd. Предельный ток в точке В ограничен скоростью диффузии ионов к поверхности ртути и называется диффузионным, Id. Он пропорционален концентрации ионов (С) в растворе (уравнение Ильковича): Id=607n(D)1/2m2/3t1/6C, где n - число электронов, участвующих в реакции, D - коэффициент диффузии ионов, m - скорость вытекания ртути, t - период капания, С - концентрация ионов. Потенциал в точке максимального наклона называется потенциалом полуволны. Полярография используется для качественного анализа (Е1/2 и наклон зависят от природы вещества) и количественного анализа (Id пропорционален концентрации ионов). 6.4. КОНДУКТОМЕТРИЯИзмерение электропроводности используется для определения качества воды, так как электропроводность определяется вкладами электропроводностей всех ионов в растворе. Чаще всего кондуктометрия используется для кондуктометрического титрования. Применимо к реакциям кислотно-основным или осадительным, которые сопровождаются заметным изменением электропроводности вследствие образования слабо диссоциирующих электролитов или малорастворимых соединений. Пример: HCl+NaOH=NaCl+H2O. В точке эквивалентности титрования образуется слабо диссоциированная вода, и электропроводность уменьшается. Дальнейшее добавление NaOH приводит к росту электропроводности. |
