Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
|
Для проверки усвоения темы рекомендуем выполнить задания и ответить на вопросы: 1. В составе липидов многих бактерий присутствует вакценовая кислота (11-октадеценовая) цис- 18 : 1: 11. В чем ее отличие от ненасыщенных кислот организма человека ? Запишите структурную формулу. 2. Препарат, получаемый из льняного масла, содержит смесь этиловых эфиров ненасыщенных жирных кислот : олеиновой( 15%) , линолевой ( 15% ) , линолено- вой ( 57% ) , применяют как профилактическое средство и для лечения атеросклероза, наружно- при ожогах , лучевых поражениях. Напишите структурные формулы выше названных эфиров. Объясните, почему утверждена форма выпуска этого препарата в о флаконах из темного стекла и хранят его в защищенном от света месте. 3. В процессе переваривания фосфолипидов в кишечнике в первую очередь происходит гидролиз сложноэфирной связи с участием ненасыщенной кислоты, образуется лизофосфатид, проявляющий свойства детергента. Запишите формулу лецитина, реакцию гидролиза в щелочной среде и формулу образовавшегося лизолецитина. 4. Запишите формулу холестерина и реакцию этерификации его олеиновой кислотой. ЛЕКЦИЯ 7 ПРИРОДНЫЕ БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА -АМИНОКИСЛОТЫ Содержание лекции 7.1.Номенклатура, особенности пространственного и структурного строения природных аминокислот 7.2.Классификация природных аминокислот по признакам химического строения (алифатические, ароматические, серусодержащие, гидроксисодержащие, моноаминодикарбоновые, диаминомонокарбоновые) в соответсвии с кислотно-основными свойствами (нейтральные, кислые, основные); 7.3. Физические свойства природных аминокислот; 7.4. Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка 7.5 . Качественная реакция обнаружения аминокислот. 7.6. Химические свойства аминокислот 8.6.1. Химические свойства аминокислот in vitro: - образование солей с кислотами, основаниями - хелатов – с ионами меди - свойства карбоксильной группы: образование сложных эфиров, амидов. 7.6.2. . Химические свойства природных аминокислот in vivo - декарбоксилирование, - дезаминирование, -трансаминирование, -окислительное дезаминирование 7.7. Строение витамина В6 и механизм реакции с его участием 7. 8. Реакция поликонденсации, образование полипептидов. 7.9. Медико-биологическое значение аминокислот 7.10 Применение аминокислот и их производных в качестве лекарственных препаратов. 7.11. Приложение - Перечень природных аминокислот ( в соответствии с классификацией) - Кислотно-основные свойства аминокислот - Структурные формулы природных аминокислот Исходный уровень знаний для усвоения темы: Кислотно-основные свойства биоорганических соединений, химические свойства карбоновых кислот и аминов, понятие « реакция поликонденсации», оптическая изомерия, стереоряды, основные понятия стереоизомерии – хиральный атом, энантиомер, диастереомер, рацемическая смесь. Ключевые слова к теме Аминокислота, амфотерность, буфеный раствор, витамин В6, дезаминирование, декарбоксилирование, диастереомер, изоэлектрическая точка, концевые аминокислоты, окислительное дезаминирование, основание Шиффа( азометин), пептид( полипептид), пептидная группа, переаминирование ( трансаминирование), поликонденсация, стереоизомер, стереоряд, энантиомер. 7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот Аминокислоты- большой класс органических соединений. характерным признаком которых является наличие в составе молекулы двух функциональных групп- карбоксильной и аминогруппы. Особую группу составляют природные аминокислоты. Их условно можно разделить на 2 группы: - аминокислоты , которые участвуют в образовании пептидов и белков. Для них характерно только а- строение и все принадлежат к L – стереоряду. - аминокислоты, которые обладают биологической активностью, но не являются мономерами природных полимеров белков и пептидов. Природные а –L - аминокислоты – мономеры полипептидов и белков. Обычно выделяют около 20 природных аминокислот , из которых образуется все множество природных белков растительного и животного происхождения. Единый генетический код природы определяет единство аминокислотного состава белков. Номенклатура природных аминокислот: применяются тривиальные названия. Особенности строения и стереохимия. Природные аминокислоты относятся к L – стереоряду и имеют а- строение ( это означает, что обе функциональные группы- амино- и карбоксильная- связаны с общим атомом углерода, который всегда оптически активный ( за исключением глицина – аминоуксусной кислоты). Исследованию пространственного строения природных аминокислот посвящены фундаментальные работы Э.Фишера, П. Каррера. R –C*H – COOH COOH NH2 - СН2- СООН | | глицин NH2 NH2 - *C – H | R L – стереоряд Большинство природных аминокислот имеют только один асимметричный атом углерода, но две аминокислоты – треонин и изолейцин – содержат два хиральных центра. Обе аминокислоты могут быть представлены двумя парами диастереомеров.( конечно, каждое соединение существует в виде 4 стереоизомеров, но конфигурация атома , связанного с амино- и карбоксильной группой может быть только L- ряда. Поэтому количество изомеров сводится к двум) На рисунке представлены истинные абсолютные конфигурации этих аминокислот. СН3 – *С Н - *С Н – СООН С 2Н5 – *С Н - *С Н- СООН | | | | ОН NH2 СН3 NH2 L- треонин L - изолейцин СООН СООН | | NH2 – C - Н NH2- С – Н | | Н – С - ОН СН3 – С - Н | | СН3 С 2Н5 7. 2 Классификация природных аминокислот Природные аминокислоты классифицируют по нескольким признакам: 1) биологическому : в отношении обмена веществ в организме человека различают два вида аминокислот заменимые( синтезируются в клетках человека) : аланин, аргинин, аспарагиновая кислота, глицин, глутаминова кислота, гистидин, пролин, серин, тирозин, цистеин, незаменимые( не синтезируются в клетках человека, должны поступать с продуктами питания) : валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин Для детей дополнительно незаменимыми являются аргинин и гистидин. 2) химическому , который связан со строением и составом радикала 3) физико- химическому , в основу которого положены кислотно- основные свойства: различают нейтральные , кислые , основные аминокислоты. 7. 3 Физические свойства природных аминокислот Аминокислоты – твердые, кристаллические вещества, многие хорошо растворимы в воде, некоторые сладкие на вкус. 7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка Кислотно- основные свойства аминокислот Аминокислоты – амфотерные вещества, в твердом состоянии они всегда существуют в виде биполярного, двухзарядного иона- « цвиттер- иона». (zwei - нем –два) R – CH – COOH <—> R – CH – COO – | | NH2 + NH3 биполярный ион Нейтральные аминокислоты Если в составе радикала аминокислоты нет групп, склонных к ионизации, то такая аминокислота и при растворении в воде представляет собой биполярный ион. К этаким аминокислотам – их называют нейтральными аминокислотами - относятся аланин, валин, гистидин, глицин, изолейцин, лейцин, метионин, серин, тирозин, треонин, триптофан , фенилаланин, цистеин . Нейтральные аминокислоты незначительно изменяют рН водного раствора в слабокислую сторону , не создают электропроводность водного раствора. Биполярный ион в кислой среде приобретает положительный заряд, а в щелочной – отрицательный. R – CH – COO – +ОН– R – CH – COO – + Н+ R – CH – COOН | <——> | <——> | NH2 -Н2 О + NH3 + NH3 анион в биполярный ион катион в щелочной среде кислой среде То значение рН, при котором аминокислота находится в виде биполярного иона, носит название изоэлектрической точки (pI ). Значение pI нейтральных аминокислот лежит в слабокислой среде. Например, у глицина pI = 5, 9, аланина – 6,02 , фенилаланина- 5,88. Слабокислая среда полностью подавляет диссоциацию положительно заряженной группы ( + NH3 ) и тем самым максимально повышают концентрацию цвиттер-иона. В кислой среде нейтральная аминокислота становится катионом и мигрирует к катоду, а в щелочном растворе - анионом и перемещается к аноду при пропускании постоянного тока через раствор , содержащий смесь аминокислот. Ионы аминокислот передвигаются к электроду с различной скоростью, зависящей от природы аминокислоты и рН среды. Метод анализа аминокислот и белков путем их разделения в электрическом поле называется электрофорезом. Кислые аминокислоты Две аминокислоты – аспарагиновая и глутаминовая , называемые моноаминодикарбоновыми, кислыми аминокислотами, содержат дополнительные карбоксильные группы в составе радикала НООС- СН2 - СН- СООН НООС – СН 2– СН2- СН- СООН | | NH2 NH2 аспарагиновая глутаминовая В кристаллическом состоянии они являются биполярными ионами, при растворении в воде происходит диссоциация второй карбоксильной группы, среда раствора становится кислой( рН < 7 ), а кислота превращается в анион с зарядом -1. НООС – ( СН 2)n– СН- СОО – – ООС – ( СН 2)n– СН- СОО – + Н+ | ————> | +NH3 <———— +NH3 кристалл + Н + раствор биполярный ион анион Изоэлектрическая точка моноаминодикарбоновых кислот находится в кислой среде: у аспарагиновой ( рI = 2, 87 ) и глутаминовой ( рI = 3, 22 ) .Это объясняется следующим образом: добавление протона более сильной кислоты подавляет диссоциацию ω –карбоксильной группы, анион превращается в цвиттер-ион. Основные аминокислоты Три аминокислоты – диаминомонокарбоновые , основные кислоты- содержат в радикале дополнительно аминогруппу- к ним относятся лизин, аргинин и орнитин( последняя не встречается в составе белков, но чрезвычайно важна для синтеза мочевины) NH2- ( СН2 ) n - СН- СООН NH2- С - NH - ( СН2 )3 - СН- СООН | | | | NH 2 NH NH2 n = 3 орнитин гуанидиновая n = 4 лизин группа аргинин В кристаллическом состоянии они являются биполярными ионами, а при растворении в воде происходит протонирование второй аминогруппы, возникает катион аминокислоты с зарядом +1. Среда раствора становится щелочной. Изоэлектрическая точка находится в щелочной среде: аргинин ( рI = 10,76), лизин (рI = 9, 74). + НОН + NH3- ( СН ) n - СН- СОО– ———> + NH3- ( СН ) n - СН- СОО– + ОН– | <——— | NH 2 + ОН – + NH 3 кристалл раствор биполярный ион катион В биполярном ионе присоединение протона от карбоксильной группы происходит к более основной ω – аминогруппе ( она в меньшей степени испытывает акцепторное индуктивное действие карбоксильной группы по сравнению с группой в а-положениии). В кислой среде возможно также протонирование одного атома азота цикла имдазола в молекуле гистидина ( вспомните, такой атом азота мы называли «пиридиновый» ) Добавление более сильного основания вновь превращает катион диаминомонокарбоновой кислоты в цвиттер- ион. NB ! Водные растворы аминокислот обладают буферными свойствами. При добавлении кислоты или щелочи аминокислоты приобретают тот или иной заряд: если рН раствора больше, чем рI, преобладают анионы кислоты, если меньше, чем рI, то преобладают катионы кислоты. 7.5. Качественная реакция обнаружения аминокислот Аминокислоты реагируют с веществом нингидрином с образованием соединений характерного синего цвета. Эту реакцию используют для качественного и количественного определения аминокислот при проведении электрофореза или хроматографии. 7. 6 . Химические свойства аминокислот 7 .6. 1 Химические свойства аминокислот in vitro Химические свойства аминокислот связаны с присутствием двух различных функциональных групп : амино – и карбоксильной. R – CH – COOH реакции карбоксильной группы | - образование сложных эфиров NH2 - амидов реакции аминогруппы - декарбоксилирование - ацилирование -солей при действии оснований. металлов ( образование амидов , защита аминогруппы) - образование солей с кислотами Присутствие основной и кислотной групп придает аминокислотам амфотерные свойства и возможность взаимодействовать друг с другом , образуя пептиды. Доказательством амфотерных свойств аминокислот является существование в виде внутренней соли( биполярного иона) и способность образовывать соли при взаимодействии с кислотами и основаниями. 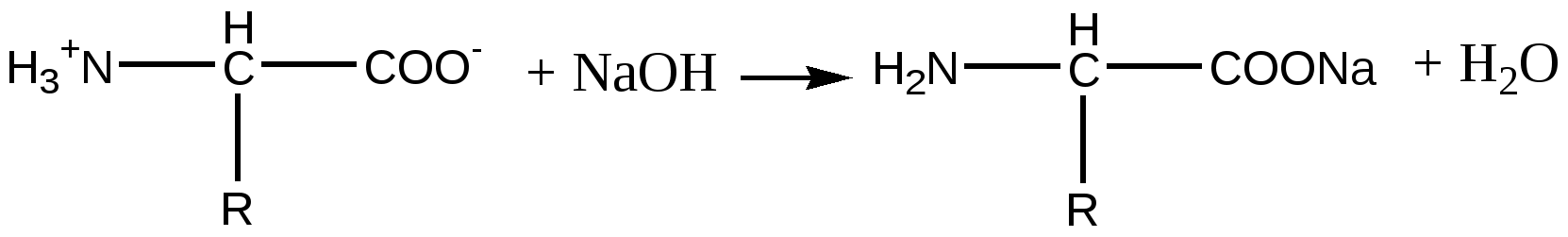 натриевая соль аминокислоты 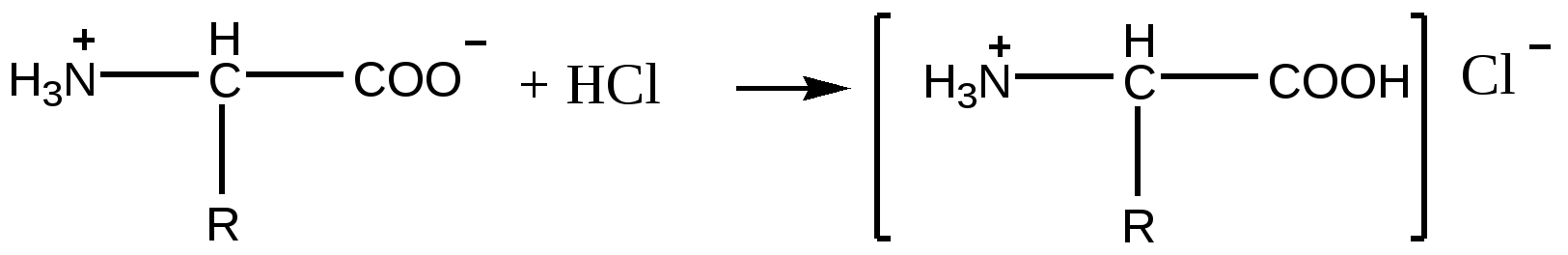 хлороводородная соль аминокислоты NB! Следует хорошо запомнить, что изменение рН среды вызывает изменение заряда аминокислоты и заряда белка. 7.6.2. Химические свойства аминокислот in vivo Декарбоксилирование Относится к общей реакции всех природных а- аминокислот , в которой участвуют ферменты декарбоксилазы при участии витамина В6 в двух активных формах пиридоксальфосфата и пиридоксаминофосфата . Образуются вещества с выраженной биологической активностью – биогенные амины. R – CH – COOH фермент декарбоксилаза | ————> R – CH2 - NH2 + CO2 NH2 В6 биогенный амин Аминокислота Синтез важнейших биоактивных соединений связан с декарбоксилированием серина, глутаминовой кислоты, гистидина , 5-окситриптофана, диоксифенилаланина ( в последнем случае образуется вначале дофамин, затем норадреналин и адреналин) СН2 - СН- СООН ———> НО - СН2 – СН2 - NH2 + СО2 | | аминоэтанол( коламин) OH NH2 серин Аминоэтанол является предшественником в синтезе холина и медиатора ацетилхолина. Аминоэтанол и холин входят в состав фосфолипидов: аминоэтанол – кефалина, холин- лецитина. фермент глутаматдекарбоксилаза НООС- СН2 -СН2 -СН-СООН ———> НООС- СН2 -СН2 -СН2 -NH2 + CO2 | γ -аминомасляная кислота ( ГАМК) NH2 глутаминоая кислота 4-Аминобутановая кислота(γ -аминомасляная кислота , ГАМК) - медиатор торможения ц.н.с.. применяется как лекарственный препарат( аминалон, гаммалон ). У экспериментальных животных недостаток витамина В6 сопровождается дефицитом образования нейромедиаторов и проявляется возникновением судорог, напоминающих эпилепсию . Дезаминирование Различают два вида дезаминирования : неокислительное и окислительное. Неокислительное дезаминирование Различают несколько видов неокислительного дезаминирования: * элиминирование аминогруппы – получается непредельная кислота * гидролитическое – аминокислота превращается в гидроксикислоту * восстановительное – образуется насыщенная аминокислота * трансаминирование( переаминирование). Представляет собой основное направление обмена аминокислот в организме человека. Трансаминирование( переаминирование) Эта чрезвычайно важная реакция, которая протекает во всех тканях организма человека, но особенно активно в печени, почке, миокарде, сводится к взаимопревращению двух различных аминокислоты и кетокислоты- образуются новая аминокислота и новая кетокислота. В результате трансаминирования вступают в обмен веществ аминокислоты, поступающие в составе белков, синтезируются заменимые кислоты. R1 - CH –COOH + R2 – C- COOH ———> R 2 - CH –COOH + R1 – C- COOH | | | <———| | | NH2 О NH2 О аминокислота (1) кетокислота( 1) аминокислота(2) кетокислота( 2) Наиболее важные пары : аланин + щавелевоуксусная кислота <=== > ПВК + аспарагиновая кислота аланин + а -кетоглутаровая кислота <===> ПВК + глутаминовая кислота аспарагиновая кислота+ а –кетоглутаровая <=== >ЩУК + глутаминовая кислота кислота В составе катализаторов- ферментов обязательно присутствует витамин В6 |
