Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
3,4 нм |
 кофермент НАДФН - восстановленная форма |
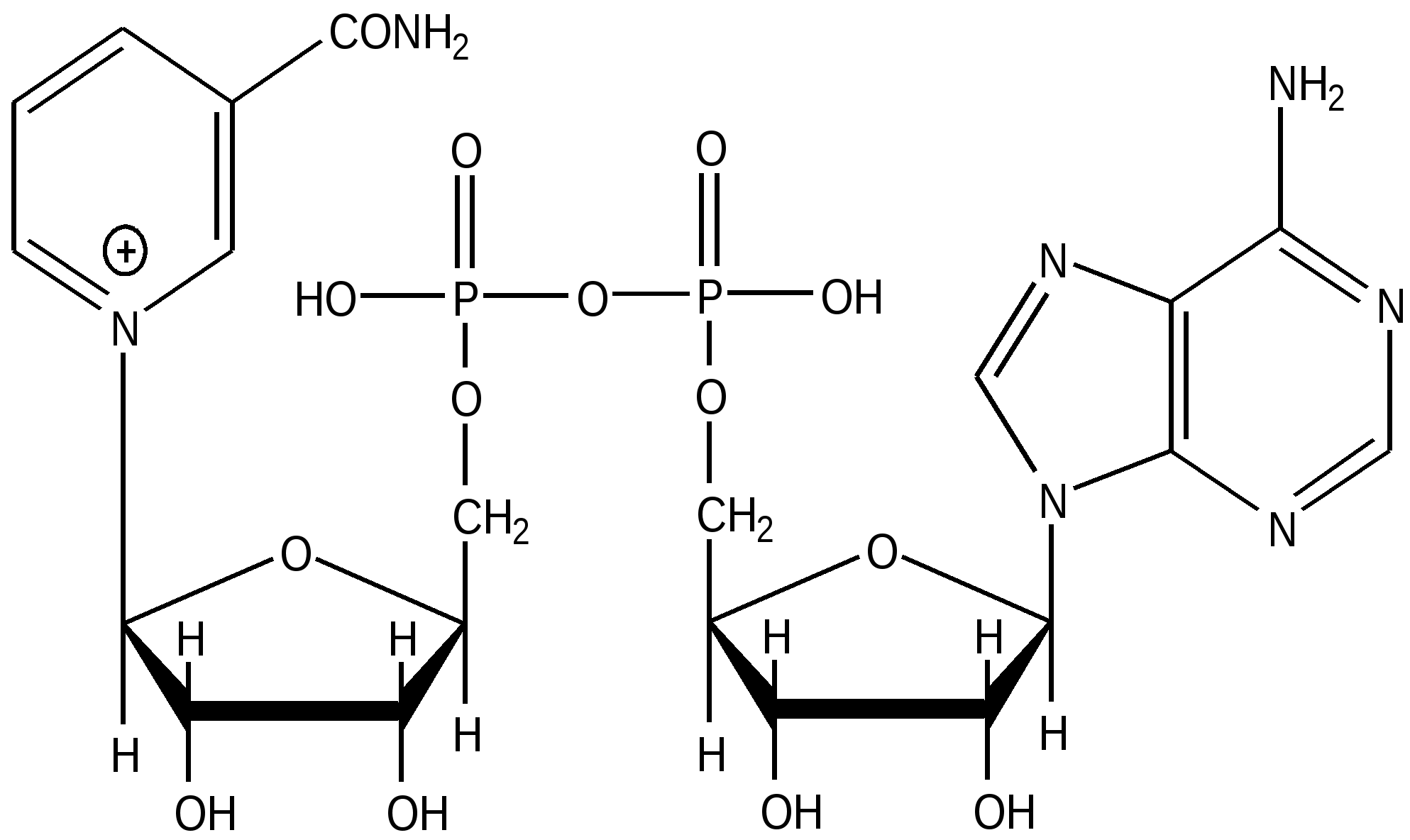
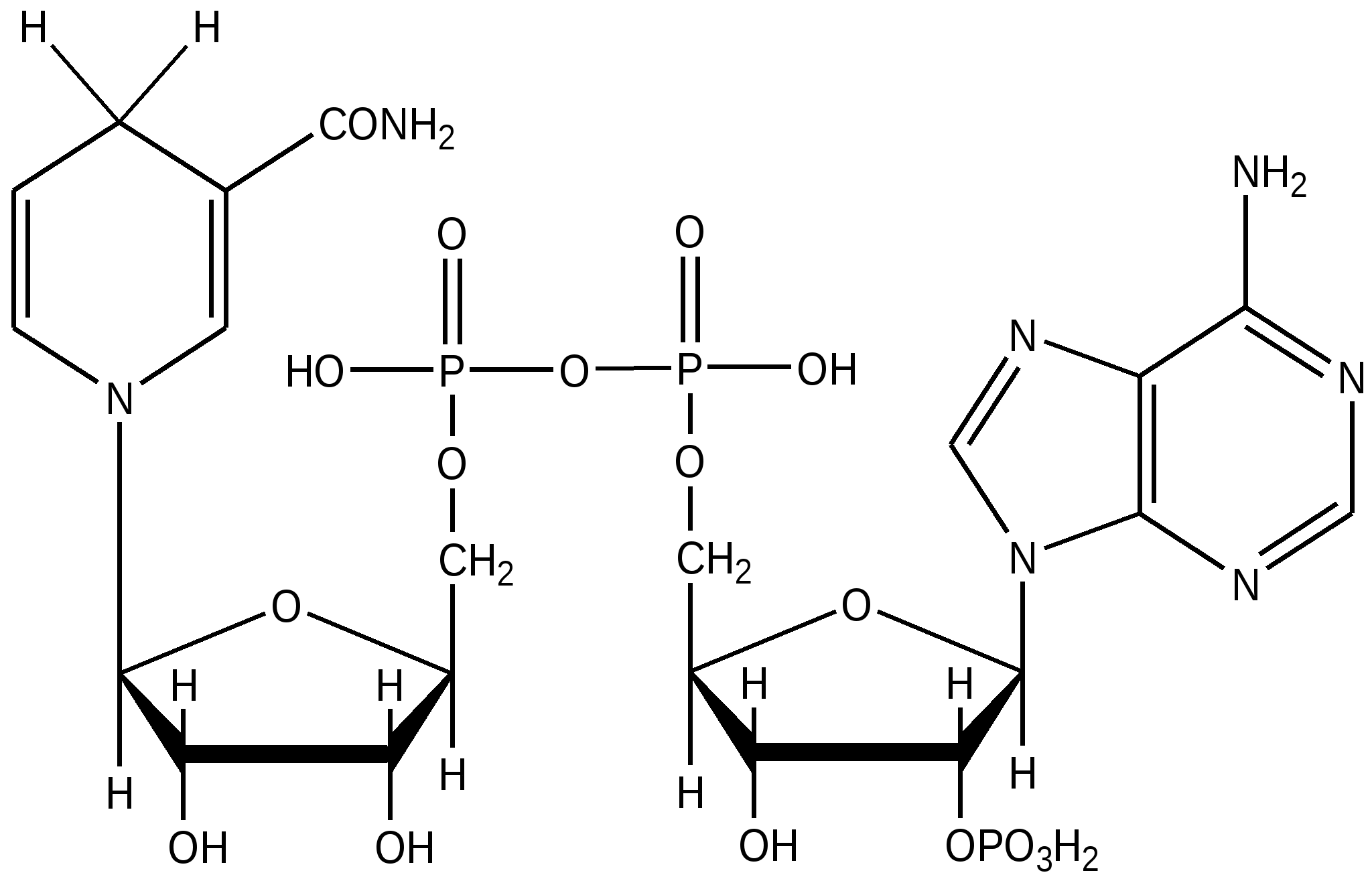
| Динуклеотиды НАД + , НАДФ+, НАДН , НАДФН – твердые кристаллические вещества, очень гигроскопичные, хорошо растворимы в воде. НАД+ и НАДФ+ разлагаются при нагревании в воде, под действием ультрафиолета, а НАДН и НАДФН – быстрее даже при комнатной температуре. Ферментативную активность имеют соединения только с β-гликозидной связью. Имеются спектральные отличия окисленной и восстановленной форм : НАД+ ( НАДФ+) λ 260 и 230 нм, НАДН( НАДФН) λ 259 и 339. на которых основано количественное определение коферментов в биологических средах и определение кинетики ( скоростей) биохимических реакций. 3’-Фосфоаденозил- 5’-фосфосульфат Принимает участие в переносе сульфогруппы( из положения 5’, где между остатками фосфорной и серной кислот образуется ангидридная, макроэргическая связь). Сульфирует гетерополисахариды( ГАГ)-хондроитинсульфат, дерматансульфат, гепарин и ксенобиотики, которые в виде сульфоэфиров фильтруются в почке и выделяются в составе мочи из организма. |
 ФАФС 3’-Фосфоаденозил- 5’-фосфосульфат |
Сульфирует гетерополисахариды( ГАГ) в процессе образования хондроитинсульфата, дерматансульфата, активного гепарина и ксенобиотики, которые в виде сульфоэфиров фильтруются в почке и выделяются в составе мочи из организма.
Реакция детоксикации – сульфирование ксенобиотика
R-ОН( ксенобиотик) + ФАФС ——>
3’-Фосфоаденозил- 5’-фосфат + R-О- SO3 Н
11.8 Приложение . Справочные материалы к теме лекции
История открытия структуры ДНК
В 1869 г. Ф. Мишер, швейцарский врач, исследовал состав ядер гнойных клеток и выделил из них вещество кислого характера, назвав его «нуклеином». Это событие рассматривается сейчас как открытие нуклеиновых кислот.
1889 г - введен термин « нуклеиновые кислоты»
1891 г. – немецкий биохимик А. Кессель описал гидролиз нуклеиновой кислоты, установив ее состав: углевод, фосфорная кислота и четыре азотистых основания . представители пиримидина и пурина. А. Кессель первый указал, что существуют два вида нуклеиновых кислот, описал гистоны и протамины. Автор одной из первых теорий строения белка. Лауреат Нобелевской премии по физиологии и медицине (1910).
1908 – 1909 г.- Ф. Левен предложил термины «нуклеозид» и «нуклеотид».
!930г и позднее- представления о том, что ДНК- тетрануклеотид с 4 различными гетероциклическими основаниями( теория Ф.Левена).
Начало 40-х гг – прямые доказательства участия НК в передаче генетической информации.
1940г.- Дж. Бидл и Э. Тейт сформулировали важнейший принцип : «один ген – один фермент»
1950 – Э. Чаргафф обнаружил отличия в нуклеотидном составе ДНК из разных биологических источников. Обнаружил попарную эквивалентность А-Т , Г-Ц.
Конец 40-х – 1952г- получены рентгенограммы ДНК.
1953 – Дж. Уотсон и Ф. Крик - модель двухцепочечной структуры ДНК.
!957 г. – А. Корнберг открыл фермент ДНК- полимераза.
1960г.-С. Вейц, Ж. Гурвиц, О. Стивенсон – открыли главный фермент транскрипции – ДНК-зависимую-РНК-полимеразу.
1961г. – С. . Беннер и Ф. Крик открыли триплетный код.
1962 г. -Уотсон, Крик, Уилкинс получили Нобелевскую премию по физиологии и медицине Д. Уотсон и Ф.Крик совместно расшифровали структуру ДНК и предложили ее модель в виде двойной спирали в 1953 г.
1966г. –М. Ниренберг, Г. Корана, С. Очоа- открыли и доказали , что генетический код состоит из 64 кодонов.
Крик (Crick) Фрэнсис Харри Комптон (р. 1916) - английский физик. Окончил Лондонский университет (1937), основные работы посвящены изучению структуры нуклеиновых кислот. Один из основоположников молекулярной биологии.
Уилкинс (Wilkins) Морис Хью Фредерик (р. 1916), английский биофизик. Окончил Кембриджский университет. Получил высококачественные рентгенограммы ДНК, на основе которых установлена ее пространственная структура.
Уотсон (Watson) Джеймс Дьюи (р. 1928) - американский биохимик. Получил образование в Чикагском университете и университете штата Индиана, основоположник молекулярной биологии. Основные работы посвящены биосинтезу белка и изучению структуры ДНК.
Чаргафф (Chargaff) Эрвин (р. 1905) – американский биохимик. Окончил венский университет( 1928). С 1935- в Колумбийском университете в Нью-Йорке. Основные работы - по изучению химического состава и структуры нуклеиновых кислот, определил
соотношение азотистых оснований в составе ДНК. Правило Чаргаффа было использовано Уотсоном и Криком при составлении модели структуры.ДНК.
Дополнительная информация для любознательных !
Производные пурина – азотистые основания и их метаболиты
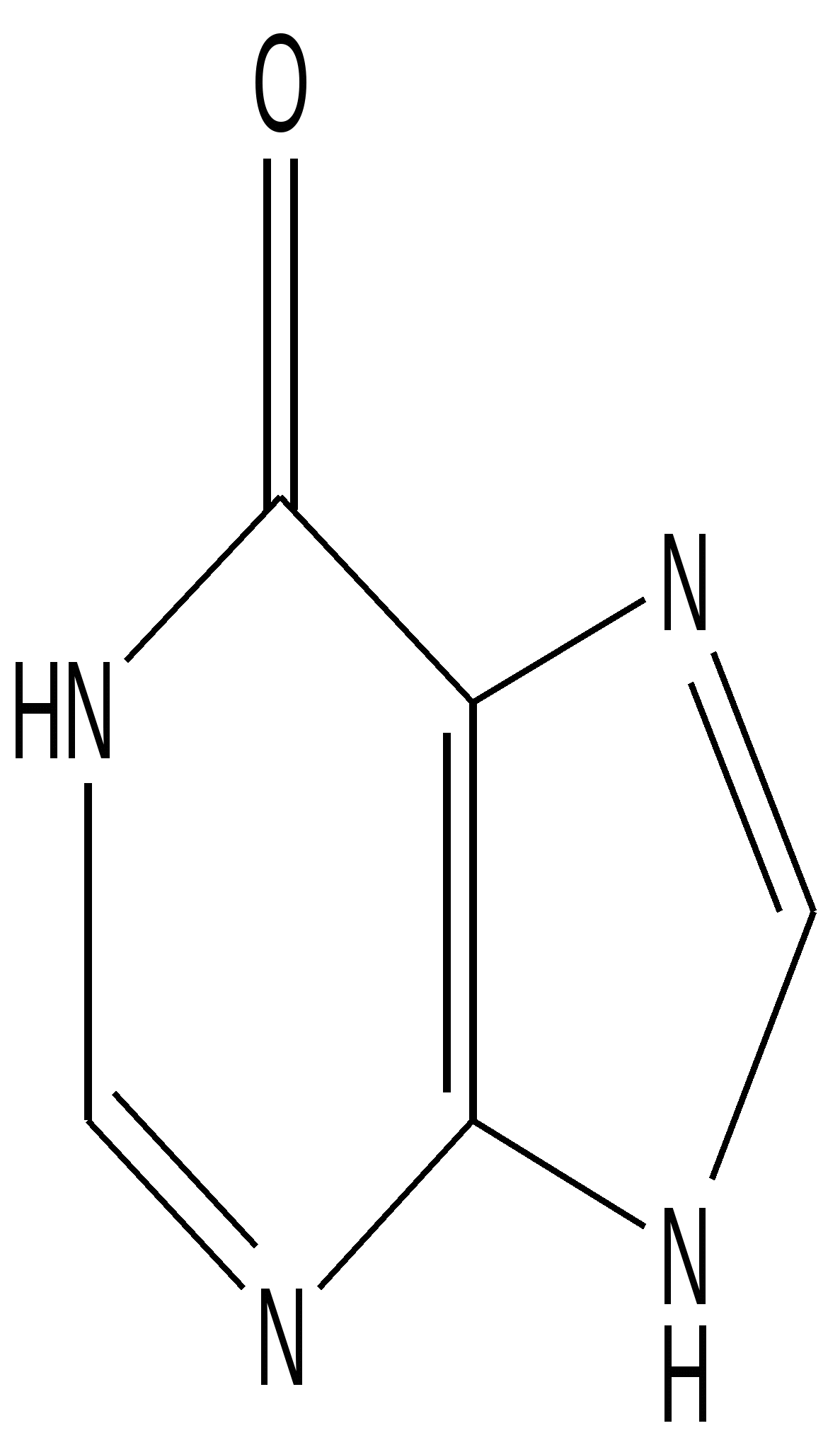
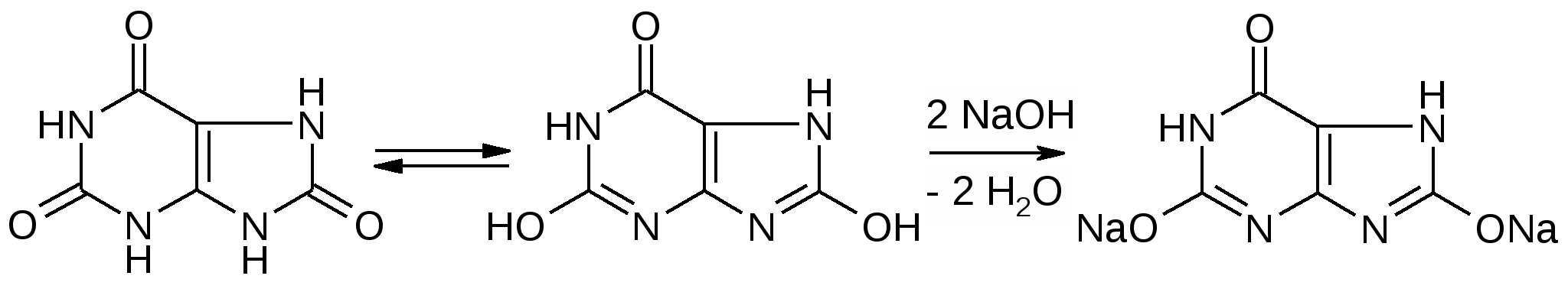
Пуриновые основания – природные вещества, производные пурина, различающиеся заместителями в пуриновом цикле. В природе наиболее распространены аденин, гуанин, гипоксантин, ксантин, мочевая кислота - конечный продукт обмена пуриновых оснований.
Метилированные производные ксантина встречаются в чае, кофе( теофиллин, теобромин, кофеин).
Пуриновые основания- бесцветные кристаллические вещества, высокие т.пл. часто с разложением.
Растворимость в воде убывает в ряду :
Аденин > гипоксантин > ксантин > гуанин > мочевая кислота /
Легко рстворимы в кислотах и щелочах с образованием солей.
Аденин – С5 Н5 N5 , 6- аминопурин - бесцветные кристаллы, т. пл. 360 – 3650 С. (разлагается) Плохо растворим в холодной воде и спирте, хорошо в горячей, растворим в кислотах и щелочах. Обладает основными свойствами. рКа аминогруппы-4,15.Может образовывать соединения с кислотами, основаниями, солями.
Аденозин- С10 Н13N5 О4 ( 9-ß-D-рибофуранозилоаденин) – N- гликозид, состоящий из D-рибозы и аденина., бесцветные кристаллы, т.пл 2290 С, легко растворим в воде, нерастворим в большинстве неорганических растворителей. Является слабым основанием,
рКа аминогруппы-3,5. при кислотном гидролизе распадается на аденин и D- рибозу.
Аденозинмонофосфат, АМФ. Известны три изомера: 5'-- АМФ, 3'- АМФ, 2 ' -АМФ.
Растворимы в воде, нерастворимы в органических растворителях. Соли, образованные активными щелочными и щелочно-земельными металлами, растворимы в воде, а тяжелыми- нерастворимы.
В щелочной среде гидролизуется фосфатная связь, труднее у 5'—АМФ по сравнению с другими изомерами, в кислой среде происходит гидролиз гликозидной связи.
Аденозиндифосфат, АДФ. АДФ и ее соли щелочных металлов хорошо растворимы в воде, нерастворимы в органических растворителях. Соли щелочно-земельных металлов плохо растворимы в воде, а тяжелых металлов – нерастворимы. При щелочном гидролизе легко отщепляется концевой фосфат. Оставшаяся фосфатная группа гидролизуется значительно труднее. Связь между фосфатами в АДФ относится к макроэргическим.
Гипоксантин С5 Н 4 N 4 O – бесцветные кристаллы. Разлагается при температуре 1500 С.
Плохо растворим в холодной воде, хорошо - в горячей, кислотах, щелочах. Амфотерен.
Характерна лактим-лактамная таутомерия (в обоих формах положение атома водорода Н7).
Гуанин С5 Н5 N5 O . Кристаллы, т. пл. 3650 С ( разложение).
Не растворим в воде. Слабо растворим в спирте, эфире, аммиачных растворах. Хорошо растворим в кислотах и щелочах, с которыми образует соли. Осаждается из растволра пикриновой и метафосфорной кислотами. В среде НС1 флуоресцирует.
Входит в состав чешуи рыб. Применяют для синтеза пуриновых алкалоидов( кофеина, теофиллина, теобромина)
Ксантин С5 Н4 N4 O2 - , бесцветные кристаллы в форме чешуек или пластинок, разлагаются при температуре около 1500 С. частично возгоняются. Растворимость в воде : 0, 008 г/ 100 мл воды при 17 0 С, 0,018 г при 400 С, легко растворим в щелочах.
Флуоресцирует. Обладает слабыми основными свойствами, образует соли с сильными кислотами, которые легко гидролизуются.
Устойчив к кипячению в разбавленной щелочи, окисляется раствором КМпО4 .применяют для получения кофеина, теобромина.
Обладает сильным диуретическим действием.
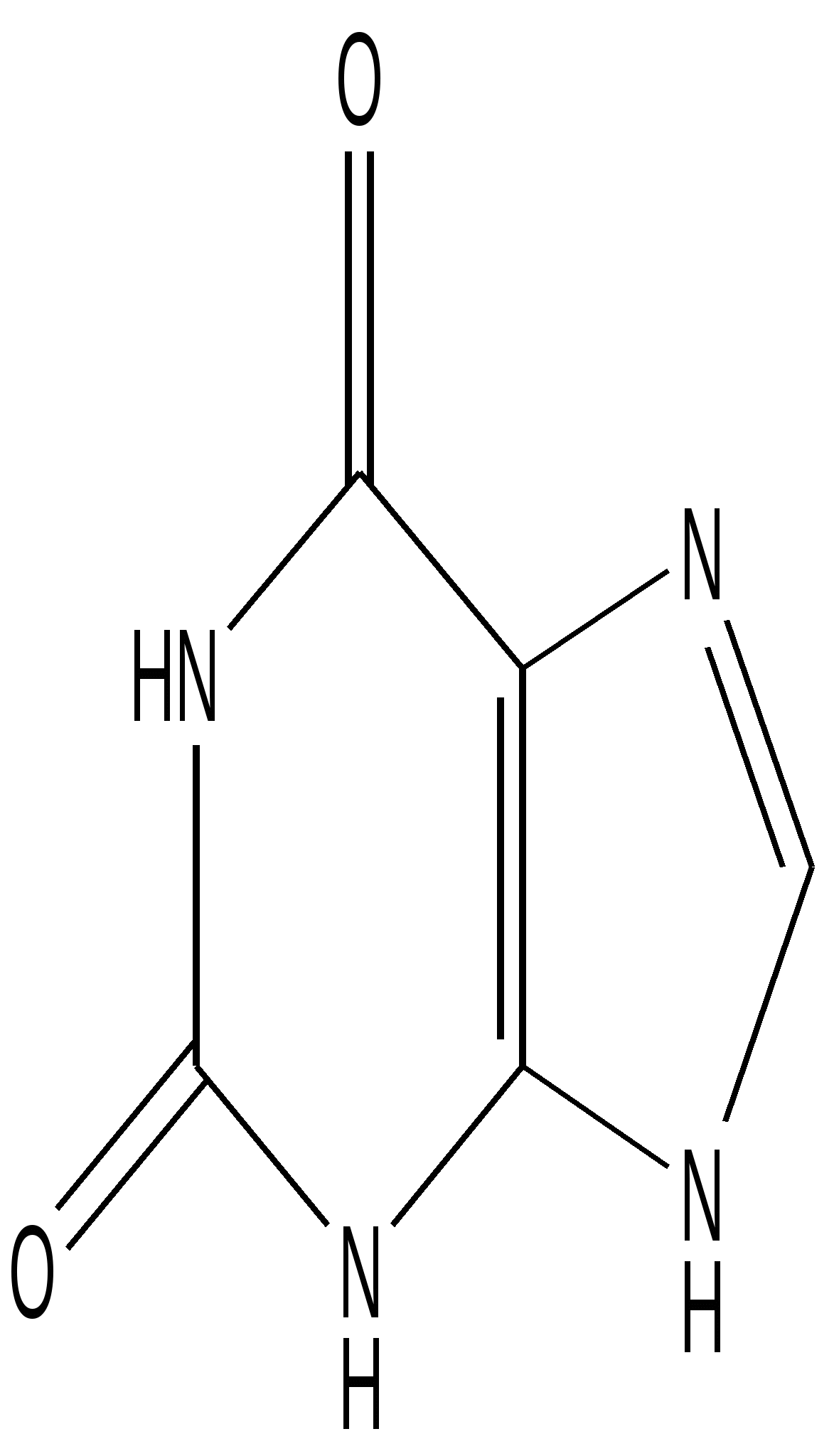
Мочевая кислота- С5 Н4 О 3 N 4 – бесцветные кристаллы. Разлагается ниже температуры плавления. Плохо растворима в воде: 6, 45 мг / 100 мл воды при 370С, спирте, эфире, растворима в глицерине. Существует в двух таутомерных формах- енольной( как двухосновная кислота) и кетонной. Равновесие сильно сдвинуто в сторону кетонной формы. У человека мочевая кислота конечный продукт обмена пуринов, но у животных она превращается в аллантоин под влиянием фермента уриказы.
Двузамещенные ураты щелочных металлов легко растворимы в воде, однозамещенные – трудно, исключение составляет соль лития. При окислении в нейтральном или щелочном растворе разрушается пиримидиновое кольцо и образуется аллантоин.
При нарушении обмена веществ (подагре) или приеме препаратов кофеина образование мочевой кислоты в организме резко возрастает. Камни почек и мочевого пузыря состоят из мочевой кислоты или солей уратов. Для их растворения применяют соли лития, которые переводят нерастворимые мочевую кислоту и ураты в растворимые соединения лития.
Производные пиримидина – азотистые основания и их метаболиты
Пиримидин – С4 Н4 N2 – соединение класса диазинов, гетероциклическое ароматическое соединение. Бесцветные кристаллы с наркотическим запахом,
т пл 210 С., легко растворим в воде, эфире, спирте. Очень слабое однокислотное основание. Образует соли - сульфат, нитрат, перхлорат, пикрат, соль с хлоридом железа (3). Трудно вступает в реакции электрофильного замещения, активность атомов углерода убывает в порядке С 5 > С 4 > С2 .
Пиримидиновые основания (У, Т, Ц)
Бесцветные кристаллические вещества, высокие температуры плавления( часто с разложением), плохо растворимы в воде, но лучше пуриновых оснований.
Растворимость убывает в ряду:
пиримидин > цитозин > тимин > урацил > оротовая кислота
Растворимы в щелочах, образуют хорошо кристаллизующиеся соли- пикраты.
Характерна лактим-лактамная таутомерия.
Окисляются раствором КМпО4, пероксидом водорода, озоном.
Из биологического материала пиримидиновые основания получают кислотным гидролизом (12 Н хлорная кислота, конц. муравьиная кислота) нуклеиновых кислот, нуклеотидов, нуклеозидов.
Введение в организм неприродных аналогов вызывает серьезные нарушения метаболических процессов (конкурентное действие, антиметаболиты), например,
аллоксан , близкий по строению к урацилу, вызывает у животных в эксперименте аллоксановый диабет. Его часто используют биохимики и физиологи в научных исследованиях нарушений обмена веществ, создавая экспериментальную модель диабета.
Многие производные обладают выраженным лекарственным действием :
- тиоурацил используют для лечения гиперфункции щитовидной железы
- производные барбитуровой кислоты используют в качестве снотворных, противосудорожных средств
- 5-фторурацил – противоопухолевое средство
- оротат калия – источник иона калия, метаболит- предшественник У,Т, Ц.
- 6- метилурацил- средство, стимулирующее лейкопоэз.
Оротовая кислота- С5 Н4 N2 О4 ( 2,6 – диоксопиримидин-4-карбоновая кислота), слегка кислые на вкус бесцветные кристаллы, из воды кристаллизуется в виде моноаква комплекса, при т. 130 0 теряет молекулу воды. Растворима в воде( 1г/ 550 мл при 180 ),
трудно в органических растворителях. Карбоксильная группа не отщепляется даже при длительном кипячении в 20% серной кислоте при 2000 .
Тимин - С5 Н6 N2 О2 ( 5- метилурацил, 5-метил-2,6-диоксопиримидин). Растворяется в кислотах и щелочах. Хорошо растворим в горячей воде, плохо в спирте, эфире.
Характерна лактим-лактамная таутомерия. Образует соли с металлами. При алкилировании солей получаются N- и О- алкильные производные.
Урацил – С4 Н4 N2 О2 ( 2, 6 -диоксопиримидин) - бесцветные кристаллы, лучше растворим в горячей воде, плохо в спирте.
Характерна лактим- лактамная таутомерия, но в лактимной форме имеет только одну константу ионизации.
Цитозин С4 Н5 N3 О- (2-оксо-6-аминопиримидин), бесцветные кристаллы, растворимость в воде 0.77 г /100 мл при темп.25о.Обладает основными свойствами, образует соли с кислотами и металлами. При действии азотистой кислоты превращается в урацил
ЛЕКЦИЯ 12
СИНТЕТИЧЕСКИЕ БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА-
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
Содержание лекции
12.1 Современная концепция создания биоорганических соединений –
лекарственных препаратов
- особые химические требования к лекарственному веществу
- особые биологические требования к лекарственному веществу
- пути поиска и создания лекарственного препарата
- классификация лекарственных веществ
12.2. Синтез, химические и физические свойства лекарственных препаратов
12.1. Производные 4-аминобензойной кислоты
12.2.2. Производные 4-аминобензолсульфокислоты
12. 2.3. Лекарственные средства, производные салициловой кислоты
12.2. 4. Лекарственные средств, производные 4 –аминофенола
12. 2 5. Лекарственные средства на основе пиридинкарбоновых кислот
12. 2.6. Производные пиримидина
2. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
12. 3. Приложение ( к истории открытия анестезина., аспирина).
Исходный уровень знаний для усвоения темы:
Химические свойства ароматических карбоциклических соединений: производных фенола, анилина, бензойной кислоты, механизмы реакций SE , SN , строение пяти- и шестичленных ароматических гетероциклических соединений, лактим-лактамная таутомерия.
Ключевые слова к теме:
адреналин, 4-аминобензойная кислота , 4-аминофенол, антиметаболит, аскорбиновая кислота ( витамин С ) , аспирин ( ацетилсалициловая кислота), барбитураты, витамин А , кофеин, парацетамол, противоопухолевые алкилирующие препараты, сульфаниламиды, теобромин, теофиллин, фенацетин.
12.1 Современная концепция создания биоорганических соединений –
лекарственных препаратов
Создание лекарственного вещества объединяет усилия множества людей и требует
соединения различных наук : органической, фармацевтической химии , фармакологии, использования современных достижений нано- , био – и химических технологий.
Лекарственные синтетические вещества- соединения, применяемые для лечения или профилактики заболеваний, полученные химическим путем ( в последнее время стали использовать методы биотехнологий )
История развития химии лекарственных соединений насчитывает сотни веков, тысячи лет. Уже в древних китайских, тибетских., египетских , античных греческих текстах упоминаются лечебные средства, которые были основаны на использовании природных
источников растительного или животного происхождения. Часть из них выдержали проверку временем и дошли до наших дней : отвары, экстракты, настойки составляют до 30% общего числа лекарственных препаратов. Первые индивидуальные природные соединения( чистые химические вещества) стали выделять в начале ХIХ века.
В 1803 г из мака был выделен морфин, позднее кофеин из кофе, какао, чая и ореха кола.
Одновременно с развитием органической химии появились синтетические вещества, обладающие фармакологическим ( лекарственным ) действием.
В настоящее время насчитывается более 3000 синтетических органических лекарственных соединений.
12.1.1. Особые химические требования к лекарственному веществу
Лекарственное вещество должно быть
высокочистым и не содержать примесей посторонних веществ, которые могут возникнуть в процессе синтеза или очистки.
содержать только определенную изомерную форму ( смесь энантиомеров или диастереомеров недопустима)
стабильным и не изменяться при стандартных условиях хранения.
доступным( пути синтеза должны быть достаточно простыми, иначе стоимость препарата будет очень высокой ).
12.1.2 Особые биологические требования к лекарственному веществу
Лекарственное вещество должно обладать
высокой активностью
избирательностью действия
низкой токсичностью ( также не должны быть токсичными продукты его превращения в организме человека )
12.1.3. . Пути поиска и создания лекарственных препаратов
На пути поиска лекарственных препаратов можно выделить несколько направлений.
1. Использование природных веществ и их аналогов.
Первый этап – выделение биологически активных веществ ( биологически активного на-
чала) из природных источников и затем осуществление химического синтеза этих веществ.
Второй этап-получение различных производных природных соединений и исследование их биологического действия с целью нахождения более активных.
2. Метод скринига( отсеивания).
Возможны два варианта скрининга , и они оба используются равноценно.
а) Вновь синтезированное соединение исследуют на различные виды биологической активности: противовирусную, противомикробную, противогрибковую, противоопухолевую, антимитотическую, противолучевую, действие анаболическое, психотропное и др.
При выявлении действия определенного направления начинают синтез гомологов и производных данного соединения для создания наиболее активного препарата с нужными свойствами и выявления механизма биологической активности.
б) Выбирают определенное направление биологической активности ( см. перечисление) и исследуют десятки, сотни органических соединений различных классов . Выбирают наиболее активные, вновь начинают синтез гомологов и производных данного соединения для создания наиболее активного препарата с нужными свойствами и выявления механизма биологической активности.
На современном этапе развития химии лекарственных соединений накоплены опытные и теоретические данные, которые позволяют создать научную теорию целенаправленного синтеза лекарственных препаратов с заданными свойствами, широко используется метод компьютерного моделирования.
Наибольшее развитие получили три принципа создания лекарственного препарата:
1. Заместительный - лекарственный препарат используют для восстановления или компенсации нарушений в организме:
- препараты- кровозаменители при кровопотере
- пищеварительные ферменты животного происхождения при снижении или
отсутствии секреции собственных ферментов желудочно-кишечного тракта
2. Антиметаболический..
Антиметаболит –это синтетический лекарственный препарат, структурно близкий к естественному метаболиту организма. Его задача состоит в замене( подмене) метаболита в тех биохимических реакциях , которые возникают при развитии патологического процесса.. Действие антиметаболита сопровождается блокированием
биохимических реакций и прекращением развития патологического процесса.
Создать антиметаболит можно несколькими путями:
1. Ввести в природное вещество активные группировки, природный метаболит транспортирует группировку к месту назначения, а там группа вступает в химическую реакцию, связывая важные участки белков –ферментов, рецепторов мембран, нуклеиновых кислот. Принцип нашел широкое применение при создании противоопухолевых препаратов, в их составе присутствует бис-β-хлорэтиламино – группировка, участвующая в реакции алкилирования по механизму нуклеофильного замещения ( препарат сарколизин представляет собой производное аминокислоты фенилаланина. Методика его промышленного производства разработана в Екатеринбурге( Свердловске) в УГТУ-УПИ на кафедре технологии органического синтеза химико-технологического факультета в 60-70 годы ХХ века.).
Сарколизин
С1 — СН2 —-CН2—N - С6 Н4 - СН2 -СН - СООН
| |
С1 – СН2 – CН2 NН2
бис-β-хлорэтиламино – группировка
( дихлорэтиламинная группировка)
2. Синтезировать изомер биологически активного соединения или заменить функциональную группу. Например, удаление метильных групп в витамине В2 сопровождается исчезновением биологической активности. Лекарственный препарат 5-фторурацил является одновременно антиметаболитом урацила ( атом фтора вместо атома водорода) и тимина ( атом фтора вместо метильной группы). Обширную группу антиметаболитов представляют собой сульфаниламидные препараты.
12.1.4 Классификация лекарственных веществ
Классификации лекарственных веществ по единому принципу не существует.
Выделяют
- по фармакологическому принципу ( по лекарственному эфекту-снотворные,
обезболивающие )
- по механизму действия на молекулярном ( клеточном) уровне
- по физиологическому значению( гормональные, витаминные препараты и т.д.)
-по лечебному применению( противотуберкулезные, противоопухолевые)
- по химическому принципу (строение, состав). Именно эта классификация
используется биоорганической химией.
12.2 Синтез, химические и физические свойства лекарственных соединений
12.2.1. Производные 4-аминобензойной кислоты
4-аминобензойная кислота- твердое бесцветное кристаллическое вещество. имеет высокую для органического соединения температуру плавления 187 0 С,. мало растворима в воде. Образует соли при действии сильных оснований и кислот – соединение обладает амфотерными свойствами, значение рКа. = 4,92.
Обладает биологической активностью – представляет собой ростовой фактор микроорганизмов, входит в состав фолиевой кислоты, витамина для организма человека. Фолиевая кислота в составе ферментов участвует в синтезе пуринового цикла аденина и гуанина. Недостаток фолиевой кислоты у человека сопровождается развитием анемии.
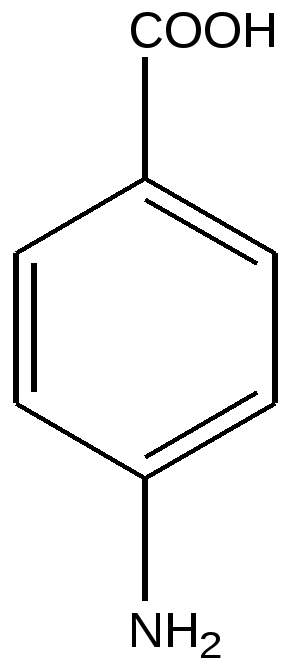 4-аминобензойная кислота
4-аминобензойная кислотаВитамины ( лат. Vita –жизнь, жизненно важные амины)-низкомолекулярные вещества органической природы, необходимые для осуществления жизненно важных биохимических процессов в живых организмах. Как правило, большинство витаминов не синтезируется в клетках организма человека и должны поступать в готовом виде с пищей.
На основе 4-аминобензойной кислоты получены противотуберкулезные препараты, анестетики и ее антиметаболитом является 4-аминосульфаниловая кислота.
Обезболивающие препараты- анестетики
Обезболивающие, анестезирующие препараты, анестетики ( греч- anaisthesia – бесчувственность) производные 4-аминобензойной кислоты относятся к эффективным препаратам местного действия, подавляют чувствительность( возбудимость) нервных окончаний.
Их открытие позволило заменить в клинике алкалоид кокаин, применение которого сопровождалось развитием болезненного привыкания к этому соединению, вплоть до состояния наркомании.( см. лекцию «Алкалоиды») Наиболее известными являются соединения анестезин, новокаин, дикаин. Это бесцветные твердые кристаллические вещества, плохо растворимые в воде. хорошо в спиртах.
Лекарственное действие связывают с наличием фармакофорной- анестезиоформной - группировки, которая также имеется в кокаине( см. лекцию « Алкалоиды»)
— N– ( C )n –Х – C ( О) – А r А r -ароматический радикал
Анестезиоформная группировка
Синтез препаратов- анестетиков заключается в реакции этерификации 4-аминобензойной кислоты
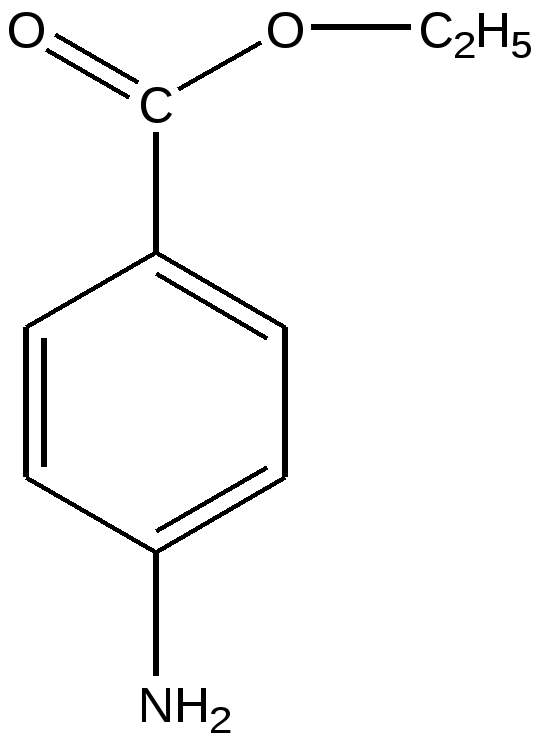
Анестезин – этиловый эфир 4-аминобензойной кислоты получают этерификацией 4-аминобензойной кислоты этиловым спиртом.
Н+
NH2 - C6 H4 – COOH + С2 Н5— ОН———> NH2 - C6 H4 – COO–С2 Н5 + НОН
Анестезин
Новокаин можно получить путем реакции переэтерификации анестезина
Н+
NH2 -C6 H4 – COO–С2 Н5 + НО –СН2 –СН2- N ( С2 Н5 )2 ———>
2-( N, N –диэтиламино)этанол -1
NH2 - C6 H4 – COO –СН2 –СН2- N ( С2 Н5 )2 + С2 Н5 ОН
новокаин
 Анестезин | 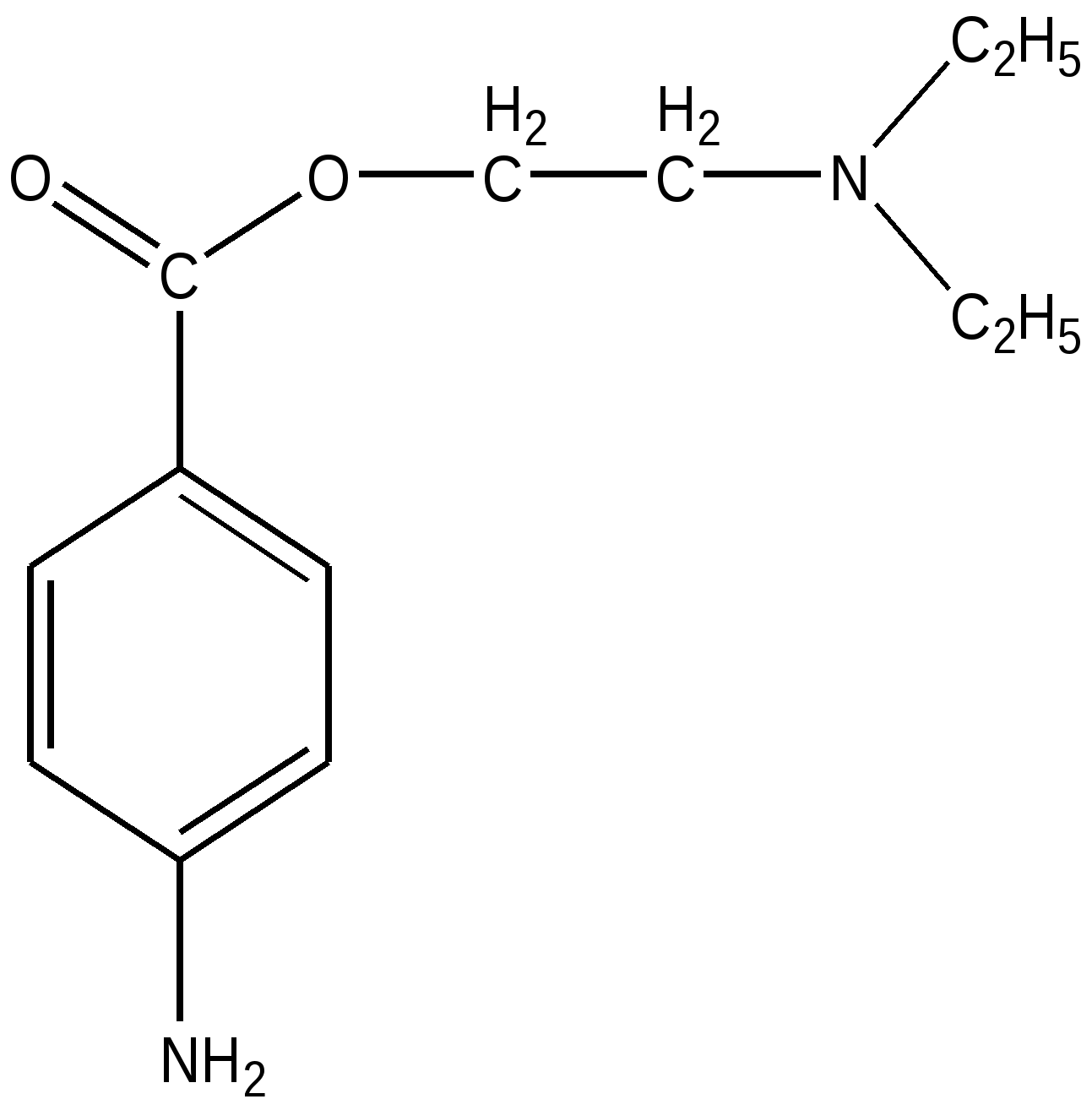 Новокаин |
Дикаин синтезируют алкилированием 4– аминобензойной кислоты 1- хлорбутаном и последующей этерификацией.
NH2 -C6 H4 – COO Н + С1- С4 Н 9 ———> С4 Н 9- NH- C6 H4 – COOН
- НС1
+ НО –СН2 –СН2- N ( С2 Н5 )2 , Н+
————————————> С4 Н 9- NH- C6 H4 – COOСН2 –СН2- N( С2 Н5 )2 ,
дикаин
В новокаине и анестезине присутствует первичная ароматическая аминогруппа., а в дикаине – вторичная .
Анестезин, новокаин, дикаин имеют отличия фармакологического действия, у анестезина и новокаина это связано с отличиями в строении сложноэфирной группы, а у новокаина и дикаина – с присутствием у дикаина алкильного бутильного радикала, который усиливает липофильные свойства, способствует транспорту и связыванию с рецептором мембраны.
Вышеназванные анестетики плохо растворимы в воде, их применяют в виде хлороводородной соли, которая одновременно усиливает анестезирующее действие. Аминогруппа боковой цепи обладает большей основностью по сравнению с аминогруппой бензольного цикла При образовании соли возникает структурное подобие с ацетилхолином, медиатором нервной системы ( сходные фрагменты выделены)
NH2 - C6 H4 – COO –СН2 –СН2- N ( С2 Н5 )2 + НС1 ———>
NH2 - C6 H4 – COO –СН2 –СН2- N+ ( С2 Н5 )2 ] C1––
|
Н
соль новокаин гидрохлорид
СН3 – СОО –СН2 –СН2- N+ ( СН3 )3 ] С1––
ацетилхолин хлорид
12.2.2. Производные 4-аминобензолсульфокислоты
4-аминобензолсульфокислота ( п-сульфаниловая кислота)- твердое кристаллическое
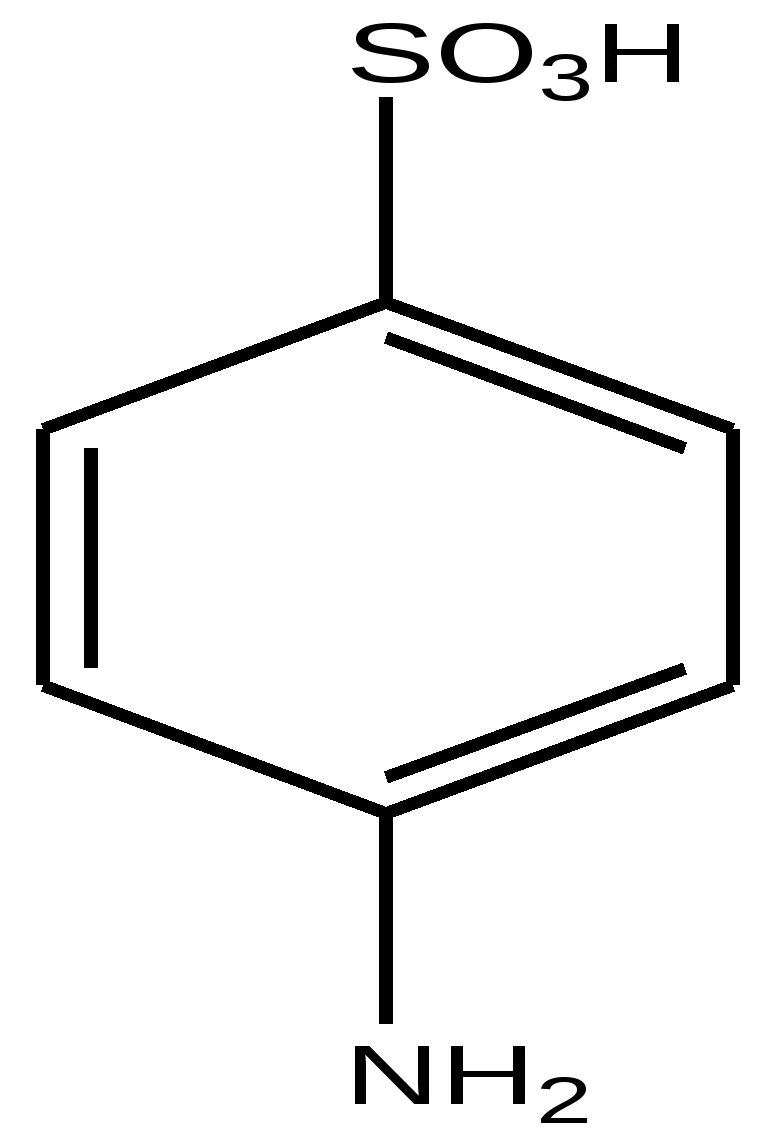
вещество, хорошо растворима в воде, не растворима в органических растворителях. Образует внутреннюю соль- биполярный ион, аминогруппа превращается в аммонийную.
 + –
+ – NH3— - _ SJ —SO3
NH3— - _ SJ —SO3Поэтому сульфаниловая кислота не образует по аминогруппе соли с неорганическими кислотами, не алкилируется и не ацилируется в отличие от п-аминобензойной кислоты. Образует соли с основаниями, эти соли хорошо растворимы в воде , аминогруппа в соли теряет положительный заряд и может алкилироваться и ацилироваться.
+ – ОН -
NH3—С 6Н4—SO3 ——— —> NH2 — С 6Н4 —SO3–
Однако замещение в аминогруппе сопровождается полным исчезновением лекарственных свойств
4-Аминобензолсульфокислота и 4-аминобензойная кислота сходны по размерам молекул ( соответственно длина 0, 69 и 0,67 Å ), и основности аминогрупп, и эти сходства лежат в основе проявления лекарственной активности - производные п-сульфаниловой кислоты являются антиметаболитами п-аминобензойной кислоты и далее фолиевой.
Синтез сульфаниламидных препаратов
Толчком к синтезу сульфаниламидных препаратов стало излечение в 1933 году пациента со стафилококковой септицемией. Он был спасён препаратом, запатентованным под названием «пронтозил» в 1932 году( известен также как «красный стрептоцид»). В 1935 году установлено, что «пронтозил» invivo превращается в п-аминобензолсульфамид.
 NH2 O O
NH2 O O




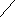
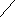
 in vivo
in vivoН











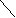

 2N N = N S NH2 Н2N S NH2
2N N = N S NH2 Н2N S NH2 O O
пронтозил п-аминобензолсульфамид
В 1932 – 1934 г.г. немецкий учёный Домагк синтезировал сульфаниламидные препараты из 4-аминобензолсульфокислоты

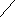
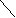
N


 H2 SO3H сульфаниламидные препараты
H2 SO3H сульфаниламидные препараты
4-аминосульфокислота
В настоящее время общим методом получения сульфаниламидных препаратов является реакция: