Курс лекций по биоорганической химии. Курс лекций по биоорганической химии учебное пособие для студентов 1 курса очного обучения
 Скачать 4.37 Mb. Скачать 4.37 Mb.
|
|
Часть из перечисленных выше соединений была введены в медицинскую практику, и хотя некоторые препараты имели перед аспирином преимущество (особенно при лечение ревматизма), ни один из них никогда не завоевал столь широкой популярности ЛЕКЦИЯ 13 АЛКАЛОИДЫ. ВИТАМИНЫ Содержание лекции 13.1 Номенклатура алкалоидов 13.1 Классификация алкалоидов 13.2 Функции алкалоидов 13.3 Содержание в растениях 13.4 Качественные реакции обнаружения алкалоидов 13.5 Фармакологическая активность – общий взгляд 13.6 Отдельные представители 13.7.1 Алкалоиды группы фенилэтиламина - Тирамин - Эфедрин и псевдоэфедрин - Мескалин 13.7.2 Производные пяти – и шестичленных гетероциклических соединений - Никотин - Анабазин - Морфин, кодеин, героин 13.7.3 Группа тропана - Атропин - Кодеин 13.8. Витамины. - Витамин С - аскорбиновая кислота - Витамин РР- никотинамид - Витамин А – ретиналь, ретинол Исходный уровень знаний для усвоения темы: Химические свойства природных аминокислот, пяти- и шестичленных гетероциклических , ароматических карбоциклических соединений, нуклеотидов, макроэргических соединений, механизмы реакций нуклеофильного замещения, окисления, восстановления, строение и свойства синтетических лекарственных препаратов. Ключевые слова к теме Алкалоид, анабазин, аскорбиновая кислота, атропин, витамин, героин, кодеин, никотин, никотиновая кислота, морфин ,тирамин, ретиналь, ретинол. Алкадоиды- азотсодержащие соединения, основания природного, преимущественно, растительного происхождения. ( название «алкалоиды» от позднелат. alcali-щёлочь и греч. eidos-вид). Кроме атомов углерода, водорода, азота содержат атомы кислорода, серы, встречаются галогены. Могут иметь циклическое, полициклическое, лактонное стороение 13.1. Номенклатура алкалоидов Номенклатура алкалоидов не была систематизирована – как из-за сложности соединений так и по историческим причинам. Все названия имеют суффикс -ин и произведены разными путями:
13.2. Классификация алкалоидов Используют несколько различных принципов классификации. 1.Основан на строении углеродно-азотного скелета молекул: -пиридиновые -пиримидиновые -хинолиновые -пирролидиновые -пуриновые - пептидные и т.д.  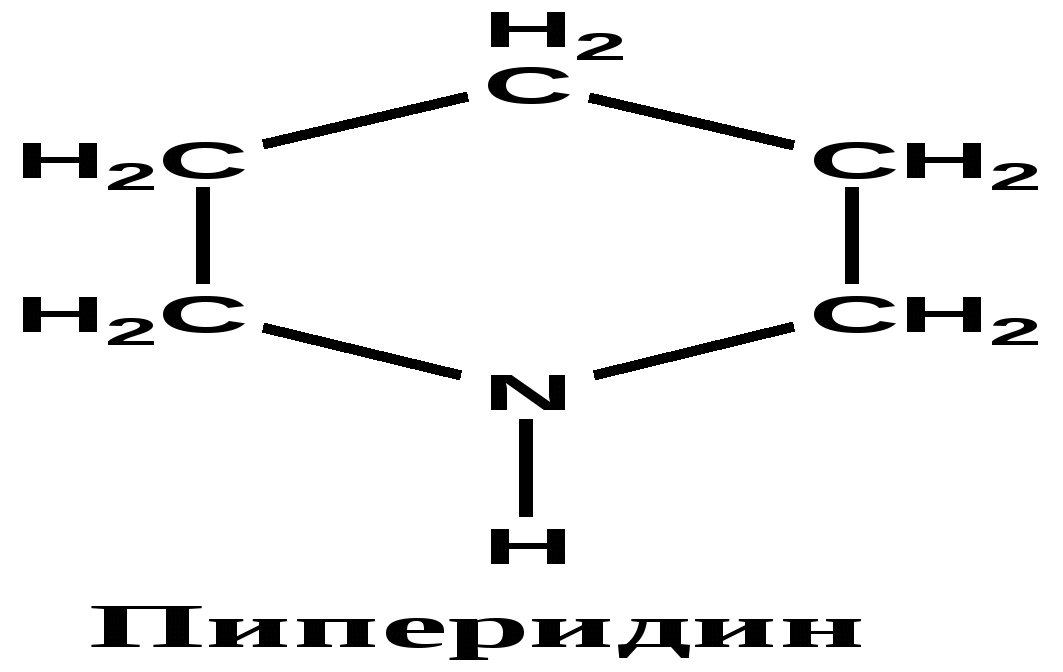 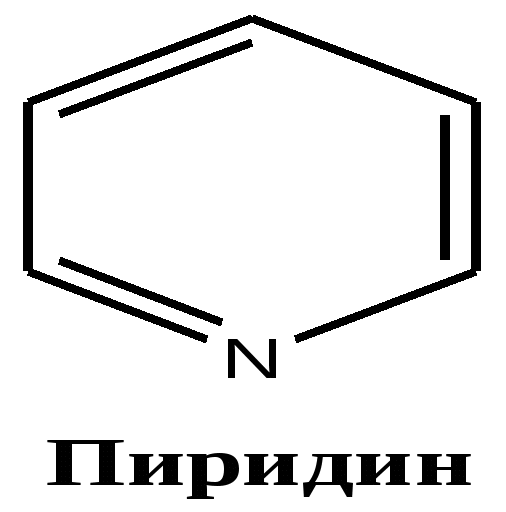  2. По филогенетическому признаку объединяют в одну группу все соединения, выделенные из растений одного рода . Этот принцип часто используют , если строение алкалоида еще не установлено.: -алкалоиды мака - алкалоиды ипекакакуаны - алкалоиды табака - алкалоиды аконита - алкалоиды хинного дерева - алкалоиды спорыньи -алкалоиды эфедры - алкалоиды стрихноса (рвотного ореха) 3. Возможна классификация по биогенетическому предшественнику, из которого алкалоиды синтезируются. Например, алкалоиды, предшественником которых является - триптофан - лизин - гистидин - фенилаланин Такая классификация не позволяет точно отнести алкалоид к какой- группе, т. к. в составе соединения может быть несколько предшественников( в никотине содержатся пиридин и пирролидин ) . 4. Используют классификацию по преобладающему физиологическому эффекту действия ( токсическому, лекарственному) Известно несколько тысяч алкалоидов , а их применение в составе настоек, вытяжек из растений, мазей на основе растений, насчитывает тоже несколько тысяч лет. 13. 3. Функции алкалоидов Функции алкалоидов в растениях не вполне понятны. Возможно, алкалоиды • побочные продукты обмена веществ (метаболизма) в растениях;
Каждое из этих объяснений может быть справедливым в конкретных случаях, однако 85–90% растений вовсе не содержат алкалоидов. 13.4. Содержание в растениях Известно более 5000 представителей алкалоидов. Содержание в растениях невелико ( 0,001 – 2 % ), но есть уникальные растения с высоким содержанием до 15-18%( хинное дерево, табак) Чаще алкалоиды локализуются в определенных частях растений( листья, цветы, семена, кора., клубни, корни ). Содержание, структура, соотношение различных алкалоидов одного или разных классов сильно зависит от места произрастания растения, периода вегетации, срока созревания, возраста. Поэтому так ценятся разные сорта кофе, табака, существуют сроки сбора растений. По содержанию одинаковых алкалоидов устанавливают филогенетическое родство растений. Большинство алкалоидов в природных источниках содержится в виде солей с органическими кислотами( бензойной., яблочной и др.) Алкалоидоносные растения распространены в природе - маковые ( Papaverceae ) – мак, опий, чистотел - пасленовые ( Solonaceae ) – табак, дурман, картофель -мареновые ( Rubiaceae ) - ипекакуана , хинная кора Алкалоиды, встречающиеся в одном растении, всегда химически родственны. Сложного строения алкалоиды ( кокаин, хинин, колхицин) содержатся только в определенном виде растений и представляют их характерную особенность. Первый алкалоид морфин был выделен из опия в 1806 г. Сертюрнером. Изучение строения алкалоидов позволило наладить производство их синтетических аналогов. 13.5. Качественные реакции обнаружения алкалоидов Многие алкалоиды при обработке их концентрированной азотной кислотой, серной., хромовой, молибденсерной дают такие интенсивные цветные реакции, которые могут быть применены для обнаружения этих соединений. Избирательность подобных реакций невысока. Алкалоиды образуют соли с ионами металлов серебра, ртути ( реакции осаждения алкалоидов) и с пикриновой кислотой. 13.6. Фармакологическая активность- общий взгляд Изменяется в широких пределах в зависимости от структуры. Среди известных алкалоидов имеются:
Многие алкалоиды, даже будучи сильными ядами, находят применение в медицине. 13.7. Отдельные представители 13. 7.1. Алкалоиды группы фенилэтиламина Эти соединения можно считать природными производными аминокислот фенилаланина и тирозина Тирамин ( 4-гидроксифенилэтиламин) Соединение состава С8 Н11 N О, находится в близкой химической связи с тирозином. Присутствует в гниющем белке , найден в спорынье(Claviceps), омеле, дроке одновременно с N –метилтирамином имеется в некоторых сортах сыра. Твердое кристаллическое вещество, Т плавления 161 0 . Cпорынья паразитирует на злаковых растениях, образуя в завязях растения -хозяина твердые черно-фиолетовые рожки( склероции). Омела ( Vistcum ) небольшие кустарники или травы, паразитирующие на ветвях деревьев, образует мелкие белыеили окрашенные соцветия ( существует примета- счастливый брак освящается ветками омелы). Дрок (Genistra)- семейство бобовых , из некоторых видов извлекали красители желтого цвета. n- НО – С6 Н4 - СН2 – СН2- NН2 n- НО – С6 Н4 - СН2 – СН2- NН-CН3 тирамин N –метилтирамин 1-амино – 2- ( 4-гидроксифенил)этан Тирамин вызывает сильное сокращение матки , суживает периферические сосуды, повышает артериальное давление. С древних времен присутствие спорыньи на злаковых было недопустимо, а омела и дрок считались крайне ядовитыми. Тирамин образуется в реакции декарбоксилирования тирозина в организме человека, если нарушается нормальный путь обмена тирозина, который должен превратиться в дигидроксифенилаланин ( диоксифенилаланин, ДОФА ) Патология обмена тирозина может возникнуть в пожилом возрасте и при заболеваниях печени. Схема обмена фенилаланина и тирозина в клетках человека in vivo в норме Фенилаланин ———> тирозин —Х—> ДОФА ——> дофамин блок превращения В случае нарушения превращения тирозина в ДОФА возникает патологический путь, сопровождающийся реакцией декарбоксилирования : витамин В6 Тирозин —————>тирамин + СО2 Тирамин блокирует образование и действие медиатора дофамина - 2 ( 3, 4 –диоксифенил)этиламина-1, который локализуется в нейронах центральной нервной системы. Развитие болезни Паркинсона и шизофрении связывают с нарушением обмена дофамина, его дефицит наблюдается при алкоголизме. Эфедрин и псевдоэфедрин Представителями этой группы являются два соединения состава С10 Н15 N О - диастереомеры эфедрин и псевдоэфедрин , которые содержатся в растениях семейства эфедровых. (эфедра хвощевая Ephedraequisetina Bunge- от греч. - epi -на, hedra –сидение). Густоветвистый кустарник высотой до 1,5 м. Для сбора лекарственного сырья собирают верхушечные молодые ветви. Химическим «родственником» эфедрина и псевдоэфедрина в биохимических реакциях можно считать аминокислоту фенилаланин. 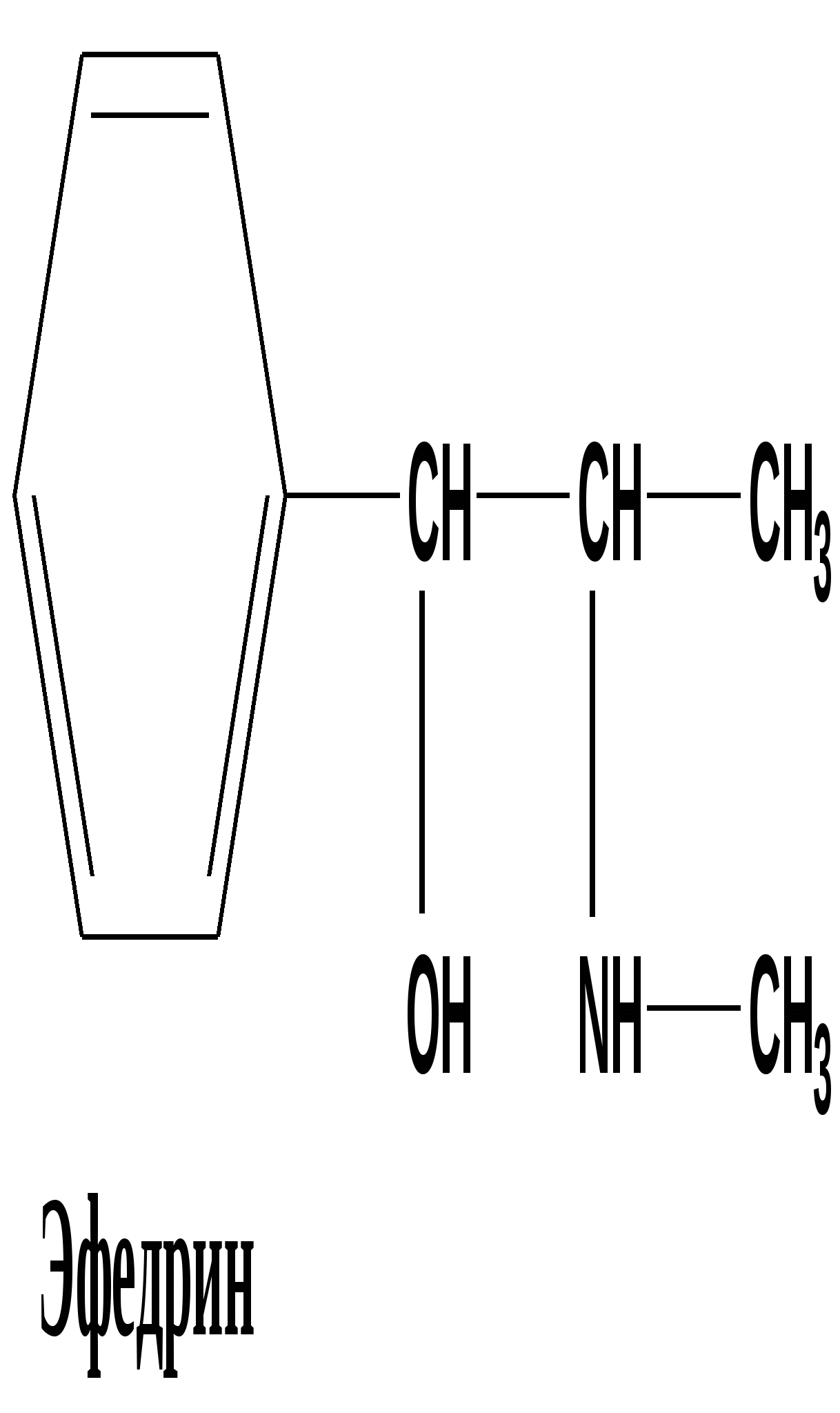 (2-метиламино-1-фенил-1-пропанол) Псевдоэфедрин и эфедрин отличаются конфигурацией одного хирального атома Псевдоэфедрин частично превращается в L -эфедрин при длительном нагревании в 25% растворе хлороводородной кислоты. СН3 СН3 | | Н- С – NН- СН3 Н-С- NН- СН3 | | НО- С-Н Н-С-ОН | | С6 Н5 С6 Н5 псевдоэфедрин (+) L- эфедрин( - ) Т плавления 118 0 Тплавления 700 Эфедрин боковой цепью полностью совпадает с адреналином, но отличается ароматической частью( вспомните формулу адреналина - в бензольном цикле две орто-гидроксильные группы в положениях 3´, 4´ ). 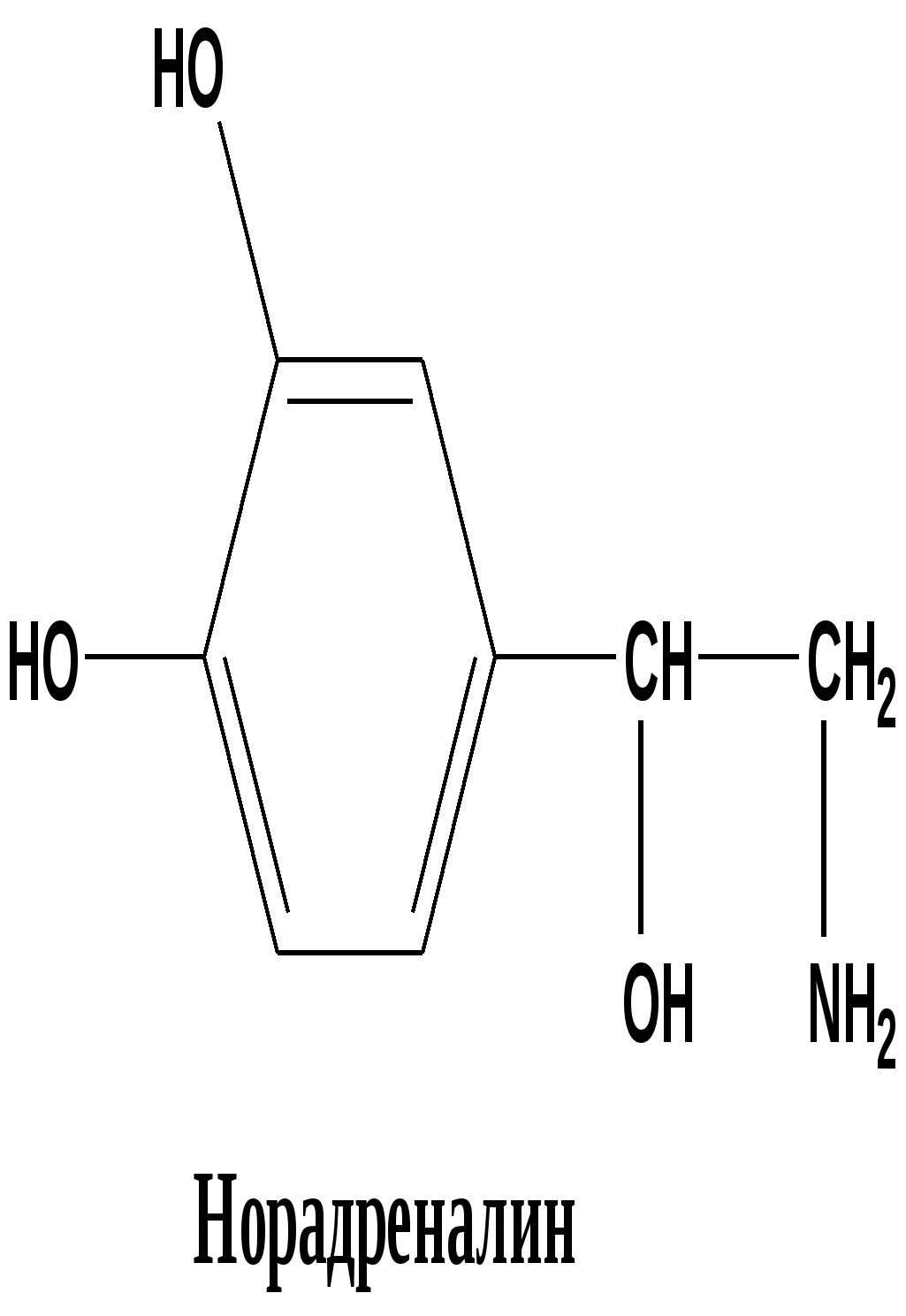 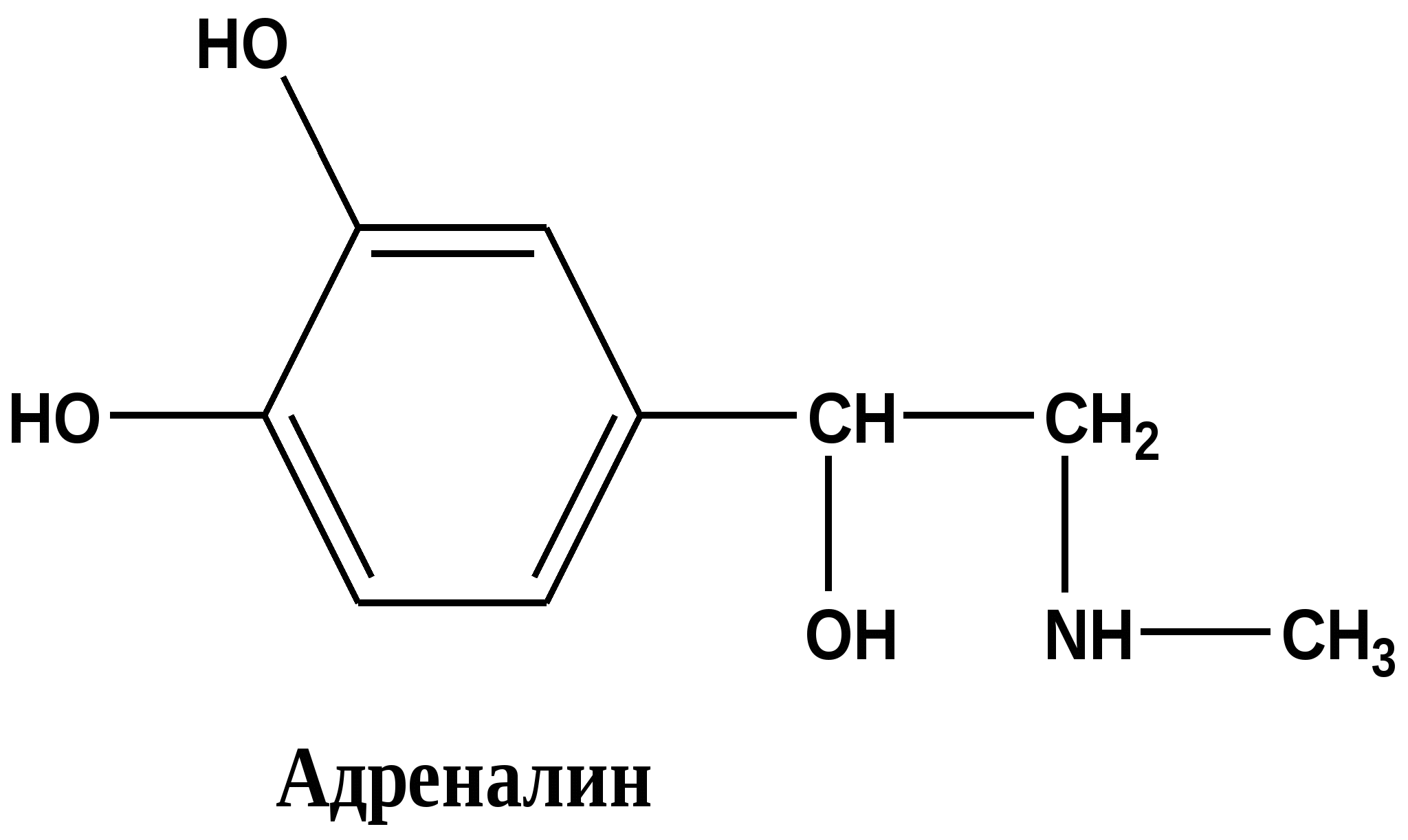 Фармакологическое действие также напоминает адреналин, стимулирует α, β –рецепторы, его применяют при бронхиальной астме, аллергических заболеваниях, гипотонии, морской болезни, отравлении наркотиками. Мескалин Имеет сходное строение с фелилэтиламином, тирамином и ДОФамином (одинаковый боковой радикал).Бесцветная маслянистая жидкость , состав C11H17NO3 Природные источники: кактусы семейства Lophophora williamsii. Обладает сильным галлюциногенным действием. 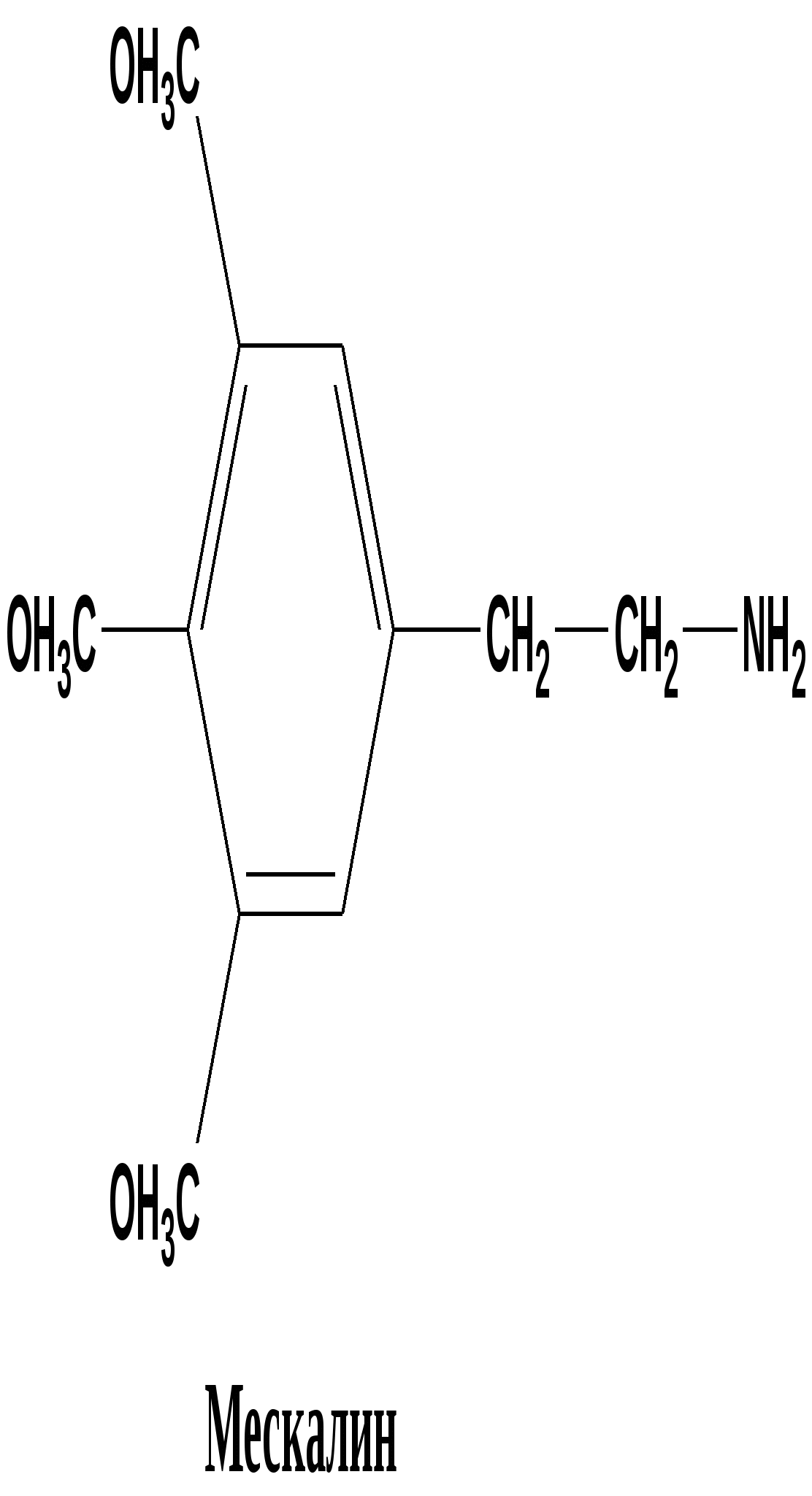
Никотин . Вместе с анабазином содержится в листьях табака- однолетнего растения семейства пасленовых ( Nicotiana tabacum). Растение названо по имени Жана Нико- французского посланника в Португалии, который прислал в 1560 г. семена этого растения во Францию. Листья табака после особой обработки( сушки и ферментации) используют для курения. Содержание никотина достигает( % ) 0,75 -8,0. В родственном растении махорке ( Nicotiana rusticus - лат – rusticus- сельский) в листьях содержится 5-15% никотина, 15-20% лимонной кислоты. мейства пасленовых.ка Никотин открыт ( выделен из листьев табака , очищен, проведен анализ состава) в 1829 г Поссельтом и Рейманом.Состав С10 Н11 N2 , бесцветное масло с запахом табака, хорошо растворимое в воде и органических растворителях.. Знак вращения( -), токсичность L- никотина в 300 раз выше, чем D- изомера. В молекуле никотина содержится два основных центра и образуются соли по обоим центрам. 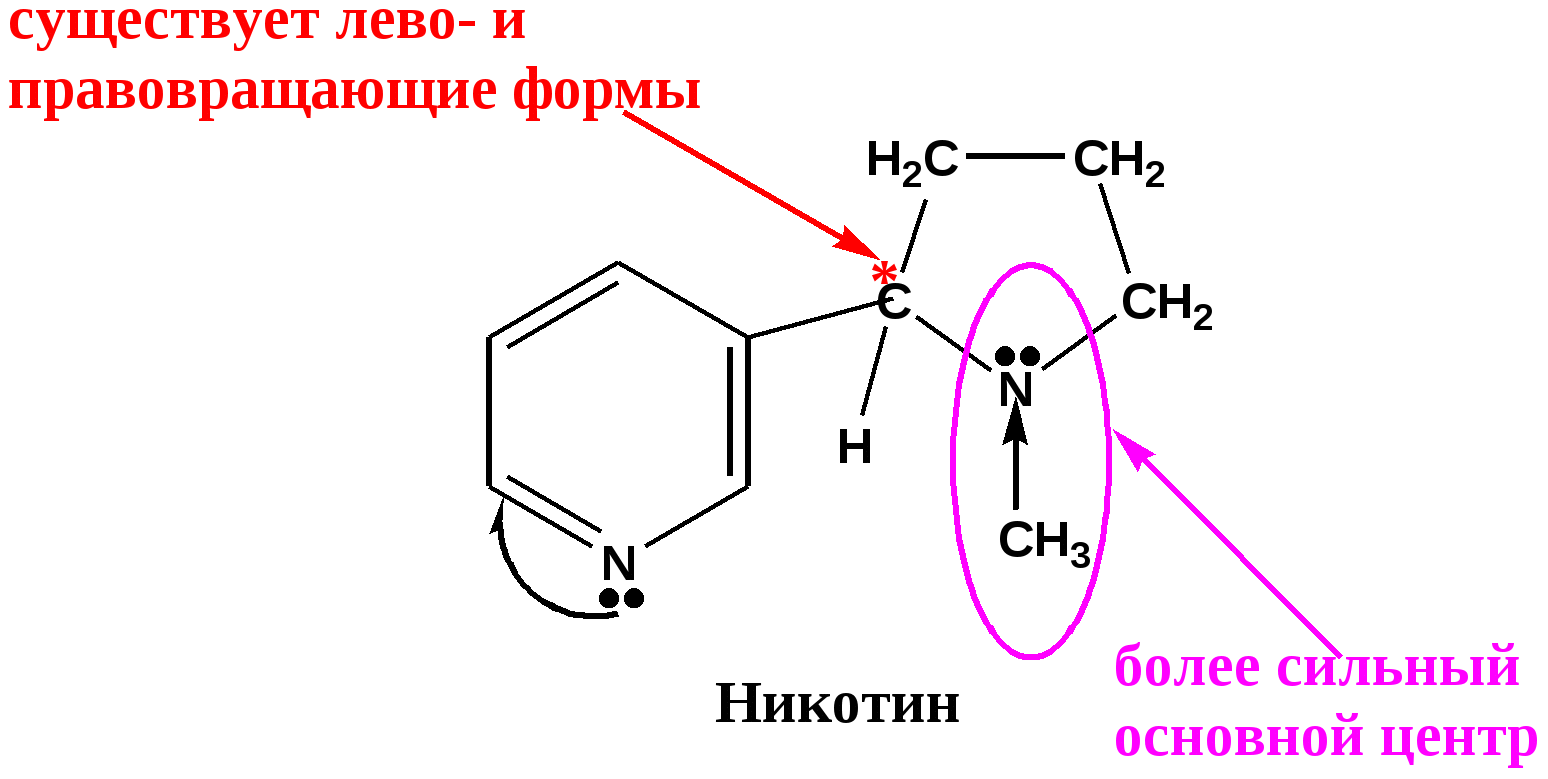 Формула никотина предложена Пиннером и подтверждена реакциями расщепления. Из никотина после обработки хромовой кислотой в мягких условиях образуются в отношении 1:1 никотиновая и L- гигриновая кислота.( N- метил-пирролидин-2-карбоновая кислота) . При жестком окислении происходит более глубокий распад : окисление Никотин ———> никотиновая кислота + СН3 NH2 + НООС-СН 2-СООН метиламин малоновая кислота Два атома азота никотина имеют различные основные свойства: пиридиновый атом , естественно, менее основен, чем третичный атом пирролидинового цикла . При действии одного моль кислоты образуется пирролидиниевый катион.  Никотин превращается в организме человека несколькими путями: образуется более чем в 20 разных метаболитов, которые быстро появляются в моче после курения: А. Происходит окисление атома азота пирролидинового цикла. Б. Происходит окисление и разрыв пирролидинового цикла. В. Происходит удаление метильной группы пирролидинового цикла. Г. Происходит метилирование пиридинового цикла (получается соединение, которое имеет электронное подобие с коферментом НАД+ и, очевидно, может препятствовать реакциям окисления в клетке с участием кофермента НАД+). Главные метаболиты – N-оксид никотина (путь А) и котинин (путь Б). 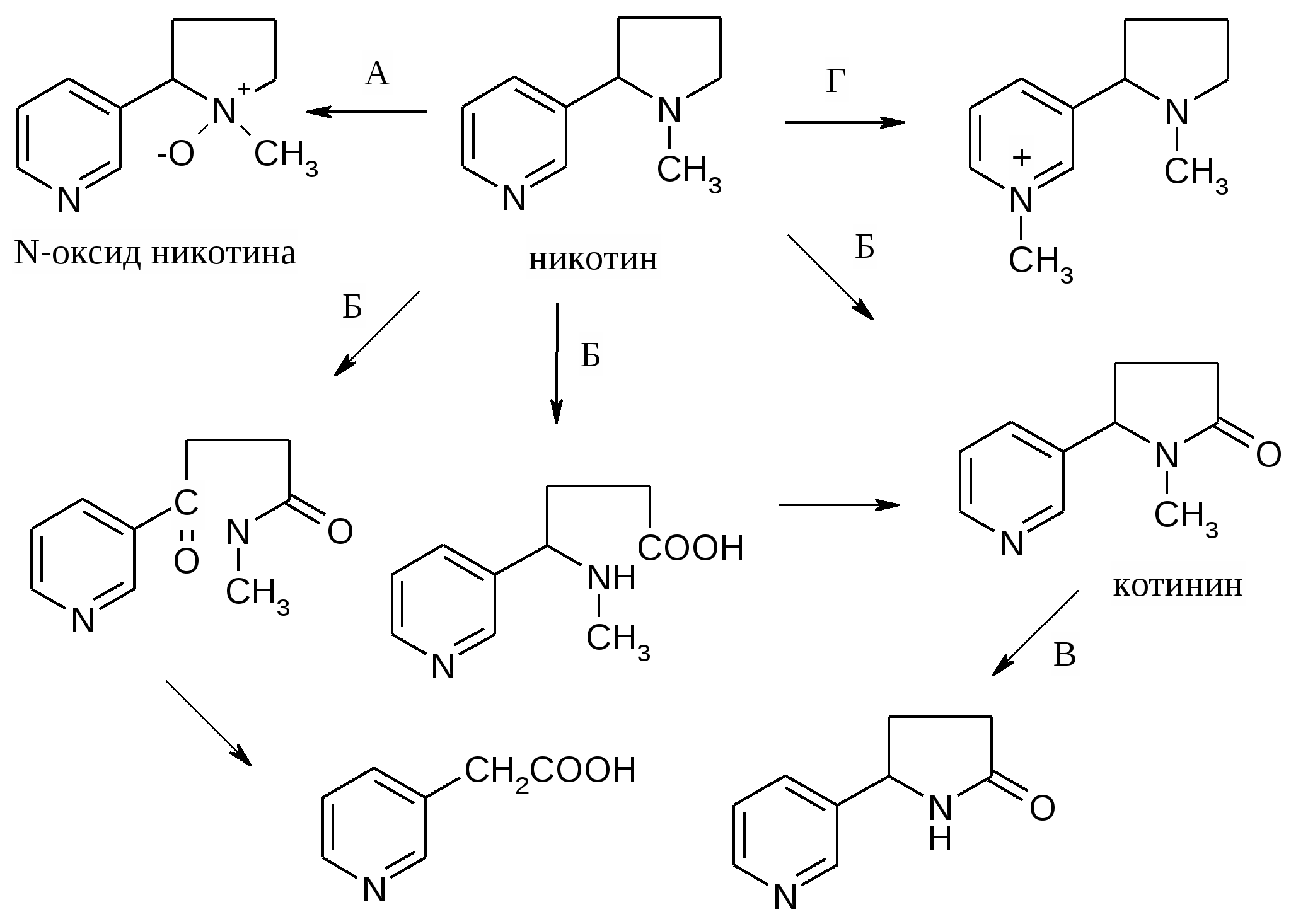 ( схема дана для информации - надо знать, что происходит в бронхах и альвеолах легких и печени при курении! ) Никотин – один из самых ядовитых алкалоидов. Для человека смертельная доза никотина при введении peros составляет 30-40 мг (2 капли чистого никотина, или примерно -200г табака ). Хроническое отравление при курении вызывает привыкание и зависимость от табака ( никотинизм) – разновидность наркомании. Весь цивилизованный мир включился в борьбу с курением. Существует приказ Росздрава о запрещении курения в медицинских учреждениях( клиники, вузы)
При курении табака никотин возгоняется , проникает с дымом в дыхательные пути, всасывается в кровь и действует на ганглии вегетативной нервной системы. В малых дозах – возбуждающе, в больших дозах – вызывает явления паралича. В составе табачного дыма содержится несколько десятков химических соединений в количествах, которые сразу вызывают токсическое действие и еще несколько сотен других органических соединений. катионов металлов, неорганических анионов, которые оказывают токсическое действие при накоплении при хроническом потреблении табака. Противоядием никотину является атропин. Анабазин Отличается от никотина содержанием шестичленного пиперидинового цикла вместо пятичленного N-метилпирролидинового. Состав С10 Н14 N2, бесцветная вязкая жидкость. Содержится в листьях табака, извлекают анабазин из ежовника безлистного ( Anabasisaphylla). Анабазин обладает высокой токсичностью, легко всасывается в желудочно-кишечном тракте, через кожу. По физиологическому действию напоминает никотин, лобелин Содержит два основных центра, образует соли по обоим центрам. При действии алкилгалогенидов образует N- алкиланабазин. пиперидиновый цикл пиридиновый цикл 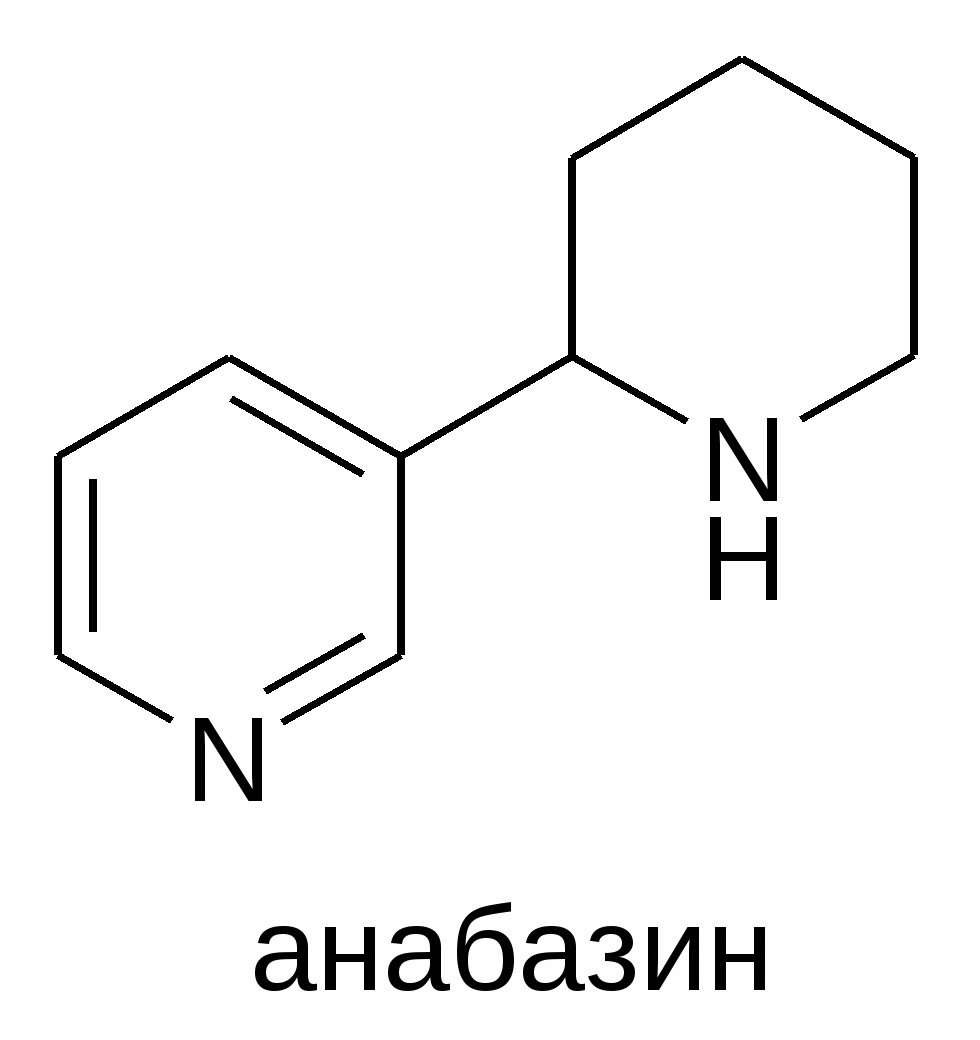 . Хлороводородная соль анабазина( протон присоединяется к более основному атому азота пиперидинового цикла)- средство . помогающее отвыкнуть от курения. Принимают в виде таблеток per os, под язык. Если закурить на фоне приема соли анабазина, возникнет сильная рвота. ( Сравните основность обоих атомов азота и выберите для образования соли наиболее основный центр) Морфин и кодеин Эти два алкалоида целесообразно рассмотреть вместе, т.к. они близки по строению и изучались исторически одновременно. Морфин выделен из опия Сертюрнером в 1806 г, кодеин Робике в 1832 г. Опий- сгущенный сок семенных коробочек различных видов мака. Содержит более десятка родственных алкалоидов. Морфин С17 Н19 N O3 получают из опия – сгущенного млечного сока, вытекающего из надрезов на недозрелых головках снотворного мака. Кодеин С18 Н21 N O3 получают из высохшего на воздухе млечного сока несозревших плодов снотворного мака. Морфин имеет 2 разные ОН группы – фенольную и спиртовую , растворим в щелочах. Кодеин - монометиловый эфир морфина, метилирована фенольная ОН группа, поэтому он не растворим в щелочах. |
